仿生修复技术在口腔颌面部硬组织缺损修复中的应用进展
牛丽娜 焦凯 方明 陈吉华
军事口腔医学国家重点实验室,国家口腔疾病临床医学研究中心,陕西省口腔医学重点实验室,空军军医大学口腔医院,西安710032
口腔颌面部硬组织主要包括牙齿及颌面骨组织,二者密切相连,功能互相支持,共同构成了人类咀嚼、语言和容貌的结构基础,支撑了颌面部外形结构。然而创伤、肿瘤、老龄化等原因,常常导致口腔颌面部硬组织缺损,既影响患者的咀嚼、发音功能,又影响患者的社交与心理健康。因此,口腔颌面部硬组织缺损的修复是关乎国民健康与生活质量的重大科学问题。由于口腔颌面部硬组织的自我修复能力有限,目前主要依靠人工合成的材料对缺损区进行替代性修复。虽然临床上使用的人工合成材料来源广泛,但其理化性能及结构特性与人体硬组织差距巨大,存在免疫排异、材料降解慢、修复性能差等问题,导致修复效果不佳。其根本原因在于这些材料的仿生度较差,从而导致与机体组织整合能力不足[1]。因此,如何对材料结构、功能进行仿生化构建以模拟缺损组织的特征,是制备理想组织缺损修复材料的核心问题。
牙和骨是以矿化胶原为基本结构单元,通过生物矿化形成的,具有多层次有序结构的硬组织。其修复的关键在于与组织结构高度仿生的材料构建[2],因而仿生矿化技术对口腔颌面部硬组织修复具有重要指导意义。近年来随着仿生矿化机制探索逐步深入,硬组织修复技术在不断进步与革新,故本文将对近年来仿生矿化在牙颌面硬组织缺损修复中的研究进展进行介绍。
1 生物矿化及仿生矿化
生物矿化现象在自然界中普遍存在,可将其概括为无机矿物质在生物多重因素共同精确调控下成核、组装及生长的过程。生物矿化主要分为生物诱导矿化和生物控制矿化。前者指生物不直接参加矿化过程,而是通过生物代谢诱导矿物的形成,主要见于藻类等低等生物。生物控制矿化则指生物对矿物的形成起到直接程序化调控作用,所形成的矿物往往呈现高度有序性。本文中所提到的牙、骨组织的形成过程主要涉及生物控制矿化[3]。生物体内的矿物与有机大分子选择性结合,形成了精妙的多级有序结构。这种结构特性赋予生物矿物优异的机械性能,并为人工材料的合成提供了设计思路和模仿典范。仿生矿化则是受生物矿化机制的启发,通过人工方法在体外合成具有类似生理结构层次及相应功能的复合材料,以期为硬组织缺损提供优良修复策略。同时仿生矿化的体外模型也被反过来用于揭示生物矿化的本质,进一步推动了生物矿化的研究进展。二者相辅相成,共同推进了硬组织仿生修复的发展进程。
2 口腔颌面部硬组织仿生修复
2.1 牙体硬组织仿生修复
龋齿是牙体硬组织最好发的病损之一,其主要病理过程为致龋菌与食物残渣相作用产生酸性物质,引起牙齿脱矿。当牙齿脱矿速度大于再矿化速度时,牙体硬组织的有序结构便会受到破坏,从而形成龋坏。目前临床上修复龋齿主要通过复合树脂材料对龋洞进行充填。然而树脂修复材料与牙齿组织间密合性差,易形成边缘微渗漏引起继发龋,远期修复效果不佳。因此通过仿生矿化技术,于受损牙体表面形成一层与原有牙体组织结构相近的修复层,对于治疗及预防龋齿发展具有重要临床意义。
2.1.1 釉质仿生修复 位于牙齿最外层的釉质是应对龋坏的第一道防线,龋齿往往始发于釉质层(根面龋除外),继而向深部的牙本质发展。因此,釉质的仿生修复在预防早期龋进展中至关重要。釉质的结构特征为成捆针状羟磷灰石晶体(hy‐droxyapatite,HAP),其矿化形成过程中可概括为,以釉原蛋白为首的釉质基质蛋白稳定钙磷离子,形成无定形磷酸钙(amorphous calcium phos‐phate,ACP),即矿化前体,之后由ACP组装形成高度有序排列的HAP[4]。因此,对釉质仿生修复的一个关键策略是通过釉质基质蛋白或其模拟物诱导脱矿釉质再矿化。有学者[5]在体外利用釉原蛋白诱导磷酸钙矿化,形成的HAP 与釉质结构类似。此外,有一些多肽拥有与釉原蛋白相似的功能。P11-4 是一种体外设计出的小分子肽段,可扩散至龋损深层,并自组装形成具有类似釉质基质表面特征的三维支架。P11-4 自组装后表面呈负电荷,具有潜在的钙离子结合位点,可用于控制HAP 的沉积与晶体生长[6],多项研究[7-9]证实,P11-4具备优异的再矿化效果。然而上述分子在纯化、储存等方面存在困难,限制了其临床转化及应用。一些高分子聚合物亦具备诱导矿化的能力,这吸引了学者们的广泛关注。例如聚酰胺[poly(amidoamine),PAMAM],它是一种体外合成的树枝状大分子,模拟了釉原蛋白的结构与功能,可作为调控HAP 合成的模板[10]。PAMAM 可经多种官能团修饰,例如天冬氨酸、硬脂酸、磷酸二甲酯等。经过修饰,PAMAM具备与釉原蛋白相近的组装功能,诱导HAP 取向生长[11]。PAMAM 诱导的再矿化深度可达100 μm,解决了龋损部位深层难以再矿化修复的难题[12]。
除了模仿釉质矿化中釉原蛋白的作用外,另有学者[13-14]直接通过矿化前体ACP对脱矿釉质进行再矿化。常规ACP 的状态不稳定,易形成沉淀,难以储存,于是学者们利用稳定剂维持ACP 的稳态从而解决了这一困难。例如酪蛋白磷酸多肽(casein phosphopeptide,CPP),这种多肽具有大量的酸性基团,可以与钙离子等矿物质结合,稳定ACP 并形成CPP-ACP 复合体。稳定后的ACP 可沉积于牙体结构上,实现脱矿釉质层的再矿化[15-16]。CPP-ACP处理后的病变釉质表面粗糙度显著降低,显微硬度明显提高,有助于修复釉质龋并延缓病变的发展[15]。
然而上述研究中所产生的再矿化层与原釉质间存在分离界面,未能达到真正意义上的“釉质修复”。为解决此难题,学者们从生物矿化的机制中寻求答案。在硬组织发育过程中ACP 常与晶体紧密结合形成矿化前沿界面,若能模拟这一过程,将对釉质仿生修复有重要指导意义。磷酸钙离子团簇可形成矿化前体层,很好地模拟了自然界硬组织发育中的结晶-非晶态边界,并能够诱导釉质HAP 晶体的外延生长,在脱矿釉质表面成功地形成了2~10 μm的新生釉质层,且与原釉质层间未见明显分离界面及缝隙,实现了釉质晶格的连续外生修复[17]。此种修复方法不仅恢复了脱矿釉质的结构,还将釉质的机械性能,例如硬度、弹性模量、耐摩擦系数等,也恢复至正常釉质水平[17]。
上述研究使得釉质再矿化修复领域取得了突破性进展,牙齿修复方法也将向更微创、修复效果更佳的方向行进。
2.1.2 牙本质再矿化 当龋坏发展突破釉质,进入牙本质层后,患者将出现明显临床症状。且牙本质暴露后,食物残渣、细菌及其代谢产物易侵入牙本质内部,难以清理。针对牙本质龋,目前材料粘接充填是唯一的治疗方法。但在传统牙本质粘接体系中,酸蚀过程会使牙本质胶原纤维内外的矿物质同时丧失,引起牙本质网塌陷,导致树脂无法渗入纤维内部,形成界面渗漏。并且脱矿胶原更易在胶原酶的作用下发生降解,进一步导致粘接界面退变。因此,牙本质粘接的长期有效性面临着严峻考验。若能克服这一难题,牙本质龋的修复将取得重大突破。在此方向,研究者们通过仿生矿化进行牙本质仿生修复,以期重构牙本质并增强其耐酶解作用,从而达到提高树脂牙本质粘接耐久性的目的。
在牙本质矿化过程中,非胶原蛋白(non-col‐lagenous proteins,NCP)起到至关重要的作用,可稳定ACP 并诱导纤维内矿化。故学者们由此入手,使用NCP 的仿生类似物,如牙本质磷蛋白模拟肽、聚天冬氨酸等聚阴离子,稳定钙磷离子形成ACP,或直接使用ACP 回填到脱矿的牙本质胶原中,完成牙本质的再矿化[18-19]。利用上述技术,成功地实现了树脂粘接界面脱矿牙本质及龋坏脱矿牙本质中裸露胶原的再矿化,不仅提高了树脂牙本质粘接界面的机械性能,还有效防止了胶原的降解和继发龋的发生。并且,这种具备牙本质再矿化性能的粘接剂粘接强度同市售粘接剂相当[18,20]。同时,利用纳米介孔硅控释系统作为液相矿化前体的载体[21],将其作为纳米填料添加于粘接剂中,使得矿化前体在裸露胶原区原位缓慢释放,促进了粘接界面再矿化。该复合材料的应用可有效地阻断牙本质小管,抗酸稳定性好,且不影响牙本质与自粘接系统之间的即时粘结强度。该技术解决了仿生钙化技术应用中液相矿化前体原位输送困难的问题,进一步推进了牙本质再矿化修复的临床转化[22]。
虽然釉质及牙本质仿生矿化修复已取得巨大进展,如表1、2 所示。然而目前,各研究组使用的牙体组织再矿化研究模型多为牙齿磨片而非整颗牙齿,那么上述技术对牙齿整体的再矿化效果如何?并且口腔环境复杂,存在大量细菌及生物膜,是否会对影响材料对牙体组织的再矿化效果?后续的牙体硬组织仿生矿化实验研究应更加关注临床效果,推进从实验室到临床应用的转化进程。
2.2 骨组织仿生修复
颌面部骨组织承担着多项重要生理功能,然而创伤、肿瘤、炎症等因素常导致颌面部骨组织缺损。骨缺损修复效果最佳的方法是自体骨移植,但存在来源有限、手术痛苦大等问题。而异体骨移植又存在排异反应和细菌、病毒感染等风险。因此,人工合成的骨修复材料或将是未来的临床发展趋势。虽然目前临床上人工合成材料来源广泛,但存在生物活性和机械性能较差、血管化程度低、与机体整合速度慢、成骨性能不足等问题,难以获得满意的临床疗效[25]。归根究底是因为这些材料的仿生度较差,只模拟了骨组织的基本成分,而未能准确模拟骨组织的微观和宏观结构特征。如何同时实现骨修复材料在结构和功能上的仿生,是骨缺损修复领域亟待解决的难题。

表1 釉质再矿化修复总结Tab 1 Remineralization of enamel

表2 牙本质再矿化修复总结Tab 2 Remineralization of dentin
2.2.1 结构仿生 天然骨组织是一种具备高度有序纳米结构基础与宏观结构基础的无机-有机复合材料。理想的骨缺损修复材料,应具备与骨相似的结构特性。Hu 等[26]模拟骨组织的有机-无机组成,合成了细菌纤维素/HAP 纳米复合材料。该复合材料既具备HAP 的生物相容性又具备纤维素优良的机械性能,与天然骨的性能相接近。学者[27-29]在体外通过聚阴、阳离子稳定矿化前体,成功构建出纤维内仿生硅化、钙化及杂化材料,同时模拟了天然骨组织的纳米结构和宏观结构,在不同类型的骨缺损模型中均显示出良好的修复效果,且该仿生矿化材料可释放活性成分,并通过调控单核细胞的分泌功能促进成骨成血管过程的耦合,从而加速骨缺损的修复。
然而上述材料一般为在体外构筑矿化好后,再移植到体内进行骨修复,在此过程中存在材料脆性较大不易塑形等问题。为解决这一难题,学者[30]从矿化前体入手,利用磷酸钙聚合物液态前体纳米簇,进行骨缺损的修复。这种液相前体呈粘稠状态,具有流动性等特点,可以注射到局部。将其注射到骨质疏松的骨腔,可完全修复疏松的骨组织。传统仿生矿化策略常在钙磷溶液中添加大量聚阴离子以模拟NCP,从而达到稳定钙磷离子形成无定形矿化前体的效果。然而这种额外添加聚电解质的方式在体内应用中难以实现,且大量游离的阴离子会对周围组织产生毒性,其生物相容性差成为了临床转化的又一大难题。基于此,学者[31]模拟非胶原蛋白与胶原纤维间的关系,直接将高分子量聚丙烯酸交联于胶原上,其所诱导出的矿化效果可与传统仿生矿化策略相媲美,且交联后的胶原韧性好,生物相容性更佳,同时解决了材料不易塑形、聚电解质原位输送困难、组织相容性差这三大问题。
2.2.2 功能仿生 骨组织矿化形成的过程需要多种细胞共同参与,因此学者们在支架材料上引入生物活性物质,构建出功能仿生的骨修复材料,可刺激成骨微环境,达到加速骨组织矿化修复的目的。
诸多学者采用微小RNA 缓释递送系统实现了仿生骨修复材料的成骨功能强化。例如通过将RNA、纳米多聚物微球附着在无细胞的纳米纤维聚合物支架上,在空间上控制miR-26a的释放,并进一步通过靶向激活内源性干细胞的成骨活性,在不依赖外源性细胞的条件下有效解决大面积骨缺损与骨质疏松骨缺损修复的难题[32]。以外泌体为基础构建无细胞组织工程化骨,通过加载含有生物抗炎因子和miR-10a的纳米微球,同时实现了抗炎与骨再生,在小鼠牙周炎模型中取得了良好成效[33]。这种加载了生物活性分子的功能性骨修复材料,可以明显缩短成骨时间并同时提高骨再生质量,为攻克多项骨缺损修复难题提供了思路。
新骨再生常与神经血管的再生并行,因此,促成血管化和成神经化在骨缺损的功能性修复中至关重要。在骨缺损修复材料的促成血管改性方面,学者[34-35]提出了使用孔道/多孔复合结构支架材料预植内皮细胞共同实现大块支架“整体快速血管化”的设计思路,其创建的细胞与因子复合微组织的磁场精确控制构建技术,可显著提高功能化骨缺损修复材料的血管化骨再生效果。另外。该团队[36]还利用多种生物活性因子,对骨缺损修复材料进行修饰,提高了材料的骨诱导活性。并且构建出的可注射功能化蚕丝水凝胶既具备良好的生物降解性,又具备优良的促血管和成骨性能,可用于不规则骨腔的修复[37]。此外,通过梯度孔径、掺锶、低氧诱导等促进材料血管化,利用神经营养因子、miR-222等促进材料神经化,构建出了功能性组织工程骨,在骨缺损修复效果上取得卓越成效[38]。通过上述学者的研究,构建出了高活性、功能仿生的骨修复材料,为加速颌面部骨修复奠定了基础。
虽然上述两种骨组织的仿生修复策略都取得了良好的修复效果(表3),但二者都存在着相应的问题。首先,结构仿生的骨修复材料制备时常需采用聚电解质等化合物,其生物相容性及生物诱导性同生物活性物质相比略有不足。而功能仿生的骨修复材料常需要生物活性物质的加入,其制备复杂,成本较高,不易储存及商品化生产。若能结合二者优势,找到一种生物体内存在、易于大量生产、且可增强修复材料成骨性能的物质,将会为骨缺损修复材料的研发带来重大突破。值得注意的是,颌面部骨组织承重少,形态多样,需要个性化的修复。3D 打印为材料的形状塑造提供了良好的技术支撑,上述结构仿生及功能仿生的骨修复理念可与3D 打印技术结合起来,为患者提供个性化的颌面骨修复材料[39]。但目前对上述骨缺损修复材料构建时,通常先通过3D 打印,打印出支架,之后再对支架进行相应的修饰,操作繁琐,耗时较长。如何在打印骨修复材料支架的同时对其进行修饰,将“两步走”合为“一步走”,减少材料生产周期,这需要我们进一步探索。
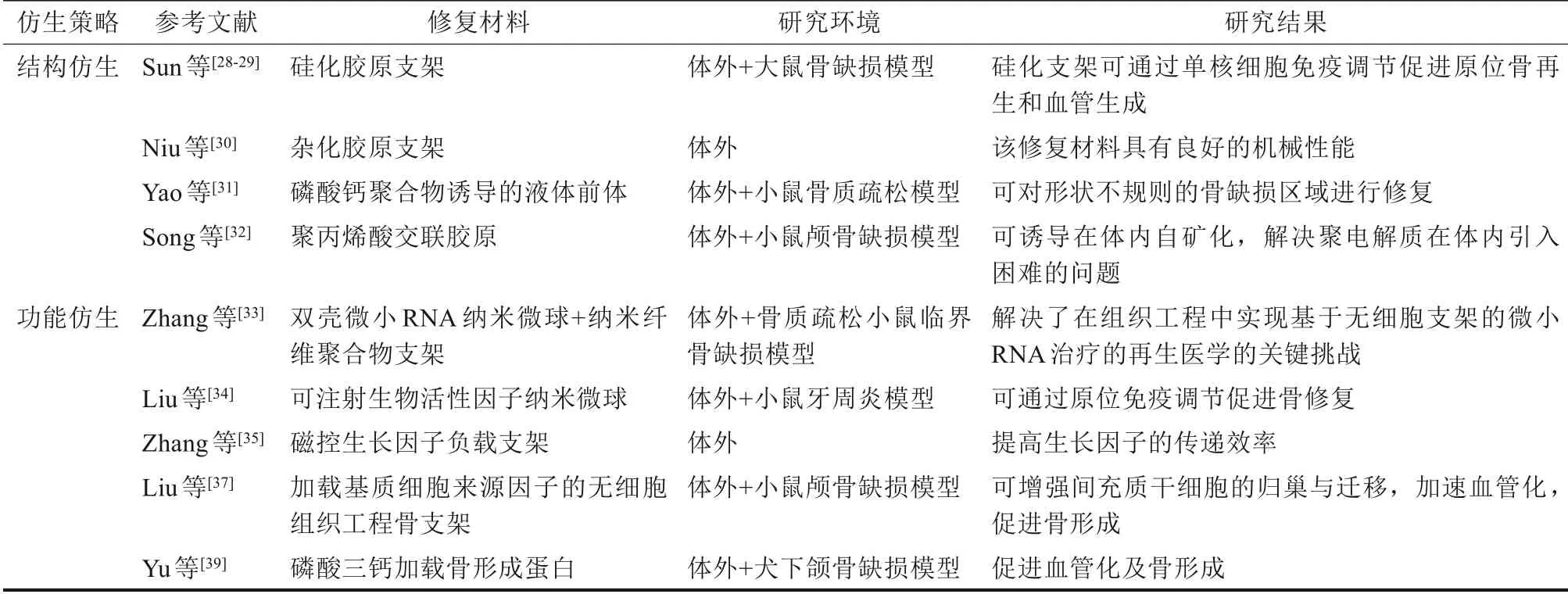
表3 骨组织的仿生修复总结Tab 3 Biomimetic restoration of bone defect
3 结论与展望
口腔颌面部硬组织缺损会对患者造成心理及生理上不可估量的伤害,为响应“健康中国”的号召,解决好硬组织缺损修复这一难题对国民健康至关重要。由于硬组织本身是自然生物矿化的产物,所以从生物矿化过程中入手,衍生出仿生矿化技术,并形成材料、理论反作用于生物矿化体系,是实现口腔颌面部硬组织缺损修复的理想途径。近些年来,随着矿化理论的发展,形成了很多新技术,在硬组织修复领域取得了重要突破,然而大部分研究仍局限于体外阶段。随着对矿化机制更全面深入的认识,仿生理论从体外化学物质走向体内生物体系的转化步伐也会逐渐加快。
利益冲突声明:作者声明本文无利益冲突。

