Dickkopf 相关蛋白 3在造影剂急性肾损伤中的应用价值分析
杨 峰,胡晓娟,邢 建,赵铁男
0 引言
Dickkopf相关蛋白3(Dickkopf-related protein3,DKK3)是近年来发现的应激性肾小管源性间质纤维化的生物标志物[1],尿DKK3浓度的升高可能提示慢性肾脏疾病(Chronic kidney diseases,CKD)进展的高风险,这种关联在Zewinger 等[2]的STOP-IgAN试验中得到证明。同时,有研究发现,在接受心脏手术的患者中,术前及术后尿DKK3浓度的检测对患者术后急性肾脏损伤(Acute kidney injury,AKI)的发生有预判价值[3],能够识别术前通过临床干预措施受益的人群。这项研究的结果也提出了一个问题:DKK3能否预测其他临床诊疗过程中的AKI风险?随着医学影像成像技术的发展,含碘造影剂的使用更加广泛,造影剂导致的急性肾损伤(Contrast-induced acute kidney injury,CI-AKI)/造影剂肾病(Contrast-induced nephropathy,CIN)的发病率也不断升高,对临床患者的预后相当不利,少数严重患者甚至可进展为慢性肾脏衰竭(Chronic kidney failure,CKF)[4]。但CI-AKI多数本身属自限性,大多可在短期内恢复,对肾功能的影响也比较轻微[5],因此,对比剂诱发AKI可作为研究DKK3是否能够预测肾小球滤过率(GFR)轻度损伤的合适模型。本研究收集了2019年9月至2020年10月我院收治的640例冠状动脉造影或CTA患者的资料,分析了接受冠状动脉造影或CTA的患者尿DKK3浓度与术后发生CI-AKI之间的关系,探讨DKK3对冠心病患者造影术后并发AKI的早期临床诊断价值。
1 资料与方法
1.1 临床资料 选取沈阳医学院附属中心医院2019年9月至2020年10月收治的640例冠状动脉造影或CTA患者作为研究对象。纳入标准:有冠状动脉造影或CTA适应证的患者,CI-AKI阳性患者按照诊断标准[6]入组。患者知情同意并签署同意书,获得沈阳医学院附属中心医院医学伦理委员会的批准和监督。排除标准为严重低血压(如心源性休克)、梗阻性尿路病变及肿瘤、根据KDIGO标准[7]已存在的CKD;既往对碘造影剂过敏患者;近期(14 d内)使用肾脏毒性的药物(顺铂类西药、头孢等);7d内行增强 CT或磁共振等应用造影剂的检查;凝血功能异常疾病如狼疮、良恶性肿瘤等;合并肝硬化、肝癌等严重肝功能受损的患者;各种生物指标结果及临床资料缺如者。
1.2 方法 640例冠状动脉造影或CTA患者,检测患者术前24 h和术后48~72 h的尿DKK3、微量白蛋白及肌酐水平,观察造影剂肾病发生情况。在碘造影剂使用前(4 h)和造影后(24 h)充分水化,最大补液量100 ml/h。在冠状动脉造影和最终血浆扩容前24 h,采集尿液样本。碘造影剂使用72 h后,采集第2份尿液样本。对2份尿液样本进行DKK3、微量白蛋白和肌酐浓度检测。GFR采用MDRD公式计算,AKI定义参照急性肾脏损伤网络(AKIN)标准[7]。患者保持空腹8 h以上,留取清晨中段尿液样本10 ml,使用自动生化分析仪及相应的检测试剂盒。根据manufacturer方案和相关文献[8-9],尿中DKK3浓度采用酶联免疫吸附试验(ELISA)进行检测。微量白蛋白通过浊度法检测(ALBU2,Roche Diagnostics),肌酐通过酶法测定(CRE2U,Roche Diagnostics)。
1.3 统计分析 采用SPSS 24.0软件进行统计分析,计数资料用百分率表示,进行卡方检验,其他资料数据进行Spearman相关分析,并以中位数和四分位数表示。采用U检验对数值资料的组间差异进行无参数统计显著性检验,确定尿DKK3/肌酐比值预测CI-AKI(曲线下面积[AUC])的准确性。Logistic回归检验进行相关性分析。模型的一致性统计结果表示为AUC,P<0.05认为差异有统计学意义。
2 结果
2.1 CI-AKI和非CI-AKI组人群分布特征 640例患者在冠脉造影或CTA后48~72 h接受随访检查。其中男363例,女277例,年龄56~72岁,中位年龄65岁。eGFR为56~74 ml/min,中位eGFR为77.8 ml/min。主要伴随疾病为高血压(77.6%)、冠心病(63.8%)和糖尿病(30.4%)。5例尿DKK3评估未成功,16例冠状动脉造影后随访尿液资料缺失,所见样本人口资料特征见表1。
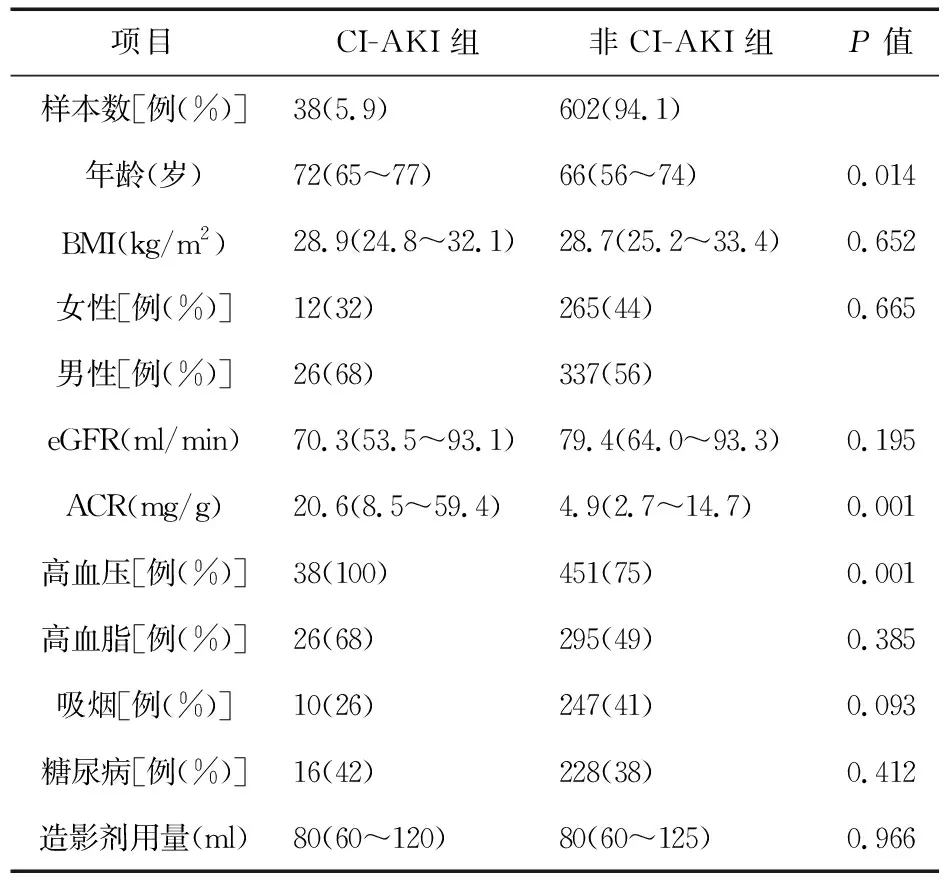
表1 CI-AKI和非CI-AKI组人群资料特征
2.2 造影剂肾病的相关因素分析 CI-AKI患者38例(5.9%),3例(0.5%)为AKIN II期,35例(5.5%)为AKIN I期。静脉应用造影剂后,CI-AKI患者术前尿DKK3/肌酐比值比无CI-AKI患者高3.2倍[7.9 pg/mg (IQR 1.4~1 275.0)vs.1.9 pg/mg (IQR 0.9~168.0),P<0.05]。ROC曲线分析评估尿DKK3/肌酐检测CIN的准确性,AUC为0.62(95%CI0.48~0.74);灵敏度为48.1%,特异度为71.3%。CI-AKI患者尿微量白蛋白/肌酐比(ACR)是其他患者的4倍[20.6 mg/g (IQR 8.5~59.4)vs.4.9 mg/g (IQR 2.7~14.7),P<0.05]。微量白蛋白和肌酐比值(ACR)与DKK3的乘积得出AUC为0.66 (95%CI:0.56~0.77)。DKK3·ACR的敏感性为58.3%,特异度为73.6%。使用DKK3/肌酐、白蛋白/肌酐、eGFR、年龄和高血压等参数建立CIN发生的logistic回归模型,AUC为0.77 (95%CI:0.72~0.81)。见表2。

表2 不同指标在诊断CI-AKI中的价值
3 讨论
肾脏生物标志物DKK3此前已被证明是心脏手术后AKI的一个独立预测因子[10]。本研究收集了沈阳医学院附属中心医院2019年9月至2020年10月收治的640例冠状动脉造影或CTA患者的资料,探讨了DKK3在冠状动脉造影或CTA背景下发生CIN的预测价值。研究发现,640例病例,CI-AKI的发生率为5.9%。美国国家心血管数据登记(NCDR) Cath-PCI登记显示,总体CI-AKI发病率为7.1%,其中0.3%需要透析[11]。此后,NCDR Cath-PCI注册表的其他研究也表明,CI-AKI的发病率为7%~8%[12-13]。本研究CI-AKI的发生率低于上述文献报道,可能与本研究的样本量较小有关。在患者尿DKK3浓度与术后发生CI-AKI之间关系的研究中,本研究发现,受试者DKK3与肌酐的比值在CI-AKI和非CI-AKI组间存在3.2倍的差异。DKK3浓度在无临床显性CKD和易发生CI-AKI的受试者中均显著升高。因此,DKK3可能有助于识别高风险AKI的受试者,但本研究得出的AUC为0.62的预测准确性还达不到临床实践要求。文献报道ACR对心脏术后AKI的预测灵敏度为76.0%,特异度为79.1%[14],而DKK3与肌酐的比值对CI-AKI的预测准确率仅为48.1%,特异度为71.3%。本研究的人群特征显示,与使用造影剂后未出现肾功能损害的患者相比,CI-AKI患者均有高血压病史,我们将高血压纳入回归分析,得出AUC为0.77的结果。该指标预测CI-AKI比预测心脏手术预后的准确性低的原因可能是有5.5%的受试者表现为AKI I期,而在整个研究对象中没有III期AKI患者,说明干预措施的伤害程度越低,生物标志物的鉴别能力就越低,因此,DKK3可作为发生CIN的首选检测指标之一。
目前,对DKK3研究关注的热点主要是探讨DKK3在心脏造影背景下对AKI的预测价值,随着研究的逐步深入,未来有望通过深入研究来判断能否通过监测DKK3降低AKI的发生率,同时使用白蛋白/肌酐和DKK3/肌酐2个指标是否能够在一定程度提高检验效能。DKK3具有促纤维化的特性,通过调节典型的Wnt/b-catenin信号通路,促进肾小管间质纤维化[15]。在临床研究中,尿DKK3水平的升高可确定患者存在处于短期CKD进展的高风险,而与肾脏疾病的原因、基线肾功能和蛋白尿无关[16]。本文的研究结果显示,应用造影剂后,患者的DKK3/肌酐比值增加,独立于AKI的发生。推测尿DKK3的高比值反映了亚临床肾损伤,DKK3的急性增加是否意味着肾功能长期恶化的风险增加,需要后续研究来探讨。
除了使用造影剂或心脏手术外,还有药物和其他临床治疗能导致AKI风险的增加。目前的研究结果表明,即使没有蛋白尿或GFR受损,DKK3也可以作为鉴别肾小管损伤患者的有用的辅助手段[17-18]。2005年,美国肾脏病学会呼吁对肾脏生物标志物进行识别和鉴定,以提高AKI的预防和管理水平,中性粒细胞明胶酶相关脂钙蛋白(NGAL)、肾损伤分子-1 (KIM-1)及金属蛋白酶组织抑制因子2·胰岛素样生长因子结合蛋白7 (TIMP-2·IGFBP7)等被广泛研究[19],但临床实际应用却不尽人意。因此,未来更多的研究将体现在探讨DKK3在CKD和AKI的预后评价效能方面。

