叶施有机硒对银杏叶总黄酮含量的影响
肖 贤,李 丽,李琳玲,,查三省,袁红慧,邓 坤,程水源,程 华,
(1.武汉轻工大学 生物与制药工程学院,湖北 武汉 430023;2.经济林木种质改良与资源综合利用湖北省重点实验室/黄冈师范学院,湖北 黄冈 438000)
银杏(GinkgobilobaL.)叶具有重要的药用价值,其中主要的活性成分是银杏黄酮[1]。在医药上,黄酮类化合物对预防和治疗早期阿尔茨海默氏病、动脉粥样硬化、脑梗死和其他神经系统疾病具有特殊效果[2]。因此,银杏叶总黄酮含量是衡量银杏叶及相关药用制剂品质的重要指标[3]。在植物中,黄酮类化合物是多酚类物质的次级代谢产物,是植物组织中重要的一类抗氧化剂。黄酮类化合物在植物生长发育、防御和适应环境胁迫中发挥重要作用。
硒(Se)是人体必需的微量元素,也是植物的有益元素[4-6]。研究表明,在各种生物和非生物胁迫下,低浓度硒能显著提高植物的光合速率,增加生物量,降低重金属胁迫对植物的损伤作用[7-9]。陈火云等[10]研究发现,施硒处理可促进油菜生长,增加籽粒中硒含量并且减少重金属镉的积累。李飞等[11]综述了硒肥对茶树的影响,对富硒茶品质提升具有一定的借鉴意义。王政等[12]研究表明,有机硒肥与硼肥配施能改善烟叶品质,提高烟叶硒含量。在正常栽培条件下,适当浓度的硒处理也能提高农作物各组织中黄酮和酚类物质的含量[13-14]。
关于硒肥对银杏叶黄酮含量的影响研究,国内外报道较少,相关研究主要集中于无机硒处理对银杏初生代谢和次生代谢的影响。陈军[15]研究表明,低浓度亚硒酸钠处理可有效促进银杏幼苗生长,显著提高叶片黄酮和萜内酯含量。研究发现,亚硒酸钠叶施和根施处理均能促进银杏幼苗生长并提高叶片黄酮含量,低浓度无机硒对银杏叶黄酮合成的影响与黄酮代谢相关基因PAL(苯丙氨酸解氨酶基因)、CHS(查尔酮合成酶基因)、FLS(黄酮醇合成酶基因)和FOMT(类黄酮O-甲基转移酶基因)等的表达量升高有关[16-17]。而有机硒处理对银杏的影响尚未见报道,而且有机硒因具有毒性小、环保、易被人体吸收等特点,极具研究价值。鉴于此,基于前期提高银杏叶黄酮含量的栽培措施研究成果[18],结合磷酸二氢钾[19]和矮壮素[20],探讨叶施有机硒肥影响银杏黄酮合成的生理和分子机制,为有效利用硒肥提高银杏叶药用品质奠定理论基础,并为富硒地区银杏种植业的健康发展提供技术支持。
1 材料和方法
1.1 试验材料
试验于2019年6月在湖北恩施白杨坪银杏种植基地进行,选择生长健康且长势一致的4年生银杏幼苗作为试材。有机硒(硒含量≥155 μg/g)购自宝来化肥(烟台)有限公司,矮壮素(≥98%)购自北京索莱宝科技有限公司,磷酸二氢钾(≥99%)购自河北硅谷肥业有限公司,槲皮素、山柰酚和异鼠李素标准品购自上海源叶生物科技有限公司。
1.2 试验方法
1.2.1 材料处理 待4月银杏新叶长出后,将用于试验研究的所有幼苗叶面喷施3.335 g/L磷酸二氢钾溶液,每处理(120株)喷施5 L,以促进银杏生长。
试验共设置7个叶施处理:无肥(对照),记为CK;有机硒(0.835 g/L),记为T1;低浓度矮壮素(1 g/L),记为T2;高浓度矮壮素(2 g/L),记为T3;低浓度矮壮素(1 g/L)+有机硒(0.835 g/L),记为T4;高浓度矮壮素(2 g/L)+有机硒(0.835 g/L),记为T5;磷酸二氢钾(3.335 g/L)+有机硒(0.835 g/L),记为T6。
2019年6月1日对银杏进行第1次叶施处理,除CK外,分别记为1-T1、1-T2、1-T3、1-T4、1-T5、1-T6,每种处理选择1列共120株银杏幼苗,设置成3个区块(重复);2019年7月14日将第1次处理的每列银杏选择半列共60株进行第2次叶施处理,除CK外,分别记为2-T1、2-T2、2-T3、2-T4、2-T5、2-T6,同样也设置成3个区块(重复)。从2019年6月15日开始采样,每15 d左右进行1次采样,2019年9月15日完成最后1次采样。采集的银杏叶一部分液氮处理后保存于-80 ℃冰箱,另外一部分置于恒温干燥箱中105 ℃杀酶20 min,65 ℃烘干至恒质量,用粉碎机粉碎,做好标记保存于阴凉干燥处[21],用于检测银杏叶总黄酮含量。
1.2.2 总黄酮含量检测 银杏总黄酮(Total flavonoids,记为F)的主要成分为槲皮素(Quercetin,记为Q)、山柰酚(Kaempferol,记为K)和异鼠李素(Isorhamnetin,记为I),F含量以Q、K、I含量总和乘以转化系数2.51表示[22]。Q、K、I、F含量以mg/g表示。所有样品均按照生物学重复测定3次。Q、K、I含量采用高效液相色谱(HPLC)法测定,参考任红等[22]试验方案稍作修改。用分析天平准确称取银杏叶粉末1 g于250 mL圆底烧瓶中,加入体积比为4∶1的甲醇-25%盐酸溶液80 mL并称质量,80 ℃冷凝回流45 min。回流结束后用色谱级甲醇补足减少的溶液,趁热抽滤,取滤液用0.45 μm滤膜过滤,即得供试品溶液。
1.2.3 部分样品总RNA提取及转录组测序分析 根据1.2.2中总黄酮含量的测定结果,选取总黄酮含量差异较大的1-T1、2-T1、1-T5、2-T5及CK作为供试处理,6月15日、6月30日、7月14日、8月1日、8月15日、8月31日和9月15日每个处理分别采集5 g叶片样品,液氮冷冻后放置于-80 ℃备用。银杏叶片总RNA提取方法参考程水源等[23]的方法略作改进。样品总RNA转录组测序工作及后期数据分析交由北京诺禾致源生物科技有限公司代为完成。将差异表达基因分别与COG (Cluster of orthologous groups of proteins)、GO (Gene ontology)、KEGG (Kyoto encyclopedia of genes and genomes)、Swiss-Prot (Swiss-protein)和NR (Nun-redundant)数据库进行比对,并对相关基因的功能、类别、代谢通路富集情况等进行注释。分别对银杏黄酮代谢途径中PAL、肉桂酸4-羟化酶(C4H)、4-香豆酸辅酶A连接酶(4CL)、CHS、查尔酮异构酶(CHI)、异黄酮合成酶(IFS)、黄酮合成酶(FS)、黄烷酮3-羟化酶(F3H)、FLS、柚皮素2-氧戊二酸3-双加氧酶(FL3H)、槲皮素O-甲基转移酶(OMT)、类黄酮3′, 5′羟化酶(F3′5′H)等基因的表达量进行分析,采用FPKM (Fragments per kilobase of transcript per million fragments mapped)作为衡量转录本或基因表达水平的指标[24]。
1.3 数据处理与分析
利用Microsoft Excel软件和DPS数据处理系统进行数据处理,所有数据用平均值±标准误(Mean±SE)表示,采用Duncan’s新复极差法进行差异显著性分析(P<0.05),采用Origin软件绘图。
2 结果与分析
2.1 叶施有机硒、矮壮素和磷酸二氢钾对银杏叶黄酮含量的影响
2.1.1 叶施1次 由图1可见,第1次叶施处理后,6月15日,与CK相比,1-T2处理银杏叶槲皮素和异鼠李素含量显著提高,山柰酚和总黄酮含量也有所提高;1-T3处理银杏叶槲皮素含量显著提高,山柰酚、异鼠李素和总黄酮含量也有所提高;1-T1、1-T4、1-T5、1-T6处理银杏叶槲皮素、异鼠李素和总黄酮含量显著降低。其中,1-T2、1-T3处理银杏叶总黄酮含量分别为16.610、16.954 mg/g,分别比CK提高了9.64%、11.91%。
由图2可见,第1次叶施处理后,6月30日,与CK相比,1-T1处理银杏叶槲皮素、山柰酚、异鼠李素和总黄酮含量均显著提高;1-T2、1-T3、1-T4处理银杏叶槲皮素、山柰酚、异鼠李素和总黄酮含量差异均不显著;1-T5处理银杏叶山柰酚、异鼠李素和总黄酮含量均显著提高,槲皮素含量也有所提高;1-T6处理银杏叶山柰酚含量显著提高,槲皮素、异鼠李素、总黄酮含量差异不显著。其中,1-T1、1-T5处理总黄酮含量分别为19.181、17.167 mg/g,分别比CK提高36.71%、22.36%。
不同字母表示处理间差异显著(P<0.05),下同Different letters indicate significant differences amongdifferent treatments(P<0.05),the same below图1 1次喷施处理后6月15日银杏叶黄酮含量Fig.1 The flavonoid content of Ginkgo biloba leaves on June 15th after foliar sprayed once

图2 1次喷施处理后6月30日银杏叶黄酮含量Fig.2 The flavonoid content of Ginkgo biloba leaves on June 30th after foliar sprayed once
由图3可见,第1次叶施处理后,7月14日,与CK相比,1-T1处理银杏叶槲皮素、山柰酚、异鼠李素和总黄酮含量差异均不显著;1-T2处理银杏叶山柰酚含量和总黄酮含量显著提高;1-T3处理银杏叶异鼠李素含量显著提高,槲皮素、山柰酚和总黄酮含量也有所提高,但差异不显著;1-T4处理银杏叶槲皮素、异鼠李素和总黄酮含量显著降低;1-T5处理银杏叶槲皮素、山柰酚、异鼠李素和总黄酮含量均显著降低;T6处理银杏叶异鼠李素、槲皮素、山柰酚和总黄酮含量差异不显著。其中,1-T2、1-T3处理银杏叶总黄酮含量分别为15.778、14.741 mg/g,分别比CK提高18.52%、10.73%。

图3 1次喷施处理后7月14日银杏叶黄酮含量Fig.3 The flavonoid content of Ginkgo biloba leaves on July 14th after foliar sprayed once
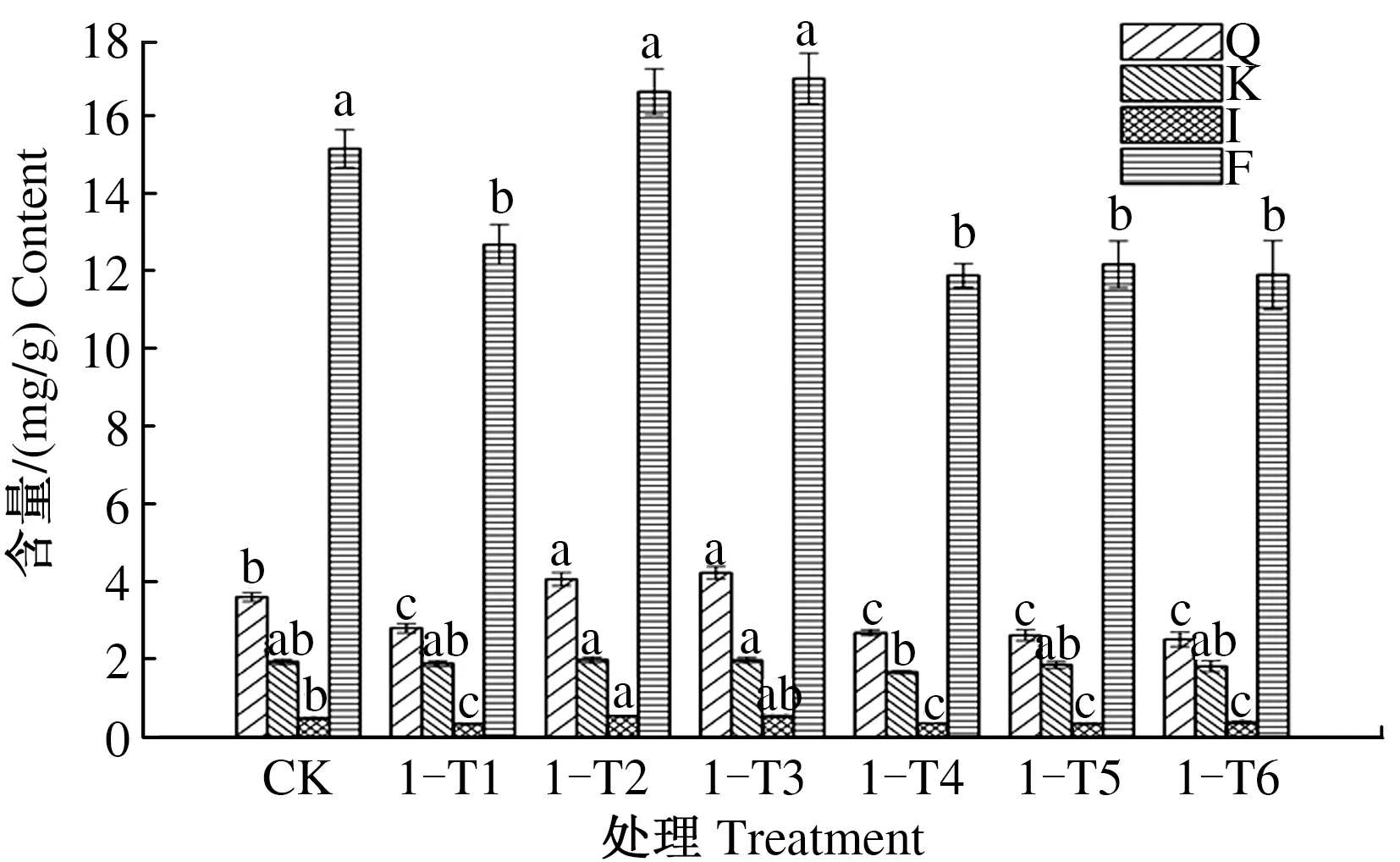
由图4可见,第1次叶施处理后,8月1日,与CK相比,1-T1处理银杏叶槲皮素、山柰酚、异鼠李素和总黄酮含量都有所提高;1-T2处理银杏叶异鼠李素含量显著提高,槲皮素、山柰酚和总黄酮含量也有所提高;1-T3处理银杏叶山柰酚含量显著提高,槲皮素、异鼠李素和总黄酮含量也有所提高;1-T4处理银杏叶山柰酚含量显著提高,异鼠李素和总黄酮含量也有所提高;1-T5处理银杏叶山柰酚和异鼠李素含量显著提高,槲皮素和总黄酮含量也有所提高;1-T6处理银杏叶槲皮素、山柰酚、异鼠李素和总黄酮含量均显著提高。1-T1—1-T6处理银杏叶总黄酮含量依次为10.816、11.960、12.696、10.908、12.612、14.504 mg/g,分别比CK提高4.93%、16.03%、23.17%、5.82%、22.35%、40.71%。
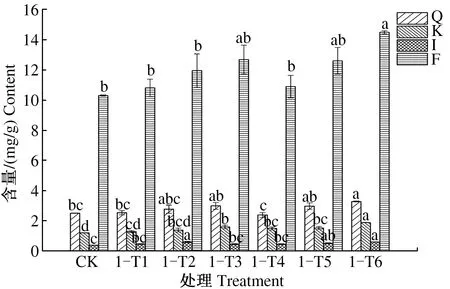
图4 1次喷施处理后8月1日银杏叶黄酮含量Fig.4 The flavonoid content of Ginkgo biloba leaves on August 1st after foliar sprayed once
由图5可见,第1次叶施处理后,8月15日,与CK相比,1-T1处理银杏叶槲皮素、异鼠李素和总黄酮含量显著提高;1-T2、1-T4处理银杏叶山柰酚、槲皮素、异鼠李素、总黄酮含量差异不显著;1-T3处理银杏叶槲皮素、山柰酚、异鼠李素和总黄酮含量均显著提高;1-T5、1-T6处理银杏叶槲皮素、山柰酚、异鼠李素和总黄酮含量都有所提高,但差异不显著。其中,1-T1、1-T3、1-T5、1-T6处理银杏叶总黄酮含量依次为17.785、19.581、15.700、16.247 mg/g,分别比CK提高19.28%、31.33%、5.30%、8.97%。
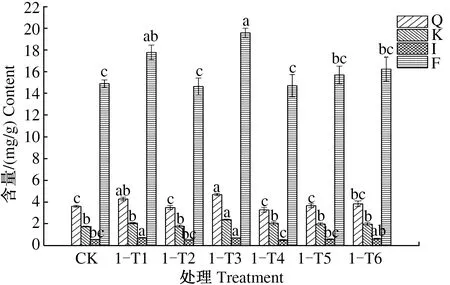
图5 1次喷施处理后8月15日银杏叶黄酮含量Fig.5 The flavonoid content of Ginkgo biloba leaves on August 15th after foliar sprayed once
由图6可见,第1次叶施处理后,8月31日,与CK相比,1-T1处理银杏叶槲皮素、山柰酚、异鼠李素和总黄酮含量均显著提高;1-T2、1-T3、1-T4、1-T5处理银杏叶山柰酚含量显著提高,总黄酮含量也有所提高但差异不显著;1-T6处理银杏叶槲皮素和异鼠李素含量显著降低,山柰酚和总黄酮含量有所降低但差异不显著。其中,1-T1、1-T2、1-T3、1-T4、1-T5处理银杏叶总黄酮含量依次为18.287、15.035、15.419、15.925、15.683 mg/g,分别比CK提高21.91%、0.23%、2.79%、6.17%、4.55%。

图6 1次喷施处理后8月31日银杏叶黄酮含量Fig.6 The flavonoid content of Ginkgo biloba leaves on August 31st after foliar sprayed once
由图7可见,第1次叶施处理后,9月15日,与CK相比,1-T1处理银杏叶槲皮素和总黄酮含量显著提高,山柰酚和异鼠李素含量也有所提高但差异不显著;1-T2处理银杏叶槲皮素、山柰酚和总黄酮含量有所提高;1-T3处理银杏叶山柰酚和总黄酮含量有所提高;1-T4处理银杏叶山柰酚含量有所提高;1-T5处理异鼠李素含量有所提高;1-T6处理银杏叶异鼠李素含量显著提高,槲皮素、山柰酚和总黄酮含量也有所提高。其中,1-T1、1-T2、1-T3、1-T6处理银杏叶总黄酮含量依次为15.230、13.476、13.642、13.193 mg/g,分别比CK提高17.68%、4.13%、5.41%、1.94%。

图7 1次喷施处理后9月15日银杏叶黄酮含量Fig.7 The flavonoid content of Ginkgo biloba leaves on September 15th after foliar sprayed once
2.1.2 叶施2次 由图8可见,第2次叶施处理后,8月1日,与CK相比,2-T1、2-T4、2-T5处理银杏叶槲皮素、山柰酚、异鼠李素和总黄酮含量均显著提高;2-T2处理银杏叶槲皮素、山柰酚和总黄酮含量显著提高;2-T3处理银杏叶槲皮素、异鼠李素和总黄酮含量显著提高;2-T6处理银杏叶山柰酚含量显著提高。2-T1—2-T6各处理银杏叶总黄酮含量依次为14.846、12.637、12.337、13.162、14.350、11.193 mg/g,分别较CK提高44.02%、22.59%、19.68%、27.69%、39.21%、8.59%。
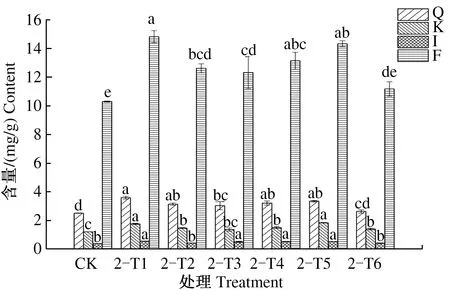
图8 2次喷施处理后8月1日银杏叶黄酮含量Fig.8 The flavonoid content of Ginkgo biloba leaves on August 1st after foliar sprayed twice
由图9可见,第2次叶施处理后,8月15日,与CK相比,2-T1、2-T2、2-T3处理银杏叶槲皮素、山柰酚、异鼠李素和总黄酮含量均显著提高;2-T4处理银杏叶山柰酚含量有所提高;2-T4、2-T5处理银杏叶槲皮素、山柰酚、异鼠李素和总黄酮含量与CK差异不显著;2-T6处理银杏叶槲皮素、山柰酚和总黄酮含量显著提高。其中,2-T1、2-T2、2-T3、2-T6处理银杏叶总黄酮含量依次为20.851、18.457、17.687、17.423 mg/g,分别比CK提高39.86%、23.80%、18.63%、16.86%。
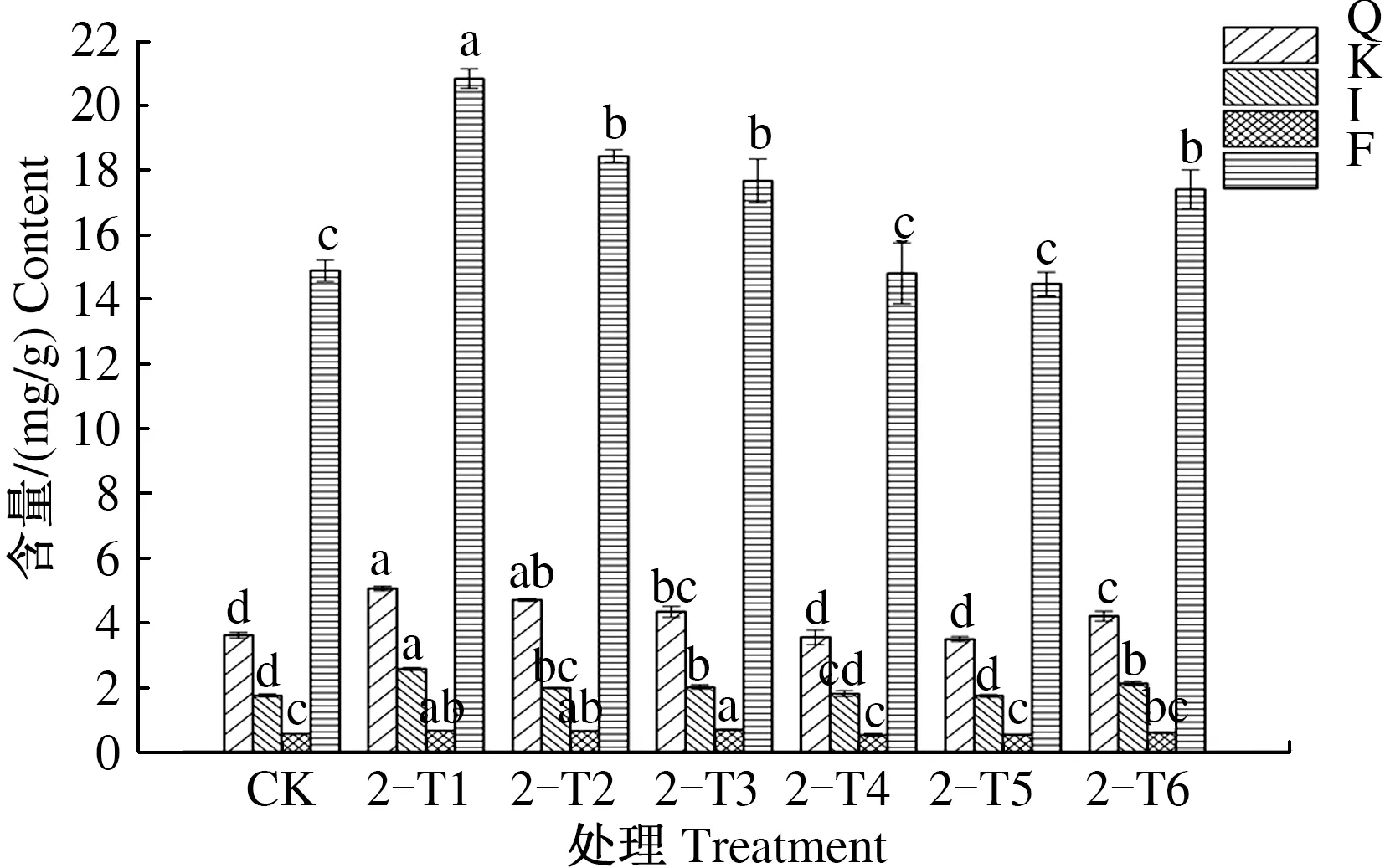
图9 2次喷施处理后8月15日银杏叶黄酮含量Fig.9 The flavonoid content of Ginkgo biloba leaves on August 15th after foliar sprayed twice
由图10可见,第2次叶施处理后,8月31日,与CK相比,2-T1、2-T4、2-T6处理银杏叶山柰酚含量显著提高,异鼠李素含量显著下降,槲皮素和总黄酮含量变化不显著;2-T2、2-T3、2-T5处理银杏叶山柰酚和总黄酮含量均显著提高,异鼠李素含量显著下降,槲皮素含量变化不显著。2-T1—2-T6处理总黄酮含量依次为15.943、17.677、17.338、16.034、17.896、16.250 mg/g,分别比CK提高6.29%、17.85%、15.59%、6.89%、19.31%、8.33%。
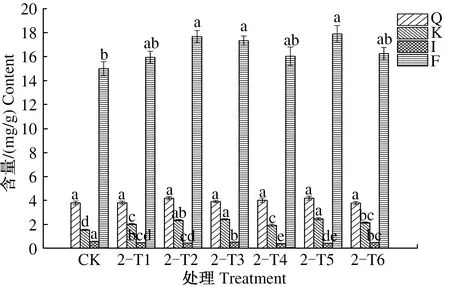
图10 2次喷施处理后8月31日银杏叶黄酮含量Fig.10 The flavonoid content of Ginkgo biloba leaves on August 31st after foliar sprayed twice
由图11可见,第2次叶施处理后,9月15日,与CK相比,2-T1、2-T6处理银杏叶槲皮素、山柰酚、异鼠李素和总黄酮含量均显著提高;2-T2、2-T3、2-T5处理银杏叶槲皮素、山柰酚、异鼠李素和总黄酮含量差异不显著;2-T4处理银杏叶山柰酚、异鼠李素和总黄酮含量均显著提高,槲皮素含量也有所提高。2-T1—2-T6处理银杏叶总黄酮含量依次为16.482、13.647、13.515、16.097、14.635、16.599 mg/g,分别比CK提高了27.35%、5.45%、4.43%、24.38%、13.08%、28.26%。

图11 2次喷施处理后9月15日银杏叶黄酮含量Fig.11 The flavonoid content of Ginkgo biloba leaves on September 15th after foliar sprayed twice
2.2 叶施有机硒、矮壮素和磷酸二氢钾不同处理银杏叶总黄酮含量变化趋势
由图12可见,CK银杏叶总黄酮含量呈现降低-升高-降低的变化趋势;第1次叶施处理后采集的7批银杏叶中,1-T1处理银杏叶总黄酮含量呈升高-降低-升高-降低的变化趋势,1-T2、1-T3处理银杏叶总黄酮含量呈降低-升高-降低-升高-降低的变化趋势,1-T4、1-T5、1-T6处理银杏叶总黄酮含量呈升高-降低-升高-降低的变化趋势;第2次叶施处理后采集的4批银杏叶中,2-T1、2-T6处理银杏叶总黄酮含量呈升高-降低-升高的变化趋势,2-T2、2-T3、2-T5处理银杏叶总黄酮含量呈先升高后降低的变化趋势,T4处理银杏叶总黄酮含量呈逐渐升高的变化趋势。
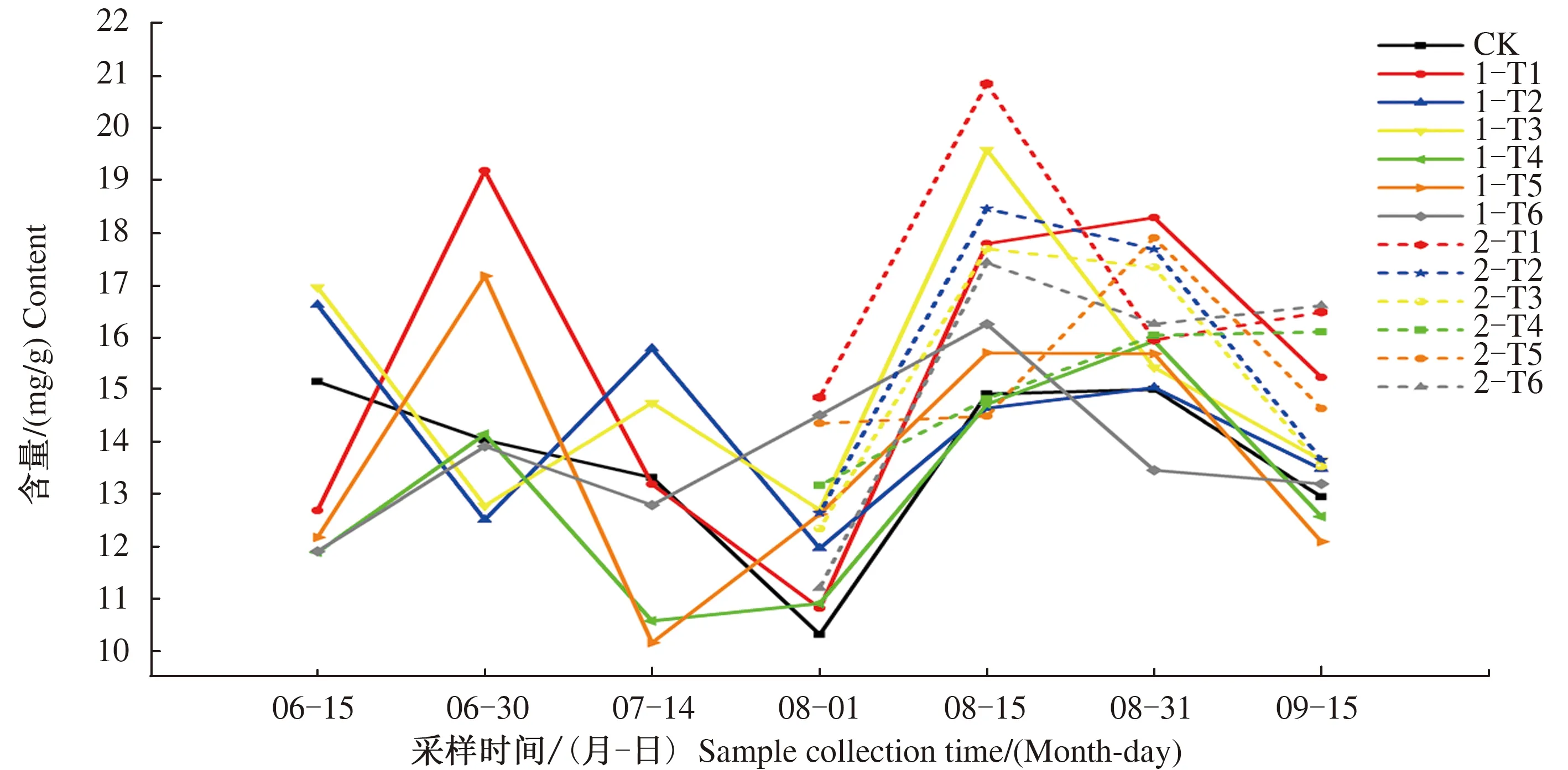
图12 叶施有机硒、矮壮素和磷酸二氢钾不同次数各处理银杏叶总黄酮含量的动态变化Fig.12 The dynamic changes of total flavonoids content of Ginkgo biloba leaves sprayed with organic selenium, chlorocholine chloride and potassium dihydrogen phosphate for different times
2次叶施处理与1次叶施处理相比,2-T1处理8月1日、8月15日和9月15日的银杏叶总黄酮含量较1-T1处理分别提高了37.26%、17.24%和8.22%,8月31日的银杏叶总黄酮含量较1-T1处理降低14.70%;2-T2处理8月1日、8月15日、8月31日和9月15日的银杏叶总黄酮含量分别比1-T2处理提高5.66%、26.06%、17.57%和1.27%;2-T3处理8月31日的银杏叶总黄酮含量分别比1-T3处理提高12.45%,8月1日、8月15日和9月15日的银杏叶总黄酮含量比1-T3处理分别降低2.91%、10.71%和0.94%;2-T4处理8月1日、8月15日、8月31日和9月15日的银杏叶总黄酮含量分别比1-T4处理提高20.66%、0.72%、0.68%和28.11%;2-T5处理8月1日、8月31日和9月15日的银杏叶总黄酮含量分别比1-T5处理提高13.78%、14.11%和21.11%,8月15日的银杏叶总黄酮含量比1-T5处理降低8.34%;2-T6处理8月15日、8月31日和9月15日的银杏叶总黄酮含量分别比1-T6处理提高7.24%、20.79%和25.82%,8月1日的银杏叶总黄酮含量比1-T6处理降低29.58%。由此可知,2-T1、2-T2、2-T4、2-T5、2-T6处理银杏叶的总黄酮含量总体上分别高于1-T1、1-T2、1-T4、1-T5、1-T6,表明2次叶施处理对于提升银杏叶总黄酮含量具有重要作用。
由银杏叶总黄酮含量及其变化趋势可知,1次叶施处理下,1-T1处理银杏叶总黄酮含量在6月30日和8月31日出现峰值,分别是CK的1.367倍和1.219倍;1-T2处理银杏叶总黄酮含量在6月15日、7月14日和8月31日出现峰值,分别是CK的1.096倍、1.185倍和1.002倍;1-T3处理银杏叶总黄酮含量在6月15日、7月14日和8月15日出现峰值,分别是CK的1.119倍、1.107倍和1.313倍;1-T4处理银杏叶总黄酮含量在6月30日和8月31日出现峰值,分别是CK的1.008倍和1.062倍;1-T5处理银杏叶总黄酮含量在6月30日和8月15日出现峰值,分别是CK的1.224倍和1.053倍;1-T6处理银杏叶总黄酮含量在6月30日和8月15日出现峰值,分别是CK的0.992倍和1.090倍。2次叶施处理下,2-T1处理银杏叶总黄酮含量在8月15日和9月15日出现峰值,分别是CK的1.399倍和1.274倍;2-T2处理银杏叶总黄酮含量在8月15日出现峰值,是CK的1.238倍;2-T3处理银杏叶总黄酮含量在8月15日出现峰值,是CK的1.186倍;2-T4处理银杏叶总黄酮含量在9月15日出现峰值,是CK的1.244倍;2-T5处理银杏叶总黄酮含量在8月31日出现峰值,是CK的1.193倍;2-T6处理银杏叶总黄酮含量在8月15日和9月15日出现峰值,分别是CK的1.169倍和1.283倍。结合银杏幼苗的生长周期和银杏叶总黄酮含量来看,银杏基地的银杏叶每年可进行多次采样。1次叶施处理下,1-T1处理最佳采样期在6月末和8月末;1-T2处理最佳采样期在6月中旬、7月中旬和8月末;1-T3处理最佳采样期在6月中旬、7月中旬和8月中旬;1-T4处理最佳采样期在6月中旬和8月末;1-T5处理最佳采样期在6月末和8月中旬;1-T6处理最佳采样期在6月末和8月中旬。2次叶施处理下,2-T1处理最佳采样期在8月中旬;2-T2处理最佳采样期在8月中旬;2-T3处理最佳采样期在8月中旬;2-T4处理最佳采样期在8月初和8月末;2-T5处理最佳采样期在8月初和8月末;2-T6处理最佳采样期在8月中旬。
所有处理中,有机硒处理(T1)对大田银杏叶总黄酮含量的提升效果在整体上达到最优水平。其中,有机硒1次叶施处理下6月30日、8月1日、8月15日、8月31日和9月15日的银杏叶总黄酮含量比CK分别提高了36.71%、4.93%、19.28%、21.91%和17.68%;有机硒2次叶施处理下8月1日、8月15日、8月31日和9月15日的银杏叶总黄酮含量比CK分别提高了44.02%、39.86%、6.29%和27.35%。因此,为了获得高总黄酮含量的银杏叶,推荐在银杏幼苗种植基地推广使用有机硒对银杏进行叶面喷施。
2.3 叶施有机硒、矮壮素和磷酸二氢钾不同处理对银杏黄酮合成相关基因表达的影响
为检测有机硒处理对银杏黄酮合成相关基因的影响,分别选取CK及总黄酮含量提升较为明显的1-T1、1-T5、2-T1和2-T5处理银杏叶进行转录组测序,并分析相关基因的表达水平变化趋势(图13)。
1-T1处理银杏叶PAL基因在6月15日—7月14日和9月15日的表达水平高于CK;C4H基因在6月15日—7月14日的表达水平高于CK,6月30日达到最高峰;4CL基因在7月14日和8月15日的表达水平明显高于CK,并在7月14日达到最高;CHS基因在6月15日达到最高表达水平,之后逐渐下降。相对于CK,CHI基因表达水平在6月15—30日、8月15—31日较高,并在8月15日和8月31日达到2个高峰;OMT基因表达水平在7月14日和8月15日较高,并在7月14日达到最高;FLS基因在7月14日—8月15日的表达水平明显高于CK,在8月15日达到最高;IFS基因的表达高峰在7月14日,相较于CK延迟了30 d左右。1-T1处理其他基因表达水平相对于CK无明显变化。

图13 银杏叶中黄酮合成相关基因表达水平变化趋势Fig.13 Trends of genes expression level related to the synthesis of total flavonoids of Ginkgo biloba leaves
2-T1处理银杏叶PAL基因表达水平在6月15日即达到最高峰;而C4H基因和F3′5′H基因表达水平则在7月14日达到最高,前者比CK提前30 d左右,后者比CK延迟15 d左右;4CL基因表达水平在7月14日和8月15日达到2个高峰,并且高于CK;CHS基因表达水平在8月1日达到最高;FS基因表达量则在7月14日达到最高;OMT、FLS、FL3H和IFS基因表达水平在8月15日达到最高,后期逐渐下降;F3H基因表达水平则在8月31日和9月15日达到最高,且明显高于CK。
1-T5处理银杏叶C4H基因表达水平在7月14日达到最高,比CK提前30 d左右;CHI基因表达水平则在8月15日达到最高;IFS基因在6月15日出现表达高峰,与CK一致。其他基因表达水平与CK无明显差异。
2-T5处理银杏叶PAL基因表达水平在8月1日达到最高峰;4CL和CHS基因表达水平则在6月30日达到最高;CHI基因和F3′5′H基因表达水平在8月15日达到最高峰,明显高于CK,之后逐渐下降;OMT基因表达水平在7月14日达到最高峰,比CK提前15 d左右。在6月30日和7月14日,FLS基因表达水平高于CK,并在7月14日达到最高峰。其他基因表达水平与CK相比无明显差异。
3 结论与讨论
本研究显示,有机硒、矮壮素和磷酸二氢钾叶施1次与2次处理对大田环境下银杏叶总黄酮含量的提升效果不尽相同。由于银杏叶中总黄酮含量是判断叶片质量的一个重要标准,故提高总黄酮含量是提升银杏叶品质的关键所在。本研究中,有机硒喷施处理效果最为突出,尤其是2次叶施处理下,银杏叶黄酮含量较CK最高可提高44.02%,极大地提升了银杏叶的药用价值。
植物可将无机硒转化成有机硒,其中一部分有机硒为次生代谢产物的转化提供物质基础,另一部分有机硒可促进植物次生代谢过程中关键酶的合成,进而增加相关次生代谢产物的累积,还有一部分有机硒则与植物的次生代谢产物结合[25]。陈军[15]研究发现,不同浓度亚硒酸钠以不同方式处理盆栽银杏后,均可有效提高叶片黄酮含量,其中以15 mg/盆亚硒酸钠溶液处理效果最佳,叶施、根浇、混合施加处理下银杏叶总黄酮含量分别提高了89.3%、20.8%、56.9%,这与本研究中有机硒肥处理可显著提高大田银杏叶总黄酮含量的结果一致。相比之下,无机硒对人体和植物的毒害作用较大,对环境造成的污染严重,而有机硒则显得安全可靠,更利于植物健康生长。因此,建议大田栽种的银杏幼苗可采用喷施有机硒代替无机硒,此法既可以达到提高银杏叶总黄酮含量的目的,又可以保证银杏产量。
矮壮素可由叶片吸收进入植物体内,矮化植物,增强植物的抗逆性,提高产量[20,26]。CHENG等[18]研究认为,叶面喷施矮壮素、脱落酸和乙烯利后,银杏叶总黄酮含量均可提高,以矮壮素的提升作用最佳,总黄酮含量提高20.06%,究其原因,一方面是矮壮素可促进银杏光合作用,合成更多初生代谢产物,为次生代谢产物的合成提供物质基础;另一方面,矮壮素能显著降低银杏叶中赤霉素含量以及吲哚乙酸与脱落酸比例、吲哚乙酸与乙烯利比例、赤霉素与脱落酸比例、赤霉素与乙烯利比例。本研究发现,低浓度矮壮素、高浓度矮壮素、低浓度矮壮素与有机硒组合、高浓度矮壮素与有机硒组合叶施处理均可显著提高大田银杏叶总黄酮含量,与CHENG等[18]结果一致,与CK相比,4种处理下最高可将银杏叶总黄酮含量分别提高23.80%、31.33%、27.69%、39.21%。
提高银杏叶黄酮含量的施肥措施包括叶面施肥和根部施肥处理,肥料则包含有机肥和无机肥。根施一定量氮、磷、钾肥可以明显提高银杏叶黄酮含量,但不同种植条件和不同施肥方案会对黄酮含量产生不同的影响[27-30];另有研究表明,施用有机肥可以显著提高银杏叶总黄酮含量,而且效果优于无机肥[31-32]。叶面喷施金属离子肥料可提高盆栽银杏苗叶片的总黄酮含量,同时银杏的最佳采叶时期延长,0.1% FeSO4、0.2% ZnSO4、0.3% MnSO4和0.4% CuSO4处理下效果最佳[33];喷施镁肥降低了总黄酮含量,喷施高质量浓度(5 g/mL)锌肥对总黄酮含量的提升作用最佳,喷施低质量浓度(0.5 g/mL)钼肥对总黄酮含量的提升作用最佳[34]。相较而言,大田条件下采用叶施有机肥具有易于操作、毒性低、对环境更加友好等优势。
硒是植物生长的有益元素,同时也对植物初级和次生代谢产物含量有一定影响。雷红灵等[35]采用25~200 mg/L硒对藤茶叶面进行喷硒,8~32 d后其黄酮、可溶性糖、可溶性蛋白、游离氨基酸含量均表现为先上升后下降,最大值均出现在硒质量浓度150 mg/L处理后20 d的藤茶样品中。陈军[15]对银杏幼苗不同部位施硒发现,施硒可以显著提高银杏叶黄酮和内酯含量,但硒对银杏叶黄酮和内酯含量的影响机制目前尚不明确,可能是施用硒调节了黄酮和内酯合成过程中主要相关酶的活性,从而影响了黄酮和内酯的合成。本研究中,采用有机硒对大田银杏幼苗进行1次和2次叶施处理,2次处理的间隔期为45 d,都能显著提高银杏叶总黄酮含量。同时,有机硒处理后PAL、C4H、4CL、CHS、CHI、FS、F3′5′H、OMT、F3H、FL3H和FLS等基因表达量明显提升,其中,PAL、C4H、UFGT和CHI等基因的表达高峰提前达到;4CL、CHS和FLS等基因则一直保持较高表达水平。前期研究表明,银杏叶总黄酮含量与GbPAL(银杏苯丙氨酸解氨酶)、GbCHS (银杏查尔酮合成酶)活性及其基因表达量之间存在显著正相关,GbPAL、GbCHS和GbCHI基因的表达水平可能决定了银杏叶总黄酮的积累[36-39]。FLS(黄酮醇合成酶)催化二氢黄酮醇发生去饱和反应,生成黄酮醇、琥珀酸盐、二氧化碳和水。银杏中,GbFLS (银杏黄酮醇合成酶)还可以直接以柚皮素作为底物,催化系列反应生成黄酮醇,GbFLS基因表达水平与总黄酮含量密切相关[40]。因此,推测有机硒通过提高PAL、4CL、CHS、CHI和FLS等总黄酮合成相关基因的表达水平来提高叶片总黄酮含量。
综合来看,根部施肥和叶面施肥均能提高银杏叶总黄酮含量,鉴于大田环境下银杏幼苗的种植面积、生存环境和管理方式等因素,叶面施肥比根部施肥更便于操作,节约成本,更利于保护环境。而且,本研究中采用的叶面施肥处理显著提高了银杏叶总黄酮含量,故建议大田栽种的银杏幼苗可采用叶面施肥代替根部施肥。有机硒一次叶施处理下6月30日、8月1日、8月15日、8月31日、9月15日采样的银杏叶总黄酮含量较CK分别提高36.71%、4.93%、19.28%、21.91%、17.68%;有机硒2次叶施处理下8月1日、8月15日、8月31日、9月15日采样的银杏叶总黄酮含量较CK分别提高44.02%、39.86%、6.29%、27.35%。因此,推荐在银杏幼苗种植基地推广使用有机硒对银杏叶进行叶面喷施并进行分级分次采收,以获得更好的银杏叶片质量。

