香根草对扑草净胁迫的响应和去除效果
石傲傲, 郑 毅,2, 张 坤, 角慈梅, 李鑫圆, 孙仕仙
(1.西南林业大学国家高原湿地研究中心/湿地学院,云南 昆明 650224;2.云南开放大学校长办公室,云南 昆明 650223;3.云南农业大学植物保护学院,云南 昆明 650221;4.西南林业大学生态与环境学院,云南 昆明 650224)
扑草净(4,6-双异丙胺基-2-甲硫基-1,3,5-三嗪)是一种三嗪类低毒、高选择的内吸性除草剂,其因杀草谱广、药效长等优点,被广泛应用于农业生产和水产养殖中[1].但其在水中溶解度低(25 ℃时为48 mg·L-1)、化学性质稳定、难降解,造成严重水环境污染,且易经生物富集作用通过食物链威胁人体健康[2];我国水产品也曾因扑草净超标出现严重贸易壁垒[3];扑草净还是一种环境内分泌干扰物质,其进入机体内可导致生物体内分泌系统、生殖系统、神经系统和免疫系统异常,还可引起蛋白质重组和构像改变,诱发人体癌变、不育及先天性缺陷[4-7].因此,水体扑草净污染修复引起了学者们的高度重视.
植物修复因具有经济、无二次污染等优点,被广泛用于污染修复[8].香根草(Vetiveriazizanioides),又名岩兰草,是多年生丛生型C4类草本植物,根系发达、生物量大,每年干草产量可达100 t·hm-2,能适应旱涝、酸碱等多种环境,对有机和无机化学物质都有很强的亲和力,已广泛用于环境修复领域[9-10].Ye et al[11]研究发现,香根草可用于修复复合污染区,能有效降解有机氯农药和富集重金属;香根草在净化生活污水和工业废水方面也优于其他植物,表现出较好的净化效果和较强的耐污能力[12-13].本项目组前期研究发现香根草能去除水体中的扑草净[14].然而,香根草对扑草净的耐受性和去除效果尚不明确.因此,本研究通过温室水培试验,测定香根草对扑草净胁迫的光合生理响应和去除效果,为利用香根草修复扑草净污染环境提供依据.
1 材料与方法
1.1 材料
于2019年5—7月在云南省西南林业大学格林温室进行试验.供试药品97%扑草净标准品购自济南仁诺化工有限公司;供试材料香根草(分蘖苗)购自江西红壤研究所.选取长势良好、大小一致的香根草植株,先用自来水清洗干净,并用0.2%高锰酸钾溶液消毒,再用去离子水清洗3遍,放入盛有1/2改良Hoagland营养液的塑料桶中,适应性培养1周.
1.2 试验设计
向营养液中添加扑草净,并将营养液定容至4 L,扑草净浓度分别为0(CK)、1、10 mg·L-1,每个处理设置3个重复,分别于试验1、2、3、5、10、15、25、35 d后测定香根草叶片叶绿素含量、光合参数、叶绿素荧光参数,并于第0、35天测定各处理香根草鲜重.考虑到扑草净存在自然降解情况,设置只添加扑草净未种植香根草的处理组,扑草净浓度同上,分别于第0、35天测定各处理营养液中扑草净含量.
1.3 项目测定方法
1.3.1 鲜重测定 采用称量法测定香根草鲜重,并计算鲜重增长率.
鲜重增长率/%=(总鲜重-初始鲜重)/初始鲜重×100
1.3.2 扑草净含量测定 根据质量差法,先将营养液添加至初始体积4 L,再取水样50 mL,经滤纸过滤后,量取30 mL至分液漏斗中,加入30 mL乙酸乙酯,振荡萃取5 min,静置直至分层.取上清液,40 ℃旋蒸至干,用正己烷定容至3 mL,过0.45 μm滤膜,转入小棕瓶,用气相色谱-质谱(GC-MS)联用仪(Thermo Scientific, USA)进行测定.以扑草净标准品配制5个梯度浓度的标准液,制作标准曲线.
1.3.3 叶绿素含量测定 采用紫外分光光度计(Thermometer Evolution 300, USA)测定各类光合色素质量分数.分别称取0.1 g长势一致的香根草中、上部叶片,剪碎后放入10 mL有盖试管中,加入10 mL 95%乙醇,在60 ℃水浴锅中加热2 h至叶片发白,分别测定提取液在665、649和470 nm波长下的光密度D值,并计算叶绿素a(Chla)、叶绿素b(Chlb)、总叶绿素(Chlt)含量[15].
1.3.4 光合参数测定 应用Li-6800便携式光合仪(LI-COR, USA)测定光合指标,选用6800-01F荧光叶室进行试验,设置红蓝光源,光强1 000 μmol·m-2·s-1,CO2控制为400 μmol·mol-1,湿度控制为50%.选取长势良好的香根草中、上部叶片,于8:30—11:30测定净光合速率(net photosynthetic rate, Pn)、胞间CO2浓度(intercellular CO2concentration, Ci)、气孔导度(stomatal conductance, Gs)、蒸腾速率(transpiration rate, Tr),并将叶片做好标记.
1.3.5 叶绿素荧光参数测定 与光合速率测定同步,应用Li-6800便携式光合仪(LI-COR, USA)测定叶绿素荧光参数,于8:30—11:30(叶片进行充分光适应)测定实际光化学效率(PSⅡ),于22:00后(充分暗适应状态)测定电子传递速率(electron transport rate, ETR).确保作用光关闭的情况下,设置矩形闪光,饱和脉冲光强为8 000 μmol·m-2·s-1,直接在仪器上读取PSⅡ最大光化学效率(maximal photochemical efficiency, Fv/Fm),潜在光化学效率(potential photochemical efficiency, Fv/Fo)、光化学淬灭系数(photochemical quenching coefficient, qP)、非光化学淬灭系数(non-photochemical quenching coefficient, NPQ)均通过系统自动拟合得出.
1.4 数据分析
应用SPSS 19.0和Excel软件处理数据,采用单因素ANOVA方差分析,并应用Duncan′s多重比较进行差异显著性检验,采用SPSS 19.0中Pearson相关系数和双侧显著性检验进行相关性分析,并采用Origin 2018绘图.
2 结果与分析
2.1 扑草净胁迫对香根草鲜重的影响
与CK相比,1和10 mg·L-1扑草净处理均显著降低了香根草总鲜重和鲜重增长率(P<0.05),总鲜重分别下降了26.78%和40.82%,鲜重增长率分别下降了20.49%和38.10%(表1).可见,高浓度处理的降幅大于低浓度处理.

表1 扑草净胁迫对香根草鲜重的影响1)Table 1 Effects of prometryn stress on fresh weight of V.zizanioides
2.2 营养液中扑草净的去除率
种植香根草的营养液中1和10 mg·L-1扑草净的去除率分别达100%和99.37%,分别较未种植香根草的去除率提高了44.68%和53.76%(表2).这表明香根草对扑草净具有良好的去除效果.

表2 营养液中扑草净含量及去除率1)Table 2 Content and removal rate of prometryn in nutrient solution
2.3 扑草净胁迫对香根草叶绿素含量的影响
1和10 mg·L-1扑草净处理组香根草叶片叶绿素含量均随处理天数的延长呈先下降后上升的趋势(图1).处理第15天,香根草叶片的Chla、Chlb、Chlt含量及Chla/Chlb值达到了较低水平,显著低于CK(P<0.05).在此之后迅速升高,第35天时,1 mg·L-1扑草净处理组香根草Chlb含量和Chla/Chlb值分别恢复到CK的90.79%和106.05%,Chla和Chlt含量恢复到CK的95.91%和94.54%;10 mg·L-1扑草净处理组香根草Chla、Chlb、Chlt含量均恢复到CK的50%以上,但仍与CK差异显著(P<0.05),而Chla/Chlb值恢复到CK的88.97%,差异不显著(P>0.05).

图中不同字母表示在0.05水平上的差异显著性,大写字母表示相同浓度不同处理天数的差异,小写字母表示相同处理天数不同浓度的差异.图1 扑草净胁迫对香根草叶绿素含量的影响Fig.1 Effects of prometryn stress on chlorophyll content of V.zizanioides
2.4 扑草净胁迫对香根草光合参数的影响
1和10 mg·L-1扑草净处理均降低了香根草叶片的Pn、Gs、Tr,而升高了Ci(图2).1 mg·L-1扑草净处理第5天时,香根草叶片的Pn、Gs、Tr均恢复到与CK接近的水平,第15天又下降到较低水平,之后迅速回升,到第35天时均恢复到正常水平,与CK无显著差异(P>0.05);而Ci随处理天数的延长呈先上升后下降趋势,第15天时达到较高水平,比CK高32.28%,此后呈下降趋势,第35天时恢复到CK的94.25%.10 mg·L-1扑草净处理第5天时香根草叶片Pn、Gs、Tr显著低于CK(P<0.05),第15天时Pn和Gs达到较低水平,分别比CK低86.15%和63.64%,此后缓慢回升,第35天时Pn、Gs、Tr仍分别比CK低38.82%、33.33%、49.40%(P<0.05);而Ci在第15天时比CK高70.45%,之后呈下降趋势,但第35天时仍显著高于CK(P<0.05).

图中不同字母表示在0.05水平上的差异显著性,大写字母表示相同浓度不同处理天数的差异,小写字母表示相同处理天数不同浓度的差异.图2 扑草净胁迫对香根草光合参数的影响Fig.2 Effects of prometryn stress on photosynthetic parameters of V.zizanioides
2.5 扑草净胁迫对香根草叶绿素荧光参数的影响
1和10 mg·L-1扑草净处理降低了香根草的Fv/Fm、Fv/Fo、ΦPSⅡ、ETR、qP,并随处理天数的延长整体上呈先下降后上升趋势,而NPQ在胁迫处理初期明显高于CK(图3).与CK相比,1和10 mg·L-1扑草净处理第15天时,香根草Fv/Fm分别下降了2.53% 和21.52%,Fv/Fo分别下降了10.63%和51.23%,ΦPSⅡ分别下降了57.14%和88.10%,ETR分别下降了57.60%和87.56%,qP分别下降了58.70%和86.96%,NPQ分别下降了63.16%和47.37%.1 mg·L-1扑草净处理第35天时,香根草各项叶绿素荧光参数均恢复到CK水平,差异不显著(P>0.05);而10 mg·L-1扑草净处理第35天时,香根草各项叶绿素荧光参数仍低于CK.
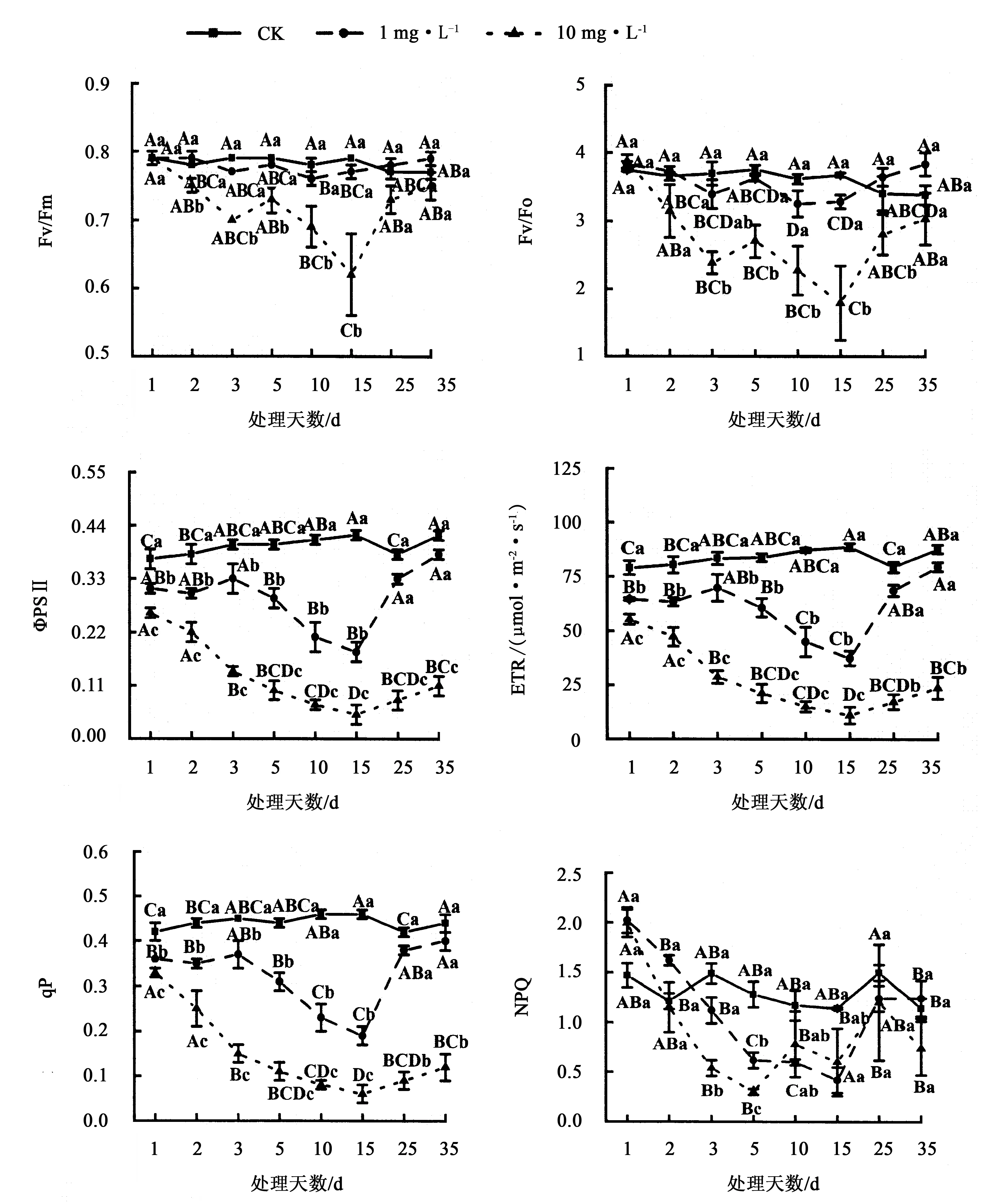
图中不同字母表示在0.05水平上的差异显著性,大写字母表示相同浓度不同处理天数的差异,小写字母表示相同处理天数不同浓度的差异.图3 扑草净胁迫对香根草叶绿素荧光参数的影响Fig.3 Effects of prometryn stress on chlorophyll fluorescence parameters of V.zizanioides
2.6 扑草净浓度与各指标的相关性
计算不同处理天数香根草Pn、Ci、Gs、Chlt、Fv/Fm、ΦPSⅡ、NPQ及扑草净浓度平均值,然后分析其相关性.由表3可知,香根草叶片Pn、Gs、Chlt、Fv/Fm、ΦPSⅡ与扑草净浓度呈极显著负相关(P<0.01),Ci与扑草净浓度呈极显著正相关(P<0.01),NPQ与扑草净浓度无显著相关性(P>0.05).
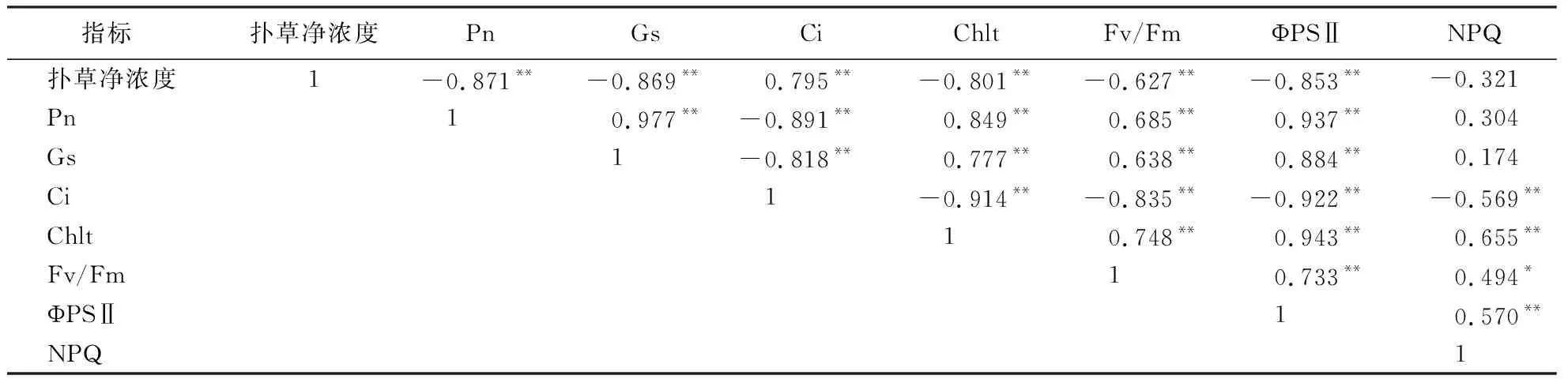
表3 扑草净浓度与各光合生理指标的相关系数1)Table 3 Correlation coefficients between prometryn concentration and all photosynthetic physiological parameters of V.zizanioides
3 讨论
植物会通过调整生理特征及改变生物量来维持在逆境下的存活与生长[16].本研究表明,不同浓度扑草净处理均降低了香根草总鲜重及鲜重增长率.这可能与扑草净的除草机理有关,扑草净经植物根部吸收并经非共质体途径传导到分生组织和叶面,作用靶标是植物光合作用系统Ⅱ的受体蛋白,从而抑制了电子传递(Hills反应)和氧化磷酸化,进而强烈抑制了植物的光合作用和养分积累,最终影响香根草的生长[17].这与刘建霞等[18]用扑草净处理黄芪幼苗的研究结果一致.
叶绿素在植株体内负责光能的吸收、传递和转化,植物叶片叶绿素含量的变化与光合强度密切相关,通常植物生长状况可通过叶绿素含量来表征[19].本研究表明,不同浓度扑草净处理均降低了香根草叶片叶绿素含量及Chla/Chlb值,且叶绿素指标随处理天数的延长呈先下降后上升的趋势.下降的原因可能是在扑草净胁迫环境下,香根草叶绿体受损,光合色素含量降低,对光能的捕获能力下降,叶绿素活性酶比例失调, 生理平衡被打破,抑制了叶绿素的合成;而各类叶绿素含量均在第15天后回升,可能是由于香根草茎叶中扑草净随处理天数的延长而降解,胁迫效应减弱,也可能是因为适应扑草净胁迫环境后,香根草体内谷胱甘肽-S-转移酶活性增强,降低了扑草净毒性[20].Burke et al[21]研究发现,抗除草剂植物倾向于降低Chla/Chlb值以提高光合效率,维持植物的生长需要,这与本研究中Chla/Chlb值的变化一致.Pn直接反映植物单位叶面积的同化能力,是衡量植物光合能力的重要指标[22].气孔和非气孔限制都可导致Pn下降,Pn、Gs和Ci同时下降时为气孔限制;Pn下降而Ci升高时为非气孔限制[23].本研究中香根草叶片Pn、Gs与Ci呈负相关,表明Pn下降主要是由于非气孔限制造成.1 mg·L-1扑草净处理第5天时,香根草叶片光合指标接近于CK水平,可能与其体内抗氧化酶增加,清除活性氧自由基能力增强有关[24];而在此之后,Pn、Gs、Tr均降低;第15天时达到最低,之后逐渐恢复到CK水平,这可能与香根草叶片中扑草净含量变化有关.Sun et al[14]研究表明,香根草可吸收溶液中的扑草净并将其转移到叶片中,在第15天左右扑草净含量达到峰值.这与本研究结果基本相符.
叶绿素荧光与光合作用中各个反应过程紧密相关,任何逆境对光合作用各过程产生的影响都可通过植物体内叶绿素荧光诱导动力学反映出来,所以叶绿素荧光参数可作为评价植物抗逆反应的指标之一[25].本研究表明,不同浓度扑草净处理后,香根草Fv/Fm、Fv/Fo、ФPSⅡ和ETR呈先下降后回升趋势,可能与体内扑草净含量变化有关.qP能在一定程度上反映PSⅡ反应中心的开放程度,qP 愈大,PSⅡ的电子传递活性愈强[26-27];NPQ 反映的是叶片吸收的光能否用于光合电子传递而以热耗散形式散失的部分能量,当PSⅡ反应中心吸收了过量的光能时,如不能及时耗散将对光合机构造成破坏,所以非光化学淬灭是一种自我保护机制[28].本研究表明,高浓度扑草净处理的qP小于低浓度处理,说明高浓度扑草净胁迫使香根草PSⅡ反应中心受损严重,阻碍了光合电子的传递.从相关性分析结果来看,扑草净胁迫不会对香根草NPQ产生显著影响,表明PSⅡ反应中心主要通过增加热形式耗散掉的光能,缓解扑草净胁迫对香根草PSⅡ带来的伤害.这与申须仁等[29]的研究结果相符,但具体的调节机制仍待研究.
本研究中,香根草对高浓度扑草净具有较强的耐受性.其对扑草净胁迫的光合生理响应机制可能表现在2个方面:一方面,通过降低体内叶绿素含量,调节Chla/Chlb值,减少对光能的捕获,从而保护光合机构;另一方面,通过调节热耗散释放过剩能量,保护PSⅡ系统.此外,不同植物对农药的吸收和降解效果存在差异:Ni et al[30]发现,铜钱草(Hydrocotylevulgaris)对0.5 mg·L-1扑草净的去除率为94%;本研究发现,香根草对1和10 mg·L-1扑草净的去除率达100%和99.37%.这表明香根草对扑草净的去除效果较铜钱草强,可能与植物的生物量及其根际微环境有关[31-32].
综上所述,香根草能够长时间耐受1 mg·L-1以下的扑草净胁迫,对10 mg·L-1扑草净胁迫也具有较强的耐受性和良好的去除效果,具有修复扑草净污染环境的潜力.

