接种AMF及施氮对滨海盐土氮矿化的影响
杨瑞珍,张焕朝,胡立煌,范之馨
(南京林业大学,南方现代林业协同创新中心,南京林业大学林学院,江苏 南京 210037)
盐土是因土壤盐化而形成的一种土壤类型,因其土体具有较高的盐分而导致植物无法正常生长[1]。盐土多分布于干旱、半干旱地区以及滨海地区。中国盐渍化土壤总面积约3 600万hm2,占全国可利用土地面积的4.88%;耕地中盐渍化面积达到920.9万hm2,占全国耕地面积6.62%[2]。随着我国经济快速发展、人口数量剧增,土地资源紧缺问题日益严峻。江苏北部地区拥有大面积的滨海冲积平原,是江苏乃至中国沿海的重要战略发展区域[3],但是这些盐土地区,因其特殊的成土因素使得该地区土壤具有养分贫瘠、土壤盐化程度严重等特点[4],使土地资源未得到有效利用。对滨海盐土地区土壤加以改良、开发和利用是改善生态环境、促进经济发展的重要途径[5]。
氮素是植物生长和发育所需的大量营养元素之一,也是植物从土壤中吸收量最大的矿质元素[6]。土壤中氮素可被植物直接吸收利用的主要形式是无机氮 (主要为铵态氮和硝态氮),仅占土壤总氮的1%[7]。氮矿化是植被-土壤系统间养分循环过程中重要的一环,氮矿化速率对土壤氮的贮存量和供应能力具有显著影响[8-10]。土壤氮循环是一个在微生物驱动下,由土壤酶介导催化的复杂过程,这一过程同时受土壤理化性质、微型动物以及根系生长发育等生物和非生物因子的综合影响[11]。土壤中较高的盐分会影响氮素转化,土壤中盐分越高,越不利于铵态氮的吸附,氮矿化作用也随之受到抑制[12]。施氮是在盐渍条件下维持植物正常生长、提高盐土供氮能力的有效手段。滨海盐土有机质和氮素含量较低,尤其是土壤有效氮含量更低,因此,需要施用氮肥满足植物生长需要,然而,大量的氮肥通过各种途径流失造成氮肥利用效率(30%~50%)低下,对生态环境产生负效应[13]。
丛枝菌根真菌(arbuscular mycorrhizal fungi,AMF)是一种内生菌根真菌,早在 4.5 亿年前,就已经与陆生植物根系形成了共生结构,并经过长期的协同进化,建立了互利互惠的共生关系[14]。AMF具有促进植物生长、改善植物营养状况、提高植物抗逆性的能力,因其具有作为生物肥料的潜力受到广泛关注[15]。近年来,越来越多的研究表明,AMF可以从土壤中吸收氮并向植物转运,因而在植物氮素营养中发挥重要作用[16-18]。但也有研究者认为AMF向植物转运的氮远不能满足植物的氮需求量,因此AMF对植物氮吸收的贡献很小,甚至没有作用[19-20]。AMF是否通过提高对氮素的利用能力而对促进植物生长产生作用,有待于进一步研究。研究证明在盐渍环境下许多植物可以形成菌根[21-22]。AMF侵染植物根系会造成根的结构和生理特性发生变化,产生大量的根外菌丝,有利于扩大植物根系在土壤中的吸收范围,从而影响根系对养分的吸收能力[23]。在滨海盐土中,AMF的侵染和施氮对植物氮素吸收的影响尚不明确。为此,本研究以江苏滨海盐土为研究对象,采用室内盆栽、培养试验,设置不同施氮浓度及接种AMF处理,研究接种AMF及不同施氮水平对滨海盐土氮矿化作用的影响,以期为合理施氮以及提高滨海盐土供氮能力提供科学理论依据。
1 材料与方法
1.1 试验材料
1)试验土壤。于2019年4月采自江苏省盐城市大丰沿海农业科技示范园(120°49′43″E,32°59′40″ N),土壤质地为海相沉积物发育而成的砂质壤土。采用S形取样方法取表层土壤(10~20 cm),充分混匀后室内风干、研磨,挑去杂根,过4 mm筛。将试验土壤装于布袋中,在95 ℃下蒸汽灭菌2次,每次1~2 h,2次灭菌中间间隔24 h,灭菌后的土壤放置1~2周使用。采用四分法取样测定其基本理化性质。采用四分法取样并测定试验土壤的理化性质为:全氮含量(0.81±0.002)g/kg,碱解氮含量(141.92±3.40)mg/kg,有效磷含量(10.96±1.04)mg/kg,速效钾含量(165.97±21.40)mg/kg,有机质含量(12.21±0.59)g/kg,全盐含量(1.64±0.12)g/kg,电导率为(910.17±73.82)μS/cm,pH为8.71±0.07。
2)试验菌剂及氮肥。供试丛枝菌根真菌为摩西斗管囊球霉(Funneliformismosseae),菌种购自北京农林科学院“丛枝菌根真菌种质资源库”,BGC编号:BGC XJ08A,采用玉米为宿主植物,使用经2 mm孔径筛的混合培养基质(由河沙与沸石按照体积比1∶1比例混合)进行扩繁,得到包括植物根系、菌丝、孢子和培养基质的干燥全培养物作为供试菌剂。供试氮肥为尿素,购自南京姜华化玻有限公司。
3)试验植物。采用生长较快、绿化价值较高的速生国槐(SophorajaponicaLinn.),种子采购于江苏亨信种业销售公司,使用前将种子在20~30 ℃温水中清洗3遍,后用稀释100倍的40%甲醛溶液浸泡15 min,再用清水清洗3遍。用清水浸种24 h,浸种完后清洗1~2遍,放置于恒温(25 ℃)培养箱中催芽,待种子出芽后种植。
4)试验盆钵。采用棕色塑料花盆,盆高16 cm,上口内径20 cm,底部内径15 cm,用自来水清洗后再用75%酒精消毒,每盆可装风干土3 kg。
1.2 试验方法
1)试验设计。采用双因素试验设计进行室内盆栽培养试验,因素1为氮肥处理,包括3个水平:不施氮(N0)、低氮(N1)和高氮(N2)处理。因素2为接种处理,包括2个水平:接种AMF处理(+)和未接种对照(-)。共设置6个处理组合,每个组合6个重复。
2)接种。在塑料花盆中填充13 cm厚的试验土壤,将15 g灭活(-)或未灭活(+)的AMF菌剂放置于其上,然后放置处理过的国槐种子,继续填充处理过的供试土壤至与花盆表面平齐。将盆栽随机放置在恒温恒湿的人工气候室内(温度23 ℃,湿度80%),实施统一的水肥管理,即每3 d浇纯水200 mL,每7 d向盆栽施加200 mL基础营养液(主要营养元素质量浓度为:KH2PO41 mg/L、K2SO45 mg/L、MgSO42 mg/L,其他微量元素浓度同霍格兰营养液[24])。
3)施氮。待种芽破土生长4周后进行施氮处理:低氮(N1)处理为施加200 mg/kg尿素(含N 92 mg/kg),高氮(N2)处理为施加400 mg/kg尿素(含N 184 mg/kg),3个月后取盆栽土壤进行土壤培养试验,同时测定其pH、含水率、全氮等指标(表1)。
对接种处理的盆栽进行菌根侵染率测定,检查其是否接种成功(图1)。

表1 3个月后盆栽土壤主要理化性质Table 1 The main physical and chemical properties of potted soil after three months
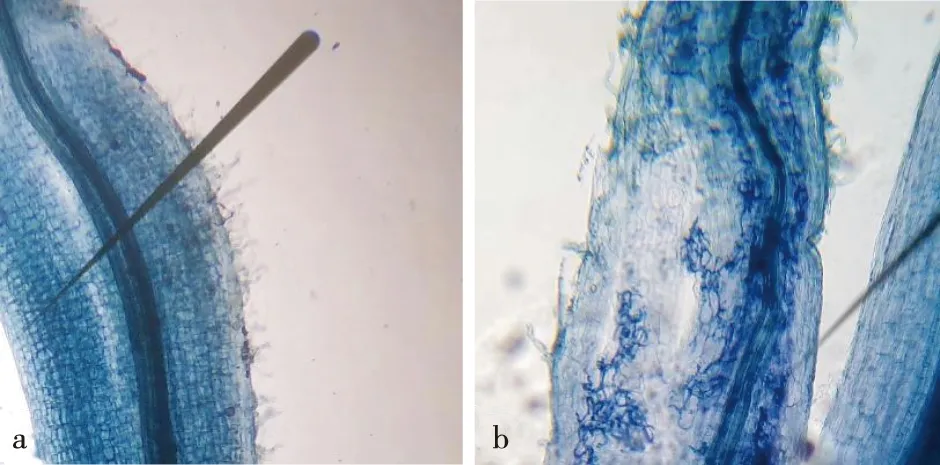
a.未被侵染的根系uninfested root system;b.被侵染的根系infested root system。图1 国槐菌根侵染情况Fig.1 Mycorrhizal infection of S.japonica
4)土壤培养。将取得的盆栽鲜土用2 mm孔径筛筛除其中根系。每个处理分别称取相当于50 g风干土的鲜土于广口塑料烧杯中,每个处理设置21组重复。用称质量法调节含水量至相对含水率为60%。然后用保鲜膜封口,再扎4~5个小孔通气,后将烧杯放置于25 ℃恒温培养箱下暗培养30 d。每隔2 d用称质量法补充含水量至相对含水率为60%,于培养的第1、3、5、7、10、20、30 d随机选取各处理中的3个烧杯取出土壤样品用于硝态氮、铵态氮的测定。
1.3 分析方法
土壤含水率采用烘干法测定,土壤pH及电导率采用电位法测定(土壤和水体积比为1∶5);土壤全氮含量采用凯式定氮法测定;铵态氮采用靛酚蓝比色法测定;硝态氮采用紫外分光光度法测定;其他土壤基本理化性质按照鲍士旦[24]的方法测定。菌根侵染率按照王幼珊等[25]的方法测定。
1.4 数据处理
计算3次重复的平均值用于后续数据分析,采用 Excel 2010、SPSS 22 软件进行数据统计、单因素方差分析(One-way ANOVA)以及双因素方差分析(Two-way ANOVA),采用Sigmaplot 12.5软件作图。采用LSD检验进行多重比较分析(显著性水平设为0.05)。土壤氮矿化速率按照如下公式进行计算:
VN=MN/T。

2 结果与分析
2.1 施氮对菌根侵染率的影响
施氮处理对国槐的菌根侵染率有显著影响(P<0.05)。菌根侵染率随着施氮量的增加呈现出先显著升高(P<0.05)再降低的趋势。不施氮处理(N0)的平均菌根侵染率仅为16.00%,N1浓度的平均菌根侵染率达到45.22%,而N2浓度时平均菌根侵染率为32.44% (图2)。表明在滨海盐土中,氮素的施用在一定范围内促进丛枝菌根真菌与植物根系建立共生关系。但当施氮量达到一定程度时,菌根真菌的生长受到一定限制。

不同小写字母表示不同处理间差异显著(P <0.05)。下同。Different lowercase letters in the figure indicate significant differences between different treatments (P <0.05).The same below.图2 施氮对菌根侵染率的影响Fig.2 Effects of nitrogen application on mycorrhizal infection rates
2.2 接种AMF及施氮对硝态氮、铵态氮含量的影响
硝态氮含量随着施氮量的增加而升高(表2),在培养第1、3、7、20和30天时相同接种处理下,高氮(N2)处理的硝态氮含量显著高于低氮(N1)以及不施氮(N0)处理(P<0.05),相同施氮水平下,接种AMF处理的硝态氮含量均显著高于不接种处理(P<0.05)。在培养初始时(1 d),N0处理下,接种AMF的硝态氮含量低于不接种处理。总体来看,硝态氮含量表现出先增加后降低最后趋于稳定的趋势。

表2 接种AMF及施氮处理的盐土在不同培养时间的硝态氮、铵态氮含量Table 2 The content of nitrate nitrogen and ammonium nitrogen in saline soil inoculated with AMF and nitrogen treatments at different cultivation time mg/kg
施氮并未对铵态氮含量表现出显著的促进作用(表3)。在培养初始时(1 d),相同施氮处理下,接种AMF的铵态氮含量显著低于不接种处理(P<0.05),接种AMF处理中,N1浓度的铵态氮含量显著低于N0和N2处理(P<0.05)。随着培养时间的增加,铵态氮含量表现出先升高而后逐渐降低的趋势。试验结束时,相同施氮处理下,接种AMF处理的铵态氮含量显著高于不接种处理(P<0.05),而在接种处理下,N2处理铵态氮含量要显著高于NO处理。
2.3 接种AMF及施氮对净硝化速率、净氨化速率的影响
随着培养时间的增加,土壤净硝化速率和净氨化速率均表现出逐渐下降的趋势(图3A)。在培养第3天时,不接种AMF条件下,净硝化速率最高的是N1处理,为8.90 mg/(kg·d);接种AMF条件下,净硝化速率最低也是N1处理,为4.90 mg/(kg·d);除N1处理外,接种AMF处理的净硝化速率均大于不接种处理(图3A)。这可能是由于AMF影响了植物根系对土壤氮矿化过程中形成的矿质氮的吸收。

图3 接种AMF及施氮在不同培养时间对盐土的净硝化速率、净氨化速率及净氮矿化速率的影响Fig.3 Effects of AMF inculation and nitrogen fertilizer application on net nitrification rate,net ammonification rate and net nitrogen mineralization of saline soil inoculated at different cultivation time

图柱上不同大写字母表示同一处理不同培养时间差异显著(P<0.05),不同小写字母表示相同培养时间不同处理间差异显著(P<0.05)。Different capital letters on the column indicate significant differences in different incubation times for the same treatment (P<0.05),and different lowercase letters indicate significant differences between different treatments for the same incubation time (P<0.05).图4 接种AMF及施氮对盐土净氮矿化量的影响Fig.4 Effects of AMF inoculation and nitrogen application on net nitrogen mineralization of saline soil
净氨化速率表现出随着培养时间增加而逐渐下降最后趋于稳定的趋势。培养初期(3 d),不接种AMF条件下,施氮处理并未表现出对净氨化速率的促进作用;而接种AMF条件下,施氮处理的净氨化速率高于不施氮处理,最高为N1处理的1.37 mg/(kg·d)。在相同施氮处理下,接种AMF的净氨化速率均表现出高于不接种处理,其中N1处理时差异极显著(P<0.01)(图3B)。这说明接种AMF有助于铵态氮的同化。
2.4 接种AMF及施氮对净氮矿化的影响
分析结果表明,在不接种AMF处理中,N1浓度的氮处理相比N0、N2处理对净氮矿化量的积累表现出更明显的促进作用,在培养的第20、30天均达到显著水平(P<0.05)(图4A)。高氮处理对净氮矿化量的积累并无明显作用,这表明过多的氮添加并不能对滨海盐土的供氮能力产生积极影响。在接种AMF处理中,氮的施用并没有表现出对净氮矿化量的明显促进作用,仅有N2处理的净氮矿化量在第7天显著高于N0、N1处理(P<0.05)(图4B)。
各组处理的净氮矿化速率随着培养时间的增加而逐渐下降并趋于一致(图3C)。
在培养初期,接种AMF处理下,N2浓度的净氮矿化速率高于N0、N1处理,达到最高值9.45 mg/(kg·d);不接种处理下,N1浓度的净氮矿化速率高于N0、N2处理。这进一步说明接种AMF和施高氮处理对滨海盐土的氮矿化能力具有促进作用,而对于不接种AMF的处理来说,更高的氮施用量并没有促进土壤氮矿化速率更多的提升。
2.5 接种AMF及施氮对滨海盐土氮矿化的交互作用
接种AMF和施氮处理对滨海盐土净硝化和净氮矿化过程具有极显著的交互作用(P<0.001),而对净氨化量和净氨化速率的交互作用并不显著(表3)。双因素方差分析结果表明,净硝化量、净硝化速率在不同施氮处理间无显著差异,在接种处理间差异显著(P=0.010),施氮和接种对其交互作用差异显著(P<0.001)。净氨化量和净氨化速率在施氮处理和接种处理下均表现出显著差异(P<0.001),但彼此之间的交互作用并不显著。净氮矿化量以及净氮矿化速率在施氮处理和接种处理下差异均不显著,但交互作用对其产生显著影响(P<0.001)。

表3 土壤氮矿化各项指标方差分析Table 3 Analysis of variance on various indicators of soil nitrogen mineralization
3 讨 论
本试验中,施氮对菌根侵染率具有极显著的促进作用(P<0.01),施氮量为92 mg/kg时菌根侵染率最大。过高的施氮量反而抑制丛枝菌根真菌与植物共生关系的建立,这与前人的研究结果基本一致[26-27]。分析其原因可能是过多的氮添加,致使土壤中的无机氮移动性更强,植物能够吸收更多的氮素,植物对AMF的依赖性因此减弱,分配给从枝菌根真菌的光合产物也随之减少,从而导致侵染率降低。高氮处理的菌根侵染率仍然显著高于不施氮处理(P<0.05),可能是由于外源氮添加同时造成土壤中氮磷比增大,丛枝菌根真菌有助于植物体吸收更多的磷[28],因此植物体为了维持体内氮磷比平衡,而在一定程度上仍然依赖于AMF。

净氮矿化量以及净氮矿化速率均受施氮和接种AMF处理的交互作用影响。有研究表明,高浓度的施氮有利于提高土壤供氮能力[29,31]。但本试验结果显示,在未接种AMF处理中,施氮量为184 mg/kg时净氮矿化量显著低于92 mg/kg施氮处理(P<0.05),过多的氮添加并没有对滨海盐土的供氮能力产生积极作用。另有学者通过相关研究也得出类似结论[31-32],但针对这一现象的解释却不尽相同。例如,张璐等[33]认为高氮添加由于其盐效应降低了土壤pH,从而抑制氮素的矿化。而有外国学者认为,外源施氮促进了各种形式氮素的周转速率,从而降低土壤的矿化潜力[34]。本研究供试土壤为滨海盐土,过量的氮添加与土壤的盐分可能产生交互作用,在盆栽期间加重了盐分对植物的胁迫,从而阻碍了氮素的转移。因此,后续的土壤培养试验过程中,表现出高氮肥对氮矿化量的抑制作用。适宜的氮素施用量是促进滨海盐土氮矿化能力的重要影响因素。
施氮对耐盐植物的菌根侵染率有极显著的促进作用(P<0.01)。施氮量为92 mg/kg时,菌根侵染率达到45.22%;施氮量为184 mg/kg时菌根侵染率仅有32.44%。在盐土条件下,过多的氮添加反而抑制丛枝菌根真菌与植物共生关系的建立。更高的菌根侵染率导致植物对铵态氮更多的吸收,在培养初期(1 d),低氮处理下的铵态氮含量显著低于不施氮和高氮处理(P<0.05)。在培养1和3 d时,相同接种处理下,高氮处理的硝态氮含量显著高于低氮以及不施氮处理(P<0.05),相同施氮水平下,接种AMF处理的硝态氮含量均显著高于不接种处理(P<0.05)。未接种AMF时,高氮处理的净氮矿化量低于低氮处理,过高的氮添加并没有对盐碱土的供氮能力产生积极作用。
在氮矿化过程中,硝化作用除了受到接种处理的影响,同时也受施氮和接种处理的交互作用;施氮和接种处理对氨化作用表现出显著影响(P<0.001),但并未对其产生交互作用;净氮矿化量和净氮矿化速率仅受交互作用影响。适宜的施氮量是提高滨海盐土氮素利用效率以及氮矿化潜力的重要举措,接种丛枝菌根真菌能有效提高滨海盐土氮素利用效率。

