北京城市公园常见乔木土壤真菌群落特征及影响因素
于天赫,张乃莉,于 爽,曲来叶
1 牡丹江师范学院,牡丹江 157000 2 北京林业大学林学院,北京 100083 3 中国科学院生态环境研究中心,北京 100085 4 中国科学院大学,北京 100049
随着近些年我国社会经济的快速发展和人们生活质量需求的不断提升,城市化和工业化进程加剧导致的城市环境污染问题已引起广泛重视。公园作为城市绿地的主体,是城市居民重要的休闲游憩场所之一,且与城市环境质量密切相关[1]。北京市作为中国的首都和国际化城市,人口密集程度高,市区内诸多公园客流量较大,历史悠久的公园每年接待游客可达上千万人次。因此城市公园土壤质量与居民日常生活密不可分,并能在一定程度上反应环境污染,如土壤重金属污染的作用规律。陈潇霖等[2]和田媛等[3]发现北京五环内地区存在不同程度土壤重金属污染。李纯等[4]研究发现北京不同公园之间的土壤重金属污染程度会随地理位置、建成年代不同而发生变化,距离城市中心越近、参观游客量越大、以及建成年代越久的公园人为残留的重金属污染积累也越多。郑袁明等[5]对北京市区30个公园的土壤研究发现,近几十年来土壤铅含量的增加较快,并有随着公园建园时间的延长而不断增加的趋势。
城市土壤是城市生态系统中重要的组成部分,工业化污染排放、废弃物堆积以及汽车尾气排放等城市建设过程中产生的污染物,都会对土壤环境造成巨大影响,并导致土壤中重金属污染的不断累积[2]。重金属污染可以通过口鼻吸入、皮肤接触等方式对人体健康安全造成危害,并对人类赖以生存的环境,包括土壤生物和非生物环境、大气质量和水环境等造成较大范围的污染[6-7]。因此,城市土壤重金属污染的研究已成为了世界广泛关注的环境问题。土壤微生物以土壤为载体,是驱动生物地球化学循环的主要生物类群之一,它对于环境变化和各种污染的响应敏感,被认为是更为敏感的生物指示因子[8-9]。闫华等[10]研究发现,土壤中的微生物往往不能降解重金属,而土壤中积累过量重金属往往会对土壤微生物类群产生毒害作用,限制其所参与的土壤生态过程,从而影响整个生态系统的生态功能。真菌是土壤微生物群落的重要组成部分,真菌多样性、群落结构及其功能类群对重金属污染的响应与适应,是评价土壤生态系统健康稳定的重要因素。有研究发现城市公园土壤重金属铅污染可能会降低土壤真菌多样性[11],也有研究发现重金属铅污染对真菌群落结构的影响相较于真菌多样性可能更为强烈[10]。
北京公园众多、分布区域广,表土环境质量对城市居民的健康有重要影响。但目前尚不清楚土壤重金属含量是否会显著影响城市公园土壤真菌群落特性?哪些生物和非生物因素显著影响土壤真菌群落结构组成和多样性?为此,本研究从北京二环、三环和四环共选取六个典型公园,每个公园选取6种常见乔木(3种常绿+3种落叶)下的土壤进行调查取样,对土壤理化性质和重金属含量进行测量,并通过高通量测序技术分析土壤真菌多样性和群落结构特征,探讨城市公园影响土壤真菌群落特性特征及主要因素,拟为城市公园土壤质量管理提供相关理论依据。
1 研究方法
1.1 试验设计与取样方案
本项研究选取了位于北京市五环内不同建成年代的六个城市公园,包括日坛、月坛、双秀、官园、颐和园和圆明园为研究对象。该研究区域属于典型的暖温带半湿润大陆性季风气候,夏季炎热多雨,冬季寒冷干燥。降雨季节主要集中在夏季的6至8月份,年均降水量约为575.5mm。采样公园基本信息详见表1。位于北京城市中心的日坛和月坛公园,建成年代比较久远,均为1530年;双秀公园和官园公园在所有六个公园中位置居中,分别建成于1984年和2001年;距离城中心较远的颐和园和圆明园公园分别建成于1750年和1707年。
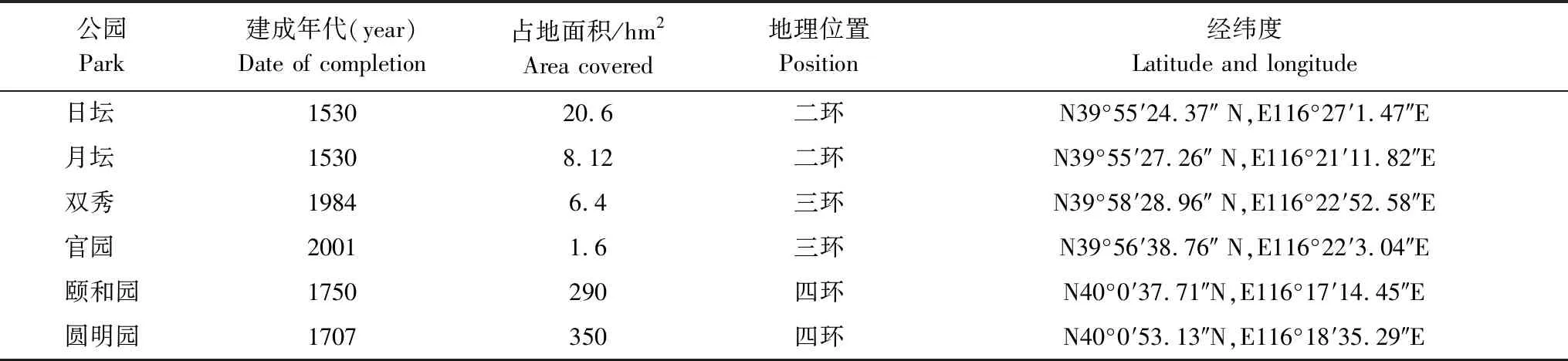
表1 采样公园基本信息
2017年10月,在所选城市公园进行土壤样品采集。以胸径大致相同为标准,在每个公园分别选取6种常见乔木树种,其中3种落叶乔木包括银杏(GinkgobilobaL.)、国槐(SophorajaponicaL.)、毛白杨(PopulustomentosaCarr.)和3种常绿乔木包括油松(PinustabulaeformisCarr.)、白皮松(PinusbungeanaZucc. ex Endl.)、圆柏(Sabinachinensis(L.) Ant.)。每种树种随机选取4株个体(20—30年树龄之间,均匀分散在整个公园),记录距离树木基部1.3m处的胸径。以树干为中心在四周(50cm处)分别设置4个取样位点采集0—10cm表层土壤(尽量选取树下面没有草的地方,取土壤样品时去除地表凋落物层),4个土壤样品充分混合,得到一个混合土样。总计获取土壤混合样本143个(6个公园×6个树种×4个重复=144个,但银杏在颐和园缺失1棵)。将混合样品挑出残留的植物细根、小石子等杂物后,过2mm的尼龙筛,一部分约100g左右,放入塑料封口袋在-80℃冰箱保存,用于进行土壤真菌测定;另一部分土壤样品风干后过100目筛,用于测量土壤理化因子。每一株植物个体采集混合土壤的同时,用环刀取土壤样品放于铝盒,用于土壤含水量测定。
1.2 土壤理化指标测定
土壤pH值:称取风干土壤样品10g左右,置于干燥的50mL烧杯中,加入25mL无CO2的水(水土比为2.5∶1),使用校正好的pH计(德国 SartoriusPB- 10 型号)进行测定。
土壤含水量(SM):称取20g鲜土,置于干燥的大型铝盒中并在天平上称重,准确至0.01g,放入已预热至105℃的烘箱中烘烤至绝干,取出后放入干燥器内进行冷却至室温,进行称重测定,由此通过鲜土和烘干土重差值换算土壤含水量。
土壤全氮(TN)和全碳(TC)含量:称取风干土壤样品约20mg,置于锡舟中,采用元素分析仪(德国 Vario macro cube 型号)进行测定。
土壤重金属铅(Pb)、铬(Cr)、镉(Cd)、锌(Zn)、铜(Cu)、镍(Ni)、锰(Mn)含量:称取约0.0500g(精确到0.0001g)(100目尼龙筛)的风干土样于聚四氟乙烯高压罐中,依次加入3mLHNO3,1mLHF,1mLHClO4,进行消解,采用ICP-OES电感耦合等离子发射光谱仪(美国 ICAP6300 型号)进行测定。
1.3 土壤真菌群落测定
土壤总DNA使用DNeasy Power Soil Kit(Qiagen, 12888- 100, DE)试剂盒及其标准流程提取。采用分光光度计(NanoDrop2000)检测土壤DNA浓度与质量,置于-80℃冰箱保存直至进行下一步分析流程。使用PCR仪(ABI GeneAmp® 9700型)进行PCR扩增,引物序列为ITS3F(5′-GCATCGATGAAGAACGCAGC - 3′)和ITS4R(5′-TCCTCCGCTTATTGATATGC - 3′)。采用TransStart Fastpfu DNA Polymerase,20μL反应体系:5×FastPfu缓冲液(4μL),2.5mmol/L dNTPs(2μL),5μmol/L Forward Primer(0.8μL),5μmol/L Reverse Primer(0.8μL),FastPfu Polymerase(0.4μL),BSA(0.2μL),基因组DNA(10ng),补双蒸水至20μL。PCR反应参数为:(1)95℃预变性3min(2)循环数:30×(95℃变性,30s;55℃退火,30s;72℃延伸45s)(3)72℃保持10min采用2%琼脂糖凝胶电泳检测PCR产物,3μL上样检测电泳图,确认目的条带大小正确,浓度合适后,交由Illumina MiSeq测序平台(上海美吉生物医药科技有限公司)进行建库测序。
利用 Trimmomatic 软件分别对双端Illumina MiSeq测序的原始数据进行质量过滤,然后按照以下标准用Flash进行拼接序列。1)任何质量低于20的序列都会被删去;2)长度超过50bp被保留,低于50bp的被删去;3)含有不明确碱基的序列也被删去;4)引物仅允许2个核苷酸不匹配;5)合并重叠长度大于10bp的序列。运行ITSx去除原始序列文件中的非真菌序列[12],使用QIIME2对操作分类单元(OTU)进行聚类。首先,使用qiimevsearchdereplicate-sequences命令对原始序列进行去重复处理,然后使用qiimefeature-tablefilter-features命令从复杂的序列数据中去除singleton。采用qiimevsearchcluster-features-Open-reference命令在97%的相似度水平进行OTU聚类分析;基于UNITE数据库,使用qiimefeature-classifierclassify-sklearn命令进行序列对比获取分类信息。基于 QIIME2 软件真菌数据注释结果,采用FUNGuild(http://www.stbates.org/guilds/app.php)在线比对,对土壤真菌群落功能类型进行划分。为了消除样品深度的异质性,对序列数据进一步进行均一化处理,总共得到12436个OTU用于后续统计分析。
1.4 数据处理
采用 R 3.4.3 软件进行数据整理和统计分析。采用多重比较方法(Turkey test)分析不同公园土壤铅污染对土壤理化因子、真菌多样性的作用差异;采用混合效应模型分析城市公园类型对土壤理化因子和真菌多样性的影响,其中树种和胸径为随机变量;利用vegan程序包进行基于距离的冗余分析(db-RDA),探讨显著影响土壤真菌群群落组成变化的环境因子,并用同种方法分析土壤真菌功能类群的群落组成对重金属铅和环境变量的响应格局。
2 结果与分析
2.1 城市公园乔木下土壤理化性质
不同公园乔木下土壤pH值、土壤含水量(SM)、全氮含量(TN)、全碳含量(TC)、碳氮比(C/N)均有显著性差异(表2)。pH值范围在8.14—8.72,日坛最高为8.72,圆明园最低为8.14。公园土壤性质整体偏碱性,其中颐和园、月坛、日坛、官园的pH值略高于双秀和圆明园; SM颐和园最高为16.98%,圆明园最低为12.25%;土壤TC和TN含量双秀均最高,分别为2.27g/kg和39.87g/kg,圆明园TN含量最低为1.24g/kg,官园TC含量最低为23.49g/kg;土壤C/N官园最高为20.14,颐和园最低为13.76。六个公园土壤重金属,重金属铅(Pb)含量由高到低依次为官园>月坛>圆明园>颐和园>日坛>双秀,但未达到统计学上的显著水平(P=0.056);其他重金属铬(Cr)、镉(Cd)、锌(Zn)、铜(Cu)、镍(Ni)、锰(Mn)含量均达到极显著性差异(P<0.001)(表2)。

表2 六个城市公园乔木下土壤重金属和理化性质
2.2 城市公园乔木下土壤真菌群落结构概况
通过测序共检测出土壤真菌OTU为12436个,由图1可知,检测出的真菌门主要包括:子囊菌门(Ascomycota)、担子菌门(Basidiomycota)、被孢霉门(Mortierellomycota)、壶菌门(Chytridiomycota)、球囊菌门(Glomeromycota)、隐真菌门(Rozellomycota)以及未确定真菌(Unidentified_Fungi),分别依次占真菌总OTU的73%、14%、4.5%、0.3%、0.1%、0.3% 和7.9%。优势真菌类群主要为子囊菌门,其次为担子菌门,两者之和共占总OTU的87%。

图1 真菌分布比例图 Fig.1 Pie chart of fungal phyla in the soils of Bejing urban parks子囊菌门,Ascomycota;担子菌门,Basidiomycota;被孢霉门,Mortierellomycota;壶菌门,Chytridiomycota;球囊菌门,Glomeromycota;隐真菌门,Rozellomycota;分类地位未确定真菌,Unidentified_Fungi
将子囊菌门进一步鉴定到纲水平上,发现主要包括:酵母菌纲(Saccharomycetes)、盘菌纲(Pezizomycetes)、圆盘菌纲 (Orbiliomycetes)、茶渍纲(Lecanoromycetes)、粪壳菌纲(Sordariomycetes)、虫囊菌纲(Laboulbeniomycetes)、散囊菌纲(Eurotiomycetes)、锤舌菌纲(Leotiomycetes)、座囊菌纲(Dothideomycetes)和未鉴定子囊菌(Ascomycota_unidentified)(图2)。其中粪壳菌纲为子囊菌门的优势类群,其次为座囊菌纲、盘菌纲、散囊菌纲。
不同公园之间土壤真菌群落组成差异显著,其中粪壳菌纲在日坛、月坛、双秀、官园、颐和园和圆明园中的相对丰度分别占68.43%、66.51%、44.98%、55.82%、42.69% 和49.55%,颐和园和圆明园的相对丰度显著高于其他公园;座囊菌纲在圆明园的相对丰度最高,且与其他公园均有显著差异;盘菌纲在月坛和日坛的相对丰度无显著差异,而与其他公园均有显著差异;散囊菌纲在月坛的相对丰度显著高于其他公园,但与双秀无显著差异。

图2 土壤真菌群落纲水平的相对丰富度Fig.2 Relative abundance of soil fungal OTUs at class level
担子菌门真菌在纲水平的类群包括:双担菌纲(Geminibasidiomycetes)、外担子菌纲(Exobasidiomycetes)、囊担子菌纲(Cystobasidiomycetes)、(Classiculomycetes)、小葡萄菌纲(Microbotryomycetes)、黑粉菌纲(Ustilaginomycetes)、银耳纲(Tremellomycetes)、柄锈菌纲(Pucciniomycetes)、伞菌纲(Agaricomycetes)和未确定子囊菌(Basidiomycota_unidentified),其中银耳纲为担子菌门的优势菌纲,其次为伞菌纲。其他菌纲在担子菌门中占比例较小且无显著性差异。银耳纲相对丰度在日坛、月坛、双秀、官园、颐和园和圆明园中分别为61.56%、85.18%、73.96%、62.46%、48.88%、55.84%,在月坛的相对丰度显著高于其他公园;伞菌纲在颐和园的相对丰度显著高于其他公园。另外柄锈菌纲(Pucciniomycetes)在双秀和官园不存在;双担菌纲在圆明园、日坛和双秀不存在; Classiculomycetes在圆明园、月坛、双秀、官园不存在;黑粉菌纲在颐和园和月坛不存在。
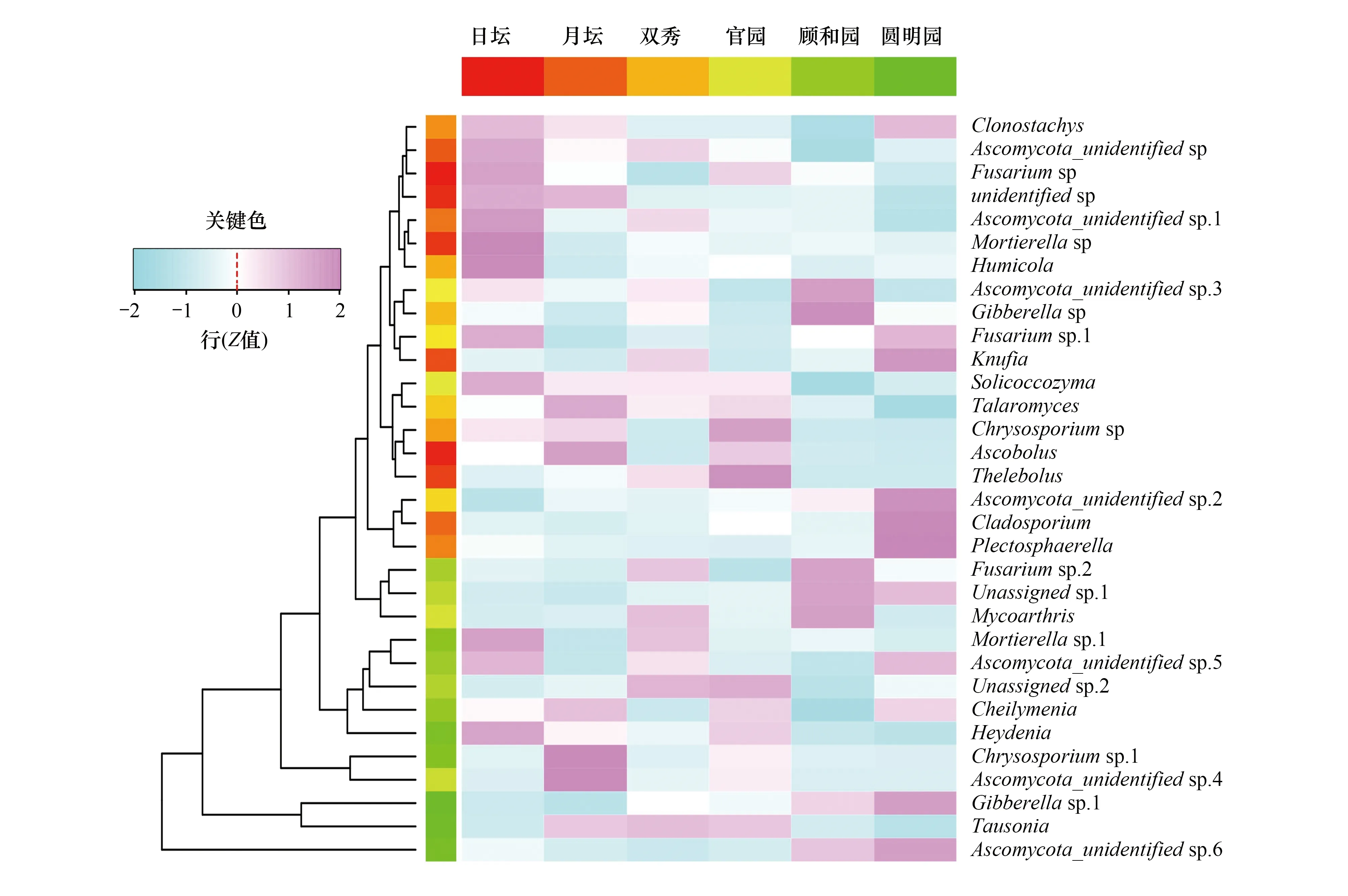
图3 不同公园乔木下土壤真菌群落在属水平聚类分析热图Fig.3 Heatmap of dominant fungal species in the soils of different parks
对六个公园的真菌丰度均值进行聚类分析,选取排名在前32的土壤真菌注释到属水平上(相对丰度>5‰),得到优势属聚类分析热图(图3)。经过Kruskal-Wallis tests检验得知,六个公园优势属没有显著性差异(P=0.438)。由图3可知,日坛公园中Gibberella sp.1属分布最广占总体13.18%,Ascomycota_unidentified sp.2属分布最少占总体的0.13%;月坛公园中Chrysosporium sp.1属分布最广占总体17.59%,Plectosphaerella属分布最少占总体0.21%;双秀公园中Tausonia属分布最广占总体20.94%,Ascobolus属分布最少占总体0.01%;官园公园中Tausonia属分布最广占总体17.57%;Plectosphaerella属分布最少占总体0.003%;颐和园公园中Ascomycota_unidentified sp.6属分布最广占总体23.70%,Cheilymenia属分布最少占总体0.01%;圆明园公园中Ascomycota_unidentified sp.6属分布最广占总体27.09%;Ascobolus属分布最少占总体0.002%。
2.3 城市公园乔木下土壤真菌多样性
不同城市公园之间土壤真菌的香农多样性指数、丰富度指数和均匀度指数均有极显著差异(表3),且日坛均为最高,圆明园均为最低。香农多样性指数结果由高到低依次为:日坛>双秀、官园>月坛>颐和园>圆明园;丰富度指数结果由高到低依次为:日坛>双秀>官园>颐和园>月坛>圆明园;均匀度指数结果由高到低依次为:日坛>双秀、官园>月坛>颐和园、圆明园。

表3 城市公园土壤真菌多样性指数
2.4 影响城市公园乔木下土壤真菌群落结构的因素

图4 不同公园乔木下土壤真菌与环境因子的db-RDA排序图Fig.4 The composition of entire fungal community and their relationship with environmental factors based on db-RDA analysis图中RT,日坛公园;YT,月坛公园;SX,双秀公园;GY,官园公园;YHY,颐和园公园;YMY,圆明园公园
通过RDA分析土壤真菌群落结构与环境因子(土壤重金属和理化指标)的相关性,从图4中可以看出,各个公园之间真菌群落结构分布具有明显分异,说明不同公园之间的真菌群落组成存在明显差异。按照环境因子在RDA轴上的投影长度和排序检验结果可以看出,显著影响土壤真菌群落的环境因子为pH值、Pb含量和土壤TN,其中pH值对真菌群落结构的影响最显著(只显示显著相关的环境因子)。
为了进一步分析环境因子对土壤真菌群落组成的影响,将真菌按照不同门划分的子囊菌门和担子菌门(图5),以及不同功能类群划分的腐生菌(Wood Saprotroph、Soil Saprotroph、Leaf Saprotroph以及Dung Saprotroph)和病原菌(Plant Pathogen)(图6)分别进行RDA分析。从图5可知,子囊菌门真菌在各个公园之间的群落组成分异明显,主要影响的环境因子为pH值、Pb含量和TN含量,其中pH值最为显著;担子菌门真菌群落主要影响的环境因子为pH值、TN和TC含量。从图6可知,腐生真菌在各公园之间的群落构成有明显分异,主要影响的环境因子为pH值和土壤含水量;病原真菌在不同公园之间的群落组成具有差异性,主要影响的环境因子为pH值和Pb含量。

图5 不同公园林下土壤真菌优势分类类群(子囊菌和担子菌)db-RDA分析Fig.5 The composition of ascomycota and basidiomycota fungi in the soils of different parks based on db-RDA analysis
3 讨论与结论
城市公园土壤重金属污染程度往往受其建园时间和空间位置的影响[13-14]。本研究结果发现,六个城市公园中乔木下土壤重金属铬(Cr)、镉(Cd)、锌(Zn)、铜(Cu)、镍(Ni)、锰(Mn)含量在不同公园之间存在极显著差异(P< 0.001),可见公园的建成时间以及空间位置确实影响土壤重金属累积。土壤铅含量没有明显的沿中心城区至外围城区降低的空间分布格局,且未达到显著水平(P=0.056),这与郑袁明等[5]对北京城市公园重金属铅的研究结果不同。其原因首先可能是由于城市土壤铅含量的时空变化格局及其衍生的土壤理化性质的改变受到更为复杂的因素影响,包括人类活动强度、频度和时间累积效应等,还有待于进一步研究;其次可能是取样方法不同导致的差异,本研究选取公园常见乔木下的土壤进行土壤重金属铅(35.4—68.7mg/kg)的检测,而郑袁明等[5]是在北京公园随机取样检测的铅含量(25.47—207.5mg/kg)。但检测均结果表明,六个公园乔木下土壤铅含量均已超过我国“土壤环境质量建议标准”铅污染一级标准的限制值(35mg/kg),需引起重视。

图6 不同公园林下土壤真菌功能类群的db-RDA分析Fig.6 The composition of functional fungal groups in the soils of different parks based on db-RDA analysis
3.1 城市公园乔木下土壤真菌多样性
我们发现不同城市公园间乔木下的土壤真菌多样性和丰富度均有显著差异,土壤重金属铅含量与真菌丰富度指数呈负相关关系(P< 0.05),说明随重金属铅污染程度加深会导致土壤真菌多样性降低,与杨菊云等发现的结果相似[15]。
人类活动引发的城市土壤重金属污染问题日益突出[16],除了居住区,在城市公园的土壤中也会沉积重金属铅等污染物[7],并且随着时间的推移呈现出一定的累积效应,可能对土壤微生物产生毒害作用,比如限制土壤微生物量和酶的活性[17-18]。富集在城市土壤中的重金属元素被认作是土壤微生物吸收的有毒化学物质[19],将对土壤生态系统造成破坏从而导致土壤微生物活性降低[17,20]。重金属生物有效性受土壤酸度的影响,随着pH的降低重金属铅污染的溶解和释放加快,毒害作用不断增强,会降低真菌生存的土壤环境质量,从而降低土壤真菌多样性[21]。因此,土壤重金属毒害可能是解释真菌多样性降低的一个原因。根据竞争假说[22],土壤铅含量可能促进抗逆性较高的某些真菌种类或类群生长,或限制其他真菌种类生长和共存,由此降低土壤真菌多样性[23-24],这可能是土壤真菌多样性随铅含量增加而降低的另一个原因之一。此外,土壤真菌多样性的降低可能限制土壤生态系统功能和稳定性,进而降低城市公园对城市污染的缓冲能力[25]。
3.2 城市公园乔木下土壤子囊真菌群落组成
重金属污染是影响土壤微生物群落结构变化的主要因素之一[26-27]。已有研究发现,子囊真菌是土壤中最丰富的真菌类群,同时作为土壤微生物中最重要的分解者[28],不仅能够降解木质素等难分解的物质,还在养分循环中扮演着关键作用[29-30]。本研究发现北京城市公园土壤真菌优势类群子囊真菌受重金属铅的显著影响,db-RDA分析发现重金属铅是影响子囊菌门真菌群落组成的主要因子,可见重金属铅可能通过影响真菌原有的群落结构以及类群间的关系,从而改变整个真菌群落组成[31]。
此外,土壤养分与酸碱环境也对土壤真菌群落组成有显著影响。城市公园土壤中一般含有较高的有机碳、氮含量,从而导致土壤真菌生物量往往显著高于自然生态系统[32]。Sakamoto K[33]等研究发现土壤C/N比是影响真菌生长的主要因素。由于真菌对有机底物的利用率较高,因此土壤C/N比值较高的土壤更有利于真菌的生长。但不同真菌对C/N比响应程度不同[34],因而随土壤C/N比值变化真菌群落组成也发生变化。我们发现双秀公园C/N含量较高,子囊菌门的相对丰度也比其他公园高,表明真菌群落结构的变化与土壤养分密切相关[35]。土壤pH值对土壤真菌的生长繁殖也有显著影响[36]。已有研究表明真菌往往在酸性(pH=5.5)的土壤环境中生长状况最佳[37],但pH值在5—9之间也不会对真菌的生长产生抑制作用[38]。本研究的六个城市公园土壤pH值范围为8.14—8.72,属于偏碱性土壤。本研究结果表明,土壤pH值显著影响真菌,包括子囊菌门和担子菌门的群落组成,并与子囊菌门的真菌丰富度指数呈显著正相关关系(P< 0.001),这说明随着土壤pH升高会抑制优势子囊菌,促进多种子囊菌的共存,导致多样性增加。
3.3 城市公园土壤真菌功能类群
土壤真菌功能类群可能同样受到土壤重金属污染和其他环境条件的影响[39]。土壤真菌功能类群主要包括腐生真菌和病原真菌。腐生真菌在凋落物分解过程中起到关键作用,对营养循环等许多生态系统过程至关重要[40],而病原真菌则对公园植物产生危害,成为城市居民健康的潜在威胁[41]。
通过db-RDA排序分析,我们发现土壤腐生真菌群落组成主要受土壤水分含量和pH的影响,而非土壤铅含量的影响。土壤 pH与真菌腐生真菌多样性呈正相关关系,这与Yamanaka Takashi等[42]研究结果一致,说明pH升高可能限制了某些优势真菌的生长。与腐生真菌不同的是土壤病原真菌明显受到土壤重金属铅含量的影响。Curguz等[43]研究发现暴露在土壤中的重金属污染会明显抑制病原菌的生长和活性。如果不同病原真菌对土壤铅含量存在差异性响应,可能将导致群落组成随之改变。另外,本研究发现土壤pH值与病原菌OTU数量呈负相关关系(P< 0.05)。有研究表明通过调控土壤微环境的酸碱性,使微生物栖息地微环境处于偏碱性状态下,可以抑制病原菌孢子的活性,使其有效地控制病原菌的生长[44]。
综上所述,北京城市公园乔木下的土壤真菌群落多样性、群落组成以及优势类群主要受到土壤pH值、土壤养分和水分以及土壤重金属铅的调控。重金属铅含量增加降低土壤真菌多样性,显著影响子囊真菌类群的群落组成。伴随城市公园土壤铅污染而来的病原真菌的多样性和群落组成的改变影响公园生态系统稳定以及环境健康,需要引起公园管理部门的重视。
参考文献(References):
[1] 张娟, 王艳春, 田宇. 北京市属公园土壤重金属分布及风险评价. 环境科学与技术, 2012, 35(6): 161- 164.
[2] 陈潇霖, 杨丹, 胡迪青, 连冬齐, 王学东. 北京土壤重金属分布及评价——以五环以内为例. 环境科学与技术, 2012, 35(S2): 78- 81.
[3] 田媛, 郭希娟, 刘效兰. 北京市不同功能区土壤重金属污染探究. 环境科学与技术, 2010, 33(12F): 83- 86.
[4] 李纯, 岑况, 王雪. 北京市主要公园土壤中铅含量及污染评价. 环境科学与技术, 2006, 29(10): 64- 66.
[5] 郑袁明, 余轲, 吴泓涛, 黄泽春, 陈煌, 吴晓, 田勤政, 范克科, 陈同斌. 北京城市公园土壤铅含量及其污染评价. 地理研究, 2002, 21(4): 418- 424.
[6] 刘玉燕, 刘敏, 刘浩峰. 城市土壤重金属污染特征分析. 土壤通报, 2006, 37(1): 184- 188.
[7] 陈秀端. 中国城市土壤重金属空间分布与污染研究. 环境科学与技术, 2011, 34(12H): 60- 65.
[8] Zhou J Z, Xue K, Xie J P, Deng Y, Wu L Y, Cheng X L, Fei S F, Deng S P, He Z L, Van Nostrand J D, Luo Y Q. Microbial mediation of carbon-cycle feedbacks to climate warming. Nature Climate Change, 2012, 2(2): 106- 110.
[9] 孙波, 赵其国. 土壤质量与持续环境——Ⅲ. 土壤质量评价的生物学指标. 土壤, 1997, 29(5): 225- 234.
[10] 闫华, 欧阳明, 张旭辉, 应多, 赵熙君, 张玉娇, 郑聚锋, 刘晓雨, 卞荣军, 李恋卿, 潘根兴. 不同程度重金属污染对稻田土壤真菌群落结构的影响. 土壤, 2018, 50(3): 513- 521.
[11] 王建坤. 铅锌污染对土壤微生物多样性的影响[D]. 成都: 四川农业大学, 2009: 1- 49.
[12] Wurzbacher C, Larsson E, Bengtsson-Palme J, Van Den Wyngaert S, Svantesson S, Kristiansson E, Kagami M, Nilsson R H. Introducing ribosomal tandem repeat barcoding for fungi. Molecular Ecology Resources, 2019, 19(1): 118- 127.
[13] Imperato M, Adamo P, Naimo D, Arienzo M, Stanzione D, Violante P. Spatial distribution of heavy metals in urban soils of Naples city (Italy). Environmental Pollution, 2003, 124(2): 247- 256.
[14] Szolnoki Z, Farsang A, Puskás I. Cumulative impacts of human activities on urban garden soils: origin and accumulation of metals. Environmental Pollution, 2013, 177: 106- 115.
[15] 杨菊云. 根系分泌物对苔草铁膜形成及铅胁迫下对根际环境的影响[D]. 南昌: 南昌大学, 2014: 56- 90.
[16] McBride M B, Shayler H A, Spliethoff H M, Mitchell R G, Marquez-Bravo L G, Ferenz G S, Russell-Anelli J M, Casey L, Bachman S. Concentrations of lead, cadmium and barium in urban garden-grown vegetables: the impact of soil variables. Environmental Pollution, 2014, 194: 254- 261.
[17] Papa S, Bartoli G, Pellegrino A, Fioretto A. Microbial activities and trace element contents in an urban soil. Environmental Monitoring and Assessment, 2010, 165(1/4): 193- 203.
[18] Narendrula-Kotha R, Nkongolo K K. Bacterial and fungal community structure and diversity in a mining region under long-term metal exposure revealed by metagenomics sequencing. Ecological Genetics and Genomics, 2017, 2: 13- 24.
[19] Giller K E, Witter E, Mcgrath S P. Toxicity of heavy metals to microorganisms and microbial processes in agricultural soils: a review. Soil Biology and Biochemistry, 1998, 30(10/11): 1389- 1414.
[20] Yang Y G, Campbell C D, Clark L, Cameron C M, Paterson E. Microbial indicators of heavy metal contamination in urban and rural soils. Chemosphere, 2006, 63(11): 1942- 1952.
[21] 夏娟娟. 植物促生内生细菌的筛选及其强化油菜富集土壤铅镉重金属的研究[D]. 南京: 南京农业大学, 2006.
[22] Tilman D. Resource Competition and Community Structure. Princeton: Princeton University Press, 1982.
[23] 肖建强, 张维维, 于立忠, 杨凯. 辽东山区次生林林窗大小对土壤微生物量碳、氮、磷的影响. 生态学杂志, 2017, 36(11): 3043- 3048.
[24] 陈晓, 刘勇, 李国雷, 孙巧玉, 张硕, 许飞. 土壤真菌研究方法及人为干扰对森林土壤真菌群落影响研究进展. 世界林业研究, 2011, 24(5): 7- 12.
[25] Lagomarsino A, Moscatelli M C, Di Tizio A, Mancinelli R, Grego S, Marinari S. Soil biochemical indicators as a tool to assess the short-term impact of agricultural management on changes in organic C in a Mediterranean environment. Ecological Indicators, 2009, 9(3): 518- 527.
[26] 陈静, 刘荣辉, 陈岩贽, 王炜, 温勇, 刘晓文, 周洪波. 重金属污染对土壤微生物生态的影响. 生命科学, 2018, 30(6): 667- 672.
[27] 胥正钢, 赵运林, 周晓梅, 许永立. 重金属污染对土壤微生物影响的研究进展. 江西农业学报, 2014, 26(4): 53- 55, 60- 60.
[28] Ma A Z, Zhuang X L, Wu J M, Cui M M, Lv D, Liu C Z, Zhuang G Q. Ascomycota members dominate fungal communities during straw residue decomposition in arable soil. PLoS One, 2013, 8(6): e66146.
[29] Beimforde C, Feldberg K, Nylinder S, Rikkinen J, Tuovila H, Dörfelt H, Gube M, Jackson D J, Reitner J, Seyfullah L J, Schmidt A R. Estimating the Phanerozoic history of the Ascomycota lineages: combining fossil and molecular data. Molecular Phylogenetics and Evolution, 2014, 78: 386- 398.
[30] 陈雅昕, 邓娇娇, 周永斌, 殷有, 魏亚伟, 白雪娇, 朱文旭. 蒙古栎天然次生林土壤微生物群落特征及其与土壤理化特性的关系. 沈阳农业大学学报, 2018, 49(4): 409- 416.
[31] 谢学辉, 范凤霞, 袁学武, 朱文祥, 刘娜, 平婧, 柳建设. 德兴铜矿尾矿重金属污染对土壤中微生物多样性的影响. 微生物学通报, 2012, 39(5): 624- 637.
[32] Kaye J P, McCulley R L, Burke I C. Carbon fluxes, nitrogen cycling, and soil microbial communities in adjacent urban, native and agricultural ecosystems. Global Change Biology, 2005, 11(4): 575- 587.
[33] Sakamoto K, Oba Y. Effect of fungal to bacterial biomass ratio on the relationship between CO2evolution and total soil microbial biomass. Biology and Fertility of Soils, 1994, 17(1): 39- 44.
[34] 聂三安, 王祎, 雷秀美, 赵丽霞, 林瑞余, 王飞, 邢世和. 黄泥田土壤真菌群落结构和功能类群组成对施肥的响应. 应用生态学报, 2018, 29(8): 2721- 2729.
[35] Paungfoo-Lonhienne C, Yeoh Y K, Kasinadhuni N R P, Lonhienne T G A, Robinson N, Hugenholtz P, Ragan M A, Schmidt S. Nitrogen fertilizer dose alters fungal communities in sugarcane soil and rhizosphere. Scientific Reports, 2015, 5: 8678.
[36] 韩世忠, 高人, 李爱萍, 马红亮, 尹云锋, 司友涛, 陈仕东, 郑群瑞. 中亚热带地区两种森林植被类型土壤微生物群落结构. 应用生态学报, 2015, 26(7): 2151- 2158.
[37] 孙英杰, 何成新, 徐广平, 莫凌, 顾大形, 姚月锋, 黄玉清. 广西十万大山地区不同植被类型土壤微生物特征. 生态学杂志, 2015, 34(2): 352- 359.
[38] Nevarez L, Vasseur V, Le Madec L, Le Bras M A, Coroller L, Leguérinel I, Barbier G. Physiological traits ofPenicilliumglabrumstrain LCP 08.5568, a filamentous fungus isolated from bottled aromatised mineral water. International Journal of Food Microbiology, 2009, 130(3): 166- 171.
[39] Burke D J, Smemo K A, López-Gutiérrez J C, DeForest J L. Soil fungi influence the distribution of microbial functional groups that mediate forest greenhouse gas emissions. Soil Biology and Biochemistry, 2012, 53: 112- 119.
[40] Wang F, Yao J, Si Y, Chen H L, Russel M, Chen K, Qian Y G, Zaray G, Bramanti E. Short-time effect of heavy metals upon microbial community activity. Journal of Hazardous Materials, 2010, 173(1/3): 510- 516.
[41] 刘登义. 病原菌与自然植物种群Ⅱ病原菌与植物种群生物学. 生态学报, 1996, 16(6): 660- 663.
[42] Yamanaka T. The effect of pH on the growth of saprotrophic and ectomycorrhizal ammonia fungiinvitro. Mycologia, 2003, 95(4): 584- 589.
[43] Curguz V G, Tabakovic-Tosic M, Veselinovic M, Raicevic V, Drazic D, Jovanovic L J, Kikovic D. The influence of heavy metals on the growth of ectomycorrhizal fungi. Minerva Biotecnologica, 2010, 22(1): 17- 22.
[44] 王莉, 李宝聚, 石延霞. 酸碱微环境对三种黄瓜主要真菌病原菌的影响. 生态学报, 2005, 25(4): 808- 813.

