绞股蓝正常茎转变为根状茎的形态结构和内源激素含量变化
彭 震,朱 里,罗 庆,高建有,查满荣,彭小列,郭惠红,刘世彪*
(1. 吉首大学生物资源与环境科学学院,湖南 吉首 416000;2. 北京林业大学生物科学与技术学院,北京 100083)
绞股蓝(Gynostemma pentaphyllum)为葫芦科绞股蓝属多年生草质藤本,又名五叶参、七叶参、七叶胆等。绞股蓝因主要分布于秦岭以南地区、体内富含绞股蓝皂苷且与人参皂苷构型相同而被誉为“南方人参”。 作为重要的药食两用植物,绞股蓝具有抗炎、抗肿瘤、降血压血脂、降血糖、抗氧化、抗衰老、保肝护肝、调节免疫和神经系统功能等多种药理功效[1—2]。自然条件下,绞股蓝既有种子繁殖又有营养繁殖,其营养繁殖通常以地下根状茎分蘖、匍匐茎节位形成不定根和不定芽形式产生新的植株。但在秋末冬初时,绞股蓝藤蔓会向地面下垂生长,茎端触地后节间伸长膨大,末端弯曲并钻入土中在地下形成根状茎,一般称之为“珠芽”[3]。珠芽在地下分化出多个腋芽和侧枝,越冬后再萌发出数株新苗,而原来的母株藤蔓则在冬季枯死[4]。对于绞股蓝这种罕见的繁殖行为,人们通常视之为适应冬季环境的繁殖策略。目前对于绞股蓝茎端向根状茎转化的研究较少,杨琦[5]对根状茎的组织结构进行解剖学观察,Yang等[6]对绞股蓝的空中茎、膨大茎和根状茎转化进行比较转录组测序,鉴定了相关差异表达基因,从分子水平阐述其形成机制。本研究观察绞股蓝茎端形成根状茎的变化过程和结构特点,并分段测定不同转化时期茎端部分内源激素含量,以期为研究该特殊的茎端转变机制提供参考依据。
1 材料与方法
1.1 植物材料
生长正常的平利2号绞股蓝,栽培于吉首大学种质圃。
1.2 仪器与试剂
HM310型切片机,TG-16G台式高速离心机,AGLIENT1290高效液相色谱仪,SCIEX-6500Qtrap(MSMS),CHA-2气浴恒温摇床,水浴氮吹仪,吲哚乙酸(IAA)、赤霉素(GA3)和茉莉酸(JA)标准品,CNWC18 QuEChers填料,色谱级甲醇和乙腈。
1.3 方法
1.3.1 形态变化观察
于2020年10月中旬至2021年4月上旬期间,连续观察绞股蓝藤蔓茎端的生长方向和入土状态,拍照并记录各发育阶段特征。于4月统计50枝入土母藤发育出的根状茎体系的二级和三级腋芽或侧枝数目,计算营养繁殖的增殖倍数。
1.3.2 解剖学观察
根据上述观察将绞股蓝根状茎的形成分为三个阶段:空中正常芽阶段、接触地面变态芽阶段、地下根状茎阶段(图1、图2)。取三阶段茎端材料,FAA固定,常规石蜡切片法制片,番红固绿和高碘酸-希夫试剂染色[7]。

图1 绞股蓝茎端发育为根状茎过程Fig. 1 The transition of aerial stem develop into rhizome in Gynostemma pentaphyllum

图2 绞股蓝茎端形态发育三阶段及区段划分Fig. 2 Partition of the stem apex at three stages in aerial stem-to-rhizome transition in Gynostemma pentaphyllum
1.3.3 激素含量测定
1.3.3.1 样品采集
将图2中变态芽和根状茎的茎端从顶部向基部分为 4段:a为尖端段(生长点和第 1~2茎节),b为弯曲段(第三茎节,形成弯钩结构钻入土中),c为膨大段(顶端较小,基端变大),d为稳定段(不再膨大)。空中的正常芽尚未膨大,但节位仍按此划分。剪取 3支相同区段的材料混合浸入液氮中,转至-80 ℃冰箱保存,用于激素含量测定。3个生物学重复取平均值。
1.3.3.2 激素测定
采用液质联用法检测植物内源生长素 IAA、赤霉素GA3和茉莉酸JA含量。
取上述激素标准品和甲醇溶液配制终浓度为0.1~200 ng·mL-1各级标准溶液。取色谱纯甲醇和超纯水各900 mL,分别加入1 mL甲酸配制有机和无机流动相。参考敖兰吉亚等[8]的方法测定内源激素含量。
2 结果与分析
2.1 绞股蓝根状茎形成的形态结构变化
2.1.1 根状茎形成的形态变化
如图1所示,绞股蓝正常芽须经过变态芽发育为根状茎。正常的空中茎为绿色,叶片较大(图1: A),触地后或原在地面匍匐生长的茎端前两节处从横向生长转为向地面方向生长。其后芽尖下第3节发生弯曲,并由弯曲处最先钻入土中(图1: B~C),第4节及以后1~2节位显著膨大,再后节段则不膨大仍保持母藤大小(图1: B),这一阶段为变态芽阶段,既“珠芽”,其茎具弯钩,淡绿色,叶变小,无须根。变态芽入土后,茎为黄白色,叶极小,第5节以后长出须根,并分化出若干腋芽,腋芽外有鳞片叶,即为根状茎阶段(图1: D~F)。变态茎和根状茎上端空中母藤干枯死亡(图1: F)。根状茎多个侧芽在来春3~4月萌发成幼苗(图1: F)。
绞股蓝根状茎的增殖能力较强,1枝入土后的母藤茎端经根状茎可发育出多个二级和三级侧芽或侧枝。统计50个入土茎端,其中发育出1芽(枝)的有 19个(占总数 38%),2芽(枝)和 3芽(枝)的各 12个(24%),4 芽(枝)的 2 个(4%),5 芽(枝)的 4 个(8%),5芽(枝)以上的1个(2%),新芽的增殖倍数平均2.28,即1枝母藤越冬后可长出2.28株幼苗。
2.1.2 根状茎形成中的结构特征
绞股蓝正常茎端形成根状茎的过程可典型地分为三个阶段:正常芽、变态芽、根状茎(图2),各阶段的主要结构特征如图3所示。
绞股蓝的正常茎、变态茎和根状茎的组织结构相似,均具有葫芦科植物的基本特征。最外为一层表皮细胞,向内为数层体积较大的皮层细胞,其内皮层细胞为一圈淀粉鞘,再内为内外两轮9~10个双韧维管束,维管束之间为髓射线,中央为髓(图3:A~C)。但正常茎具 5个棱槽,凸起的棱内有发达的厚角组织(图3: A),而变态茎和根状茎为圆形,厚角组织不发达。正常茎的淀粉鞘内具有较少的淀粉粒(平均粒径 1.89 μm),髓中有少量淀粉粒(图3: A)。变态茎淀粉鞘细胞内有多数较小淀粉粒(平均粒径2.25 μm),淀粉粒位于细胞下端,表现为向重力沉降现象(图3: C),其髓和髓射线细胞具有丰富而较大的淀粉粒(髓射线内平均粒径5.56 μm,髓中9 μm,图3: B)。根状茎的淀粉粒积累部位与变态茎相同,但髓中淀粉粒体积更大(平均粒径 10.56 μm,图3:D)。在根状茎尖弯曲段细胞内未见淀粉粒积累(图3:E),但在弯曲段基端的膨大段,细胞体积增大且髓中具淀粉粒,而在弯曲段顶端的芽尖段,细胞体积较小且细胞核染色较深,无淀粉粒积累(图3: F)。

图3 绞股蓝变态茎和根状茎的结构特征Fig. 3 Structure traits of modified stem and rhizome in Gynostemma pentaphyllum
2.2 绞股蓝根状茎形成中的内源激素含量变化
测定图2中根状茎发育三个阶段四个部位的生长素IAA、赤霉素GA3和茉莉酸JA含量变化。由图4可见,激素对绞股蓝不同时期和不同节段茎端的发育具有重要的调节作用。从发育阶段看,正常茎端的生长素、赤霉素和茉莉酸含量均为最高,变态茎端次之,根状茎最低,反映了入土前的正常茎处于活跃的生长期,需大量激素促成,而入土后根状茎处于休眠半休眠状态,生理活动受抑制,激素含量较低。
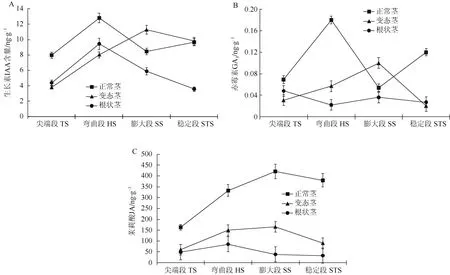
图4 绞股蓝根状茎形成阶段中茎尖各节段的激素含量Fig. 4 Phytohormone contents in 4 parts of stem apex during rhizome formation in Gynostemma pentaphyllum
从茎端部位看,三种激素含量从芽尖段、弯曲段、膨大段至稳定段总体表现为先升后降的趋势。生长素含量变化在正常茎表现为“升–降–升”,在变态茎表现为“升–升–降”,在根状茎则为“升–降–降”,赤霉素含量在正常茎和变态茎中的变化趋势与生长素相同,波动幅度更大,而在根状茎表现为“降–升–降”趋势但幅度较小;茉莉酸含量在正常茎表现为“升–升–降”且最终含量显著高于芽尖,在变态茎表现为“升–升–降”但幅度较小,在根状茎表现为较小的“升–降–降”趋势。生长素、赤霉素和茉莉酸在变态茎中的变化规律相似,茉莉酸在正常茎、变态茎和根状茎中的变化规律相似。总体来看,生长素、赤霉素和茉莉酸在变态茎的弯曲段含量明显升高,在膨大段达最高值,说明三者共同调控变态茎的弯曲和膨大生长;生长素在根状茎的弯曲段升至最高而赤霉素和茉莉酸含量在各节段变化不显著,说明生长素在根状茎的弯曲生长中发挥主要作用。
3 讨论
根状茎是生长于地下但仍具有茎的基本形态和结构特征的变态茎。根状茎通常来源于植株茎基部的不定芽或越冬芽,或实生苗子叶腋芽和真叶腋芽[7]。绞股蓝种子实生苗不能直接形成根状茎,只能由原来的根状茎增殖或越冬前由藤蔓茎端入土形成根状茎,而后者在植物界中较为罕见,正如本文所示。绞股蓝变态茎和根状茎的解剖结构与正常茎相似,但它们的髓细胞体积明显增大,且正常茎只有淀粉鞘细胞积累淀粉粒,而变态茎和根状茎的淀粉鞘、髓和髓射线细胞中均可积累大量淀粉粒,且体积较大,这与前人的观察结果相一致[5]。根状茎是碳水化合物、营养物质和水的储藏器官,淀粉作为重要的储藏成分,南荻根状茎的淀粉在11月中旬成熟期达最大值,在5月营养生长旺盛期具最小值,与可溶性糖含量正好相反[8]。绞股蓝秋冬季淀粉粒的积累有利于根状茎的增粗,与其越冬的生理功能相适应。作为多年生草质藤本,绞股蓝地上部分在冬季枯萎死亡,但茎端在地下形成根状茎的同时,分化出2.28倍的新芽,开春后形成多株新苗。因此,根状茎的形成又是一套营养繁殖再生系统的构建,这一在与环境长期互动中发展起来的灵活的繁衍策略,极大地提高了物种的生存力和成苗率,提高了种群数量,生产中则可用于保持品种的优良性状和种苗扩增。
根状茎的发育是一个复杂的生物学进程,由不同的内源物质和环境因子等诱导发生。绞股蓝在发育为变态茎之时,茎前端形成弯钩结构,使其在钻入土中时免受土壤损伤,这与双子叶植物种子幼苗出土时的下胚轴顶端部位因土壤压力而发生的“顶端弯钩”结构极为类似[9],只不过绞股蓝是入土而幼苗是出土,其目的都是通过影响生长素的极性运输导致其沿重力刺激方向的不对称分布,从而造成重力反应器官的不对称生长。生长素与根状茎的膨大紧密相关,如莲藕的膨大与IAA含量呈正相关关系[10],而本研究最高的生长素含量出现在根状茎的弯曲段和变态茎的膨大段。绞股蓝变态茎弯曲段的赤霉素含量有所上升,至膨大段增至最高,说明它也是促成绞股蓝茎端膨大的重要激素,这与较高浓度赤霉素有利于姜和马铃薯根状茎膨大的结论相符[11—12],但已经膨大且稳定的根状茎赤霉素含量较低。茉莉酸在调节拟南芥(Arabidopsis thaliana)暗形态建成的过程中与光信号通路存在互作关系,它能在暗中抑制乙烯诱导的幼苗顶端弯钩形成,抑制下胚轴伸长并促进子叶打开[13—14]。绞股蓝茉莉酸含量在根状茎各节段的含量均较低且持续下降,表现出与幼苗出土的相反功能,以适应入土越冬环境。总体来看,绞股蓝的生长素、赤霉素和茉莉酸含量在生理旺盛的正常茎中含量最高,在变态茎中次之,在生理活动受抑制的根状茎中最低。这三种激素在变态茎的弯曲段含量明显升高,在膨大段达最高值,它们共同调控绞股蓝茎端弯曲和膨大生长,而生长素在根状茎弯曲段升至最高后连续下降,赤霉素和茉莉酸含量在各节段变化不显著,说明生长素在根状茎的弯曲生长中发挥功能。
绞股蓝变态茎的向地性生长和细胞中淀粉粒的向重力沉降,说明根状茎形成也是一种向重力性转变[15]。最近本课题组报道了编码 YUCCA、IDD、LAZY1和ARP2/3复合体的向地性基因在绞股蓝茎端转变过程中显著上调,其协调控制使地上茎获得类似于根的正向地性从而向地生长[6],同时参与这一转变的还有与苯丙烷生物合成、光周期、植物激素信号转导、碳水化合物代谢等差异基因。同时,这一转变还与 MiR159-MYB29,miR166-ECH2/SGT-like,miR156-SPL6/13A 和 miR396-GRF5-like modules等小RNA的转录后水平调控靶基因的表达有关[16],提示从分子水平入手将有助于对这一现象的深入理解。

