右美托咪定通过α2AR介导的ERK1/2减轻急性肺损伤大鼠肺水肿*
夏明珠, 王 琦, 黄 志, 乐 琴, 姜远旭△
[1深圳市罗湖医院集团罗湖区人民医院,2深圳市人民医院(南方科技大学第一附属医院,暨南大学第二临床医学院)麻醉科,3深圳市麻醉医学工程技术中心,广东深圳518020]
急性肺损伤(acute lung injury,ALI)是急性呼吸窘 迫 综 合 征(acute respiratory distress syndrome,ARDS)的早期形式,肺水肿是ALI 最重要的特征[1]。肺水肿导致的顽固性低氧血症,常危及患者生命。尽管过去对ALI 的治疗作了多种探索,但只有小潮气量肺保护性通气及俯卧位通气收到了比较明确的效果[2],药物治疗尚未取得突破。因ALI发病机制复杂,虽然在某些方面取得了进展,但ALI 临床死亡率仍然高达30%~40%[2],给家庭社会带来了沉重负担。因此,寻求有效减轻肺水肿的治疗药物尤为重要。
右美托咪定(dexmedetomidine,Dex)是一种高选择 性α2肾 上腺素 能受体(α2adrenergic receptors,α2AR)激动剂,具有良好的镇静作用[3]。近年的研究发现,Dex 可抑制肿瘤坏死因子α(tumor necrosis factor-α,TNF-α)和白细胞介素1β(interleukin-1β,IL-1β)等炎症细胞因子而发挥抗炎作用[4-6],且能减轻不同致病因素所致的ALI 肺水肿[7-8]。在前期研究中,我们发现Dex 减轻肺水肿的作用与上调水通道蛋白(aquaporin,AQP)有关[9]。研究表明,肺泡内水的清除不但与AQP 有关、更与肺泡上皮细胞钠离子转运有关[10],其中钠钾ATP 酶(Na+/K+-ATPase)在钠离子转运及肺泡液体转运中扮演重要角色[11-12]。那么,Dex 减轻肺水肿的作用是否与Na+/K+-ATPase 的表达有关,其机制又如何,尚不清楚。因此,本研究致力于观察Dex 是否通过上调Na+/K+-ATPase 表达而减轻脂多糖诱导的ALI 相关肺水肿,同时进一步探究其机制。
材料和方法
1 材料
1.1 实验动物 SPF 级Wistar 大鼠24 只,4~6 周龄,体重180~220 g,购于广东省医学实验动物中心,许可证号为SCXK(粤)2019-0035。所有大鼠均在恒温(25℃),恒湿(50%)条件下饲养,实验前均经历至少1个昼夜循环,且禁食12 h,自由饮水。
1.2 药物和试剂 细菌脂多糖(lipopolysaccharide,LPS;Escherichia coli055:B5)购自Sigma;右美托咪定(江苏恒瑞医药公司);测定TNF-α、IL-β、IL-6 和IL-10 的ELISA 试剂盒以及测定丙二醛(malonaldehyde,MDA)的和髓过氧化物酶(myeloperoxidase,MPO)的试剂盒(上海江莱生物科技有限公司);抗α1Na+/K+-ATPase、β1Na+/K+-ATPase 和细胞外信号调节激 酶1/2(extracellular signal-regulated kinase 1/2,ERK1/2)抗体(Abcam);辣根过氧化物酶标记的羊抗兔IgG Ⅱ抗(CST);抗β-actin抗体(Santa Cruz)。
2 方法
2.1 模型建立和分组 24 只大鼠随机分为生理盐水(normal saline,NS)对照组、急性肺损伤模型组(LPS 组)、右美托咪定治疗组(LPS+Dex 组)和α2AR抑制剂育亨宾(yohimbine,YHB)和右美托咪定合用治疗组(LPS+Dex+YHB 组)。LPS组大鼠经腹腔注射LPS(20 mg/kg)诱导ALI模型;LPS+Dex组大鼠于LPS注射后即刻腹腔注射Dex 100 μg/kg 进行干预;LPS+Dex+YHB 组大鼠腹腔注射0.1 mg/kg YHB,30 min后注射LPS 和Dex;以腹腔注射NS 作为对照。干预完成后8 h,腹腔注射3%戊巴比妥钠50 mg/kg 麻醉大鼠,颈动脉放血处死动物。
2.2 肺组织病理学检查 取部分肺组织用10%中性甲醛固定,石蜡包埋及切片,HE 染色。采用半定量评分系统评价肺损伤,包括肺泡充血、肺泡出血、中性粒细胞浸润和肺泡壁厚度。评分标准如下:0分为无损伤,1 分为轻度损伤(25%),2 分为中度损伤(50%),3 分为重度损伤(75%),4 分为极重度损伤(100%)。各项评定分数相加为肺损伤总评分。
2.3 动脉血氧分压(PaO2)及氧合指数(PaO2/FiO2)的检测 大鼠处死前,用肝素注射器经颈动脉抽取动脉血0.5 mL 进行血气分析,测PaO2,依据吸入氧浓度计算PaO2/FiO2。
2.4 肺指数及肺组织湿/干重比(W/D)的测定 大鼠处死后,立即剖胸,取出全肺,称重。以全肺湿重除以体重得出的数值为肺指数。取出右肺上叶,精确称重后(湿重),置75 ℃恒温烤箱中,烘烤24 h 至恒重后称重(干重),计算W/D 值。
2.5 支气管肺泡灌洗液(bronchoalveolar lavage fluid,BALF)的获取及其中TNF-α、IL-β、IL-6 和IL-10 浓度的检测 大鼠处死后,立即剖胸,暴露心肺,分离左右主支气管,结扎右支气管。自制导管插入主支气管。然后,将2 mL 冷磷酸盐缓冲生理盐水注入左肺,并来回抽取3 次。收取支气管肺泡灌洗液,采用ELISA 法测定TNF-α、IL-β、IL-6 和IL-10 浓度,严格按照说明书操作。
2.6 肺组织中MDA 浓度及MPO 活性的检测 取肺组织100 mg解冻,制备肺组织匀浆用于测定MDA 浓度和MPO活性,严格按说明书操作。
2.7 Western blot 检测肺组织α1Na+/K+-ATPase、β1Na+/K+-ATPase 和p-ERK1/2 的蛋白水平 分别取适量的肺组织,加入蛋白裂解液冰上匀浆,离心收取上清液,提取总蛋白并定量。应用10% SDS-PAGE 分离后,电转移至PVDF 膜上。脱脂奶粉溶液封闭1.5 h;洗 膜 后 加 入 抗α1Na+/K+-ATPase、β1Na+/K+-ATPase、p-ERK1/2 和β-actin 抗体,4℃孵育过夜;洗膜后加入Ⅱ抗,室温下孵育2 h,洗膜后加入化学发光增强剂,自显影。采用图像分析处理系统对蛋白条带扫描分析,测得的目的蛋白吸光度值与β-actin吸光度值的比值表示各蛋白的相对表达量。
3 统计学处理
计量资料以均数±标准差(mean±SD)表示。采用SPSS 13.0 统计软件行单因素方差分析(one-way AONVA)和SNK-q检验,ALI 评分采用Kruskal-Wallis检验。以P<0.05为差异有统计学意义。
结果
1 肺组织病理学检查
肺组织HE 染色显示,NS 对照组肺组织结构基本正常;LPS 组肺组织间隔增厚,肺血管充血,有大量炎症细胞浸润;Dex 治疗组肺组织病理变化减轻,见图1A。肺损伤分数比较显示,与NS 组相比,LPS组肺损伤分数升高(P<0.01);Dex 治疗组肺损伤分数低于LPS 组(P<0.01),而α2AR 抑制剂育亨宾部分逆转了Dex 的作用,肺损伤分数升高(P<0.01),见图1B。
2 各组大鼠PaO2及PaO2/FiO2的变化
与NS对照组相比,LPS组PaO2及PaO2/FiO2降低(P<0.01);Dex 治疗组PaO2及PaO2/FiO2高于LPS 组(P<0.01),而α2AR 抑制剂育亨宾部分逆转了Dex 的作用(P<0.05),见图2。
3 各组大鼠肺指数和W/D的变化
与NS 对照组相比,LPS 组肺指数和W/D 增加(P<0.01);Dex 治疗组肺指数和W/D 低于LPS 组(P<0.01),而α2AR 抑制剂育亨宾部分逆转了Dex 的作用(P<0.01),见图3。
4 各组大鼠支气管肺泡灌洗液中TNF-α、IL-β、IL-6和IL-10浓度的变化
与NS 对照组相比,LPS 组TNF-α、IL-β 和IL-6 及IL-10 浓度升高(P<0.01);与LPS 组比较,Dex 治疗组TNF-α、IL-β 和IL-6 浓度降低,IL-10 浓度进一步升高(P<0.01),而α2AR 抑制剂育亨宾部分逆转了Dex 的作用(P<0.01),见图4。
5 肺组织MDA浓度及MPO活性的变化
与NS 对照组相比,LPS 组MDA 的浓度及MPO的活性升高(P<0.01);与LPS 组比较,Dex 治疗组MDA 的浓度及MPO 的活性降低(P<0.01),而α2AR抑制剂育亨宾部分逆转了Dex 的作用(P<0.05),见图5。
6 各组大鼠α1 Na+/K+-ATPase和β1 Na+/K+-ATPase蛋白水平的变化
与NS 对照组相比,LPS 组α1Na+/K+-ATPase 和β1Na+/K+-ATPase 的蛋白水平降低(P<0.01);与LPS 组比较,Dex 治疗组的α1Na+/K+-ATPase、β1Na+/K+-ATPase 蛋白水平升高(P<0.01),而α2AR 抑制剂育亨宾部分逆转了Dex的作用(P<0.01)),见图6。
7 各组大鼠p-ERK1/2蛋白水平的变化
与NS 对照组相比,LPS 组p-ERK1/2 的蛋白水平降低(P<0.01);与LPS组比较,Dex治疗组p-ERK1/2的蛋白水平升高(P<0.01),而α2AR 抑制剂育亨宾部分逆转了Dex的作用(P<0.01),见图7。
讨论
LPS是革兰氏阴性杆菌细胞壁的主要成分,常用来诱导ALI 模型[13]。我们的研究结果清楚地表明,LPS 导致ALI 大鼠肺指数和W/D 比值明显升高,而Dex 降低了肺指数和W/D 比值,说明Dex 减轻了LPS诱导的ALI 大鼠肺水肿。此外,肺组织病理学的检查发现,在ALI 模型组,肺泡间隔增厚,肺泡充血,炎症细胞浸润,而Dex治疗则明显改善了LPS导致的肺组织病理学改变。与这些研究结果一致,LPS 导致PaO2和PaO2/FiO2显著降低,给予Dex 治疗后,PaO2和PaO2/FiO2上升,表明肺水肿的消除可有效改善氧合功能,从而有利于ALI患者的转归。

Figure 1. Pathological changes and injury scores of lung tissues(HE staining,×200). Mean±SD. n=6. **P<0.01 vs NS group;##P<0.01 vs LPS group;&&P<0.01 vs LPS+Dex group图1 HE染色观察右美托咪定对各组大鼠肺组织病理学改变及肺损伤分数的影响

Figure 2. Effects of Dex on PaO2 and PaO2/FiO2 in rats with LPS-induced ALI. Mean±SD. n=6. **P<0.01 vs NS group;##P<0.01 vs LPS group;&P<0.05 vs LPS+Dex group.图2 右美托咪定对各组大鼠PaO2及PaO2/FiO2的影响
肺水肿的消除不仅依赖于肺泡内液生成的减少,更依赖于肺泡内液体的清除。研究发现,Na+/K+-ATPase在肺泡上皮细胞膜上表达增加或其活性增强能够促进肺泡液体清除[14]。相反,Na+/K+-ATPase 在肺泡上皮细胞膜上低表达或活性被抑制则导致肺泡内液体清除降低[15-17]。近年来的研究表明:不同致病因素导致的ALI 肺组织Na+/K+-ATPase 表达降低,肺泡内液体清除也降低[18-20],提示维持肺泡上皮细胞Na+/K+-ATPase 正常表达,有利于促进肺泡内液体清除及减轻肺水肿。在本研究中,我们观察到LPS 可导致肺组织α1Na+/K+-ATPase 和β1Na+/K+-ATPase 的表达降低,Dex 治疗明显上调α1Na+/K+-ATPase 和β1Na+/K+-ATPase 的表达。这些结果提示,Dex 减轻肺水肿的作用与促进Na+/K+-ATPase的表达有关。
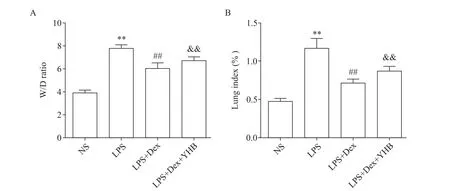
Figure 3. Effects of Dex on W/D ratio(A)and lung index(B)in the rats with LPS-induced ALI. Mean±SD. n=6. **P<0.01 vs NS group;##P<0.01 vs LPS group;&&P<0.01 vs LPS+Dex group.图3 右美托咪定对各组大鼠W/D和肺指数的影响

Figure 4. Effects of Dex on TNF-α(A),IL-β(B),IL-6(C)and IL-10(D)in BALF in rats with LPS-induced ALI. Mean±SD. n=6. **P<0.01 vs NS group;##P<0.01 vs LPS group;&&P<0.01 vs LPS+Dex group.图4 右美托咪定对各组大鼠肺泡灌洗液中TNF-α、IL-β、IL-6和IL-10浓度的影响

Figure 5. Effects of Dex on MPO activity(A)and MDA level(B)in the rats with LPS-induced ALI. Mean±SD. n=6. **P<0.01 vs NS group;##P<0.01 vs LPS group;&P<0.05,&&P<0.01 vs LPS+Dex group.图5 右美托咪定对各组大鼠肺组织MPO活性和MDA水平的影响
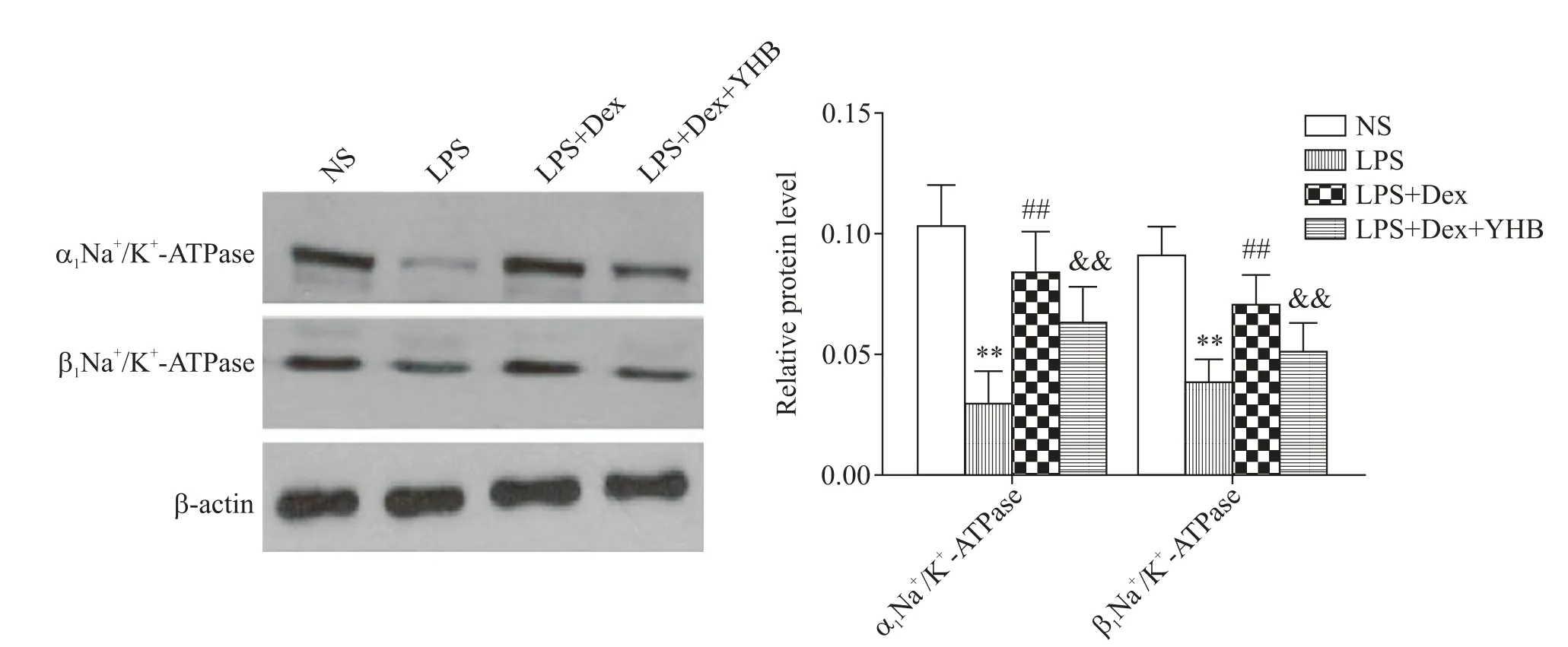
Figure 6. Effects of Dex on expression of Na+/K+-ATPase in the rats with LPS-induced ALI. Mean±SD. n=3. **P<0.01 vs NS group;##P<0.01 vs LPS group;&&P<0.01 vs LPS+Dex group.图6 Western blot观察右美托咪定对各组大鼠Na+/K+-ATPase表达的影响

Figure 7. Effects of Dex on protein level of p-ERK1/2 in rats with LPS-induced ALI. Mean±SD. n=3. **P<0.01 vs NS group;##P<0.01 vs LPS group;&&P<0.01 vs LPS+Dex group.图7 Western blot观察右美托咪定对各组大鼠p-ERK1/2蛋白水平的影响
LPS 能够激活中性粒细胞和肺泡巨噬细胞等炎症细胞,释放TNF-α、IL-1β 和IL-6 等大量炎性细胞因子,而IL-10 等抑制性炎症细胞因子分泌不足,最终导致全身瀑布样炎症反应,而肺部最先受到打击。以往,我们过多关注炎症反应对毛细血管内皮细胞损伤的影响,而对肺泡上皮细胞的影响重视不够。最近研究发现:TNF-α、IL-1β和IL-6等炎症细胞因子能够抑制肺泡上皮细胞Na+/K+-ATPase 的表达[21-23]。与这些研究结果一致,我们的研究显示,LPS 导致肺组织大量中性粒细胞浸润,且BALF中促炎症细胞因子TNF-α、IL-1β 和IL-6 明显增加,虽然抑制性炎症细胞因子IL-10 分泌增加,但不足以抵抗促炎反应,而Dex 减少了BALF 中TNF-α、IL-1β 和IL-6 的浓度,同时增加了IL-10 的浓度。以上研究结果提示,在LPS 诱导的ALI 模型中,Dex 上调Na+/K+-ATPase 表达可能与抑制炎症反应相关。
近年来,国内外对引起Na+/K+-ATPase 表达和活性变化的相关信号通路进行了相关研究。ERK1/2是丝裂原激活的蛋白激酶信号家族中的重要成员,调节细胞的增殖和分化,并与某些基因的转录与表达密切相关。以往的研究表明,ERK1/2 在调控Na+/K+-ATPase 中扮演重要的角色[24],研究发现:甲状腺激素通过激活ERK1/2 增加鼠肺泡上皮细胞Na+/K+-ATPase 的活性[25-26],多巴胺通过激活ERK1/2 提高肺泡上皮细胞Na+/K+-ATPase的活性[27]。在人骨骼肌细胞上,Na+/K+-ATPase 的活性也依赖于ERK1/2 的激活[28]。我们的研究发现,LPS 抑制p-ERK1/2 的水平,而Dex 治疗极大的增加了p-ERK1/2 的蛋白水平,以上这些研究结果提示在LPS诱导的ALI大鼠模型中,Dex 上调Na+/K+-ATPase 表达可能与ERK1/2 的激活有关。近年来的研究发现,Dex 可激活ERK1/2 减轻脑缺血再灌注损伤及心脏缺血再灌注损伤,而给予α2AR 抑制剂后会消除Dex 的保护作用[29-30],提示Dex可能通过α2AR 介导ERK1/2 的激活而发挥器官保护作用。我们的研究也得出了类似的结果,在Dex 和α2AR 抑制剂育亨宾同时干预后,Dex 单独干预时其抑制肺部炎症反应,上调Na+/K+-ATPase 表达及减轻肺水肿的作用被部分逆转。
综上所述,Dex 可通过上调Na+/K+-ATPase 的表达减轻LPS诱导的ALI相关肺水肿,其机制可能与大鼠α2AR介导的ERK1/2激活有关。

