五味子哮喘汤对哮喘小鼠SIRT1/Akt信号通路及肺功能的影响*
孙 毅, 任亚平, 孔 乔, 陈 辉△
(1滕州市中心人民医院药剂科,山东滕州277599;2北京中医药大学东直门医院中医科,北京100029)
支气管哮喘简称哮喘,是一种常见呼吸系统慢性炎症性疾病,患者主要表现为咳嗽、喘息和气促等症状,若不及时干预,可引起肺气肿等严重并发症,目前传统治疗药物仍不能有效控制重度哮喘患者症状,因此寻找治疗哮喘的新型药物至关重要[1]。近来研究显示,中医药在治疗哮喘中逐渐彰显出独特优势[2-4]。五味子哮喘汤(Schisandrae-asthma decoction,SAD)涉及五味子、麻黄(蜜炙)、干姜等十四味中药,为本院正常使用的中药饮片,产地地道,疗效确切,毒副作用小,价格低廉,使用安全。沉默信息调节因子2 相关酶1(silent information regulation 2 homolog-1,SIRT1)是一种烟碱胺腺嘌呤二核苷酸(nicotinamide adenine dinucleotide,NAD+)依赖的脱乙酰酶,广泛存在于动物细胞中,与细胞周期控制、炎症反应、氧化应激及细胞凋亡等密切相关;有研究显示,SIRT1 可作为一种抗炎因子,在哮喘炎症进展中发挥重要调节作用[5-6]。SIRT1 过表达可引起蛋白激酶B(protein kinase B,PKB/Akt)磷酸化水平升高,与细胞增殖、凋亡及氧化应激等有关[7]。因此,本项工作拟探讨五味子哮喘汤对哮喘小鼠肺功能及SIRT1/Akt 信号通路的影响,以期揭示其作用机制,进一步为临床应用提供实验基础。
材料和方法
1 实验动物
120 只6 周龄清洁级雌性BALB/c 小鼠,体质量18~22 g,由中国科学院上海药物研究所提供,生产许可证号为SCXK(沪)2018-0002。于本院实验动物中心饲养,室温(23±1)℃,空气湿度50%~60%,黑暗光照交替时间12 h,自由饮水、采食。本研究经过本院动物伦理委员会批准通过。
2 药物、试剂及仪器
五味子哮喘汤配方:五味子6 g,麻黄(蜜炙)12 g,干姜6 g,款冬花(蜜炙)12 g,紫菀(蜜炙)12 g,胆南星6 g,地龙10 g,金银花12 g,芦根12 g,竹茹10 g,射干10 g,茯苓10 g,西洋参6 g,甘草6 g。药液制备:将中药加水浸泡40 min,煎煮两次,第1 次煎沸后再煎30 min,过滤;第2 次煎沸后再煎20 min,过滤(亦可用自动煎药机设定时间一次煎出药液)。合并两次煎液浓缩至400 mL 即得。生理盐水配制浓度为1 kg/L,备用。地塞米松(dexamethasone,Dex;货号:50-02-2)购自上海一飞生物科技有限公司;Trizol(货号:R0016)购自上海碧云天公司;PrimeScript ™RT reagent Kit(Perfect Real Time)和TB Green®Premix Ex Taq™Ⅱ(Tli RNaseH Plus)均购自TaKaRa(货号:RR037A 和RR820A);兔源Ⅰ抗[抗SIRT1 抗体(货号:ab32441)、抗磷脂酰肌醇3-激酶(phosphatidylinositol 3-kinase,PI3K)抗体(货号:ab32089)、抗 磷 酸 化PI3K(phosphorylated PI3K,p-PI3K)抗体(货号:ab191606)、抗Akt 抗体(货号:ab32505)、抗磷酸化Akt(phosphorylated Akt,p-Akt)抗体(货号:ab38449)和抗GAPDH 抗体(货号:ab9485)]和Ⅱ抗羊抗兔IgG(货号:ab6721)均购自Abcam;WooⅠ型超声雾化吸入器购自上海塔望智能科技有限公司;Evolution 220 紫外分光光度计、ABI 7500 RT-qPCR 仪和FC 型酶标仪均购自Thermo。
3 方法
3.1 分组、模型制备及给药 小鼠适应性饲养1 周后随机分为对照(control)组、模型(model)组、阳性对照Dex 组、低剂量SAD(low-dose SAD)组、中剂量SAD(middle-dose SAD)组和高剂量SAD(high-dose SAD)组,每组20 只,其中10 只用于检测肺功能,另10 只取肺组织进行病理学观察、mRNA 及蛋白检测。参照文献[8]构建动物模型,除control 组外其余5 组于实验第1 和8 天皮下注射10 mg 卵清蛋白(ovalbumin,OVA)+200 mg 氢氧化铝[Al(OH)3]混合液,于第15天雾化吸入2%OVA 磷酸盐缓冲液进行过敏激发,每天1 次,每次30 min,持续1 周。造模成功标准:小鼠烦躁不安,弓背,呼吸加深、加快,严重者甚至伸颈、喘息状、大小便失禁等。对control 组予以等量生理盐水注射及雾化吸入。于第16 天给药处理:Dex 组灌胃Dex(10 mg/kg);参考文献[9]及预实验结果(中剂量为70 kg 成人每日服用药物剂量与小鼠表面积换算比值),确定low-dose SAD 组、middle-dose SAD 组和high-dose SAD 组分别予以8.5 g/kg(8.5 mL/kg)、17 g/kg(17 mL/kg)和34 g/kg(34 mL/kg)SAD 灌胃;control 组和model 组灌胃等量双蒸水,均每天1次,连续7 d。
3.2 肺功能仪检测小鼠肺功能变化 末次给药后24 h,以2%戊巴比妥纳0.2 mL 腹腔麻醉各组小鼠,每组取10 只进行肺功能检测,将小鼠气管切开,置入气管插管并固定,按要求连接肺功能仪,记录小鼠0.1 s 用力呼气容积(forced expiratory volume in 0.1 s,FEV0.1)及最高呼气流速(peak expiratory flow rate,PEFR)等指标。
3.3 HE 染色观察肺组织病理学变化 小鼠麻醉处死后,取左肺组织,用4%多聚甲醛固定48 h,常规脱水、石蜡包埋后以0.4 mm 切片,脱蜡、水化后进行HE染色,于显微镜下观察肺组织病理学变化。
3.4 RT-qPCR 检 测 肺 组 织SIRT1、PI3K 和Akt 的mRNA 表达水平 Trizol 法提取各组小鼠部分右肺组织总RNA,反转录得到cDNA,置于-20℃保存备用。采用RT-qPCR 扩增SIRT1、PI3K及Akt mRNA 片段。反应体系(20 μL):TB Green Premix Ex Taq Ⅱ(2×)10 μL,ROX Reference Dye II(50×)0.4 μL,cDNA(50 μmol/L)2 μL,上、下游引物(10 μmol/L)各0.8 μL,ddH2O 6.0 μL。反应条件为:95℃30 s;95℃5 s,61℃34 s,40 个循环。采用2-ΔΔCt法定量分析肺组织SIRT1、PI3K 及Akt 的mRNA 相对表达水平。所用引物序列见表1。

表1 RT-qPCR引物序列Table 1. The sequences of the primers for RT-qPCR
3.5 Western blot 检测肺组织SIRT1、PI3K、p-PI3K、Akt 和p-Akt 蛋白水平 采用Western blot 检测小鼠肺组织SIRT1、PI3K、p-PI3K、Akt 及p-Akt 蛋白水平。蛋白提取试剂盒提取各组小鼠肺组织总蛋白;BCA法测定蛋白质浓度;进行SDS-PAGE 分离,并转膜、封闭,分别添加SIRT1(1∶2 000)、PI3K(1∶1 000)、p-PI3K(1∶2 000)、Akt(1∶500)、p-Akt(1∶1 000)和GAPDH(1∶2 000)抗体,4℃孵育过夜,添加Ⅱ抗羊抗兔IgG(1∶5 000)室温避光孵育1 h,增强化学法显影,蛋白条带灰度值用ImageJ软件分析。
4 统计学处理
采用SPSS 19.0 软件进行统计学分析。所有数据采用平均数±标准差(mean±SD)表示。多组间比较采用单因素方差分析(one-way ANOVA),两两间比较采用SNK-q检验。以P<0.05 为差异有统计学意义。
结果
1 五味子哮喘汤对小鼠肺功能的影响
与control 组比较,model 组小鼠肺功能指标FEV0.1 和PEFR 水 平 均显 著 降 低(P<0.05);与model 组比较,Dex 组、low-dose SAD 组、middle-dose SAD 组和high-dose SAD 组小鼠肺功能指标FEV0.1和PEFR水平均显著增加(P<0.05),见图1。
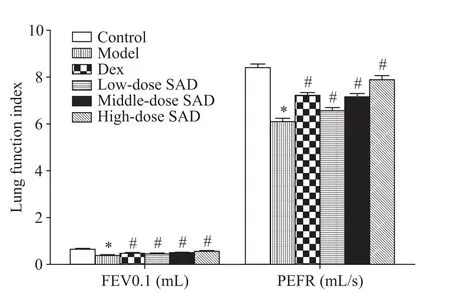
Figure 1. Effect of Schisandrae-asthma decoction (SAD) on lung function in mice. Mean±SD. n=10. *P<0.05 vs control group;#P<0.05 vs model group.图1 五味子哮喘汤对小鼠肺功能的影响
2 五味子哮喘汤对小鼠肺组织病变的影响
HE 染色结果显示,control组小鼠肺泡组织形态正常,无炎症细胞浸润;model 组小鼠肺壁增厚,肺组织周围可见大量炎症细胞浸润;Dex 组、low-dose SAD 组、middle-dose SAD 组和high-dose SAD 组小鼠肺组织病变呈不同程度减轻,见图2。

Figure 2. Effect of Schisandrae-asthma decoction (SAD) on lung lesions in mice(HE staining,scale bar=50 μm). A:control group;B:model group;C:Dex group;D:low-dose SAD group;E:middle-dose SAD group;F:high-dose SAD group.图2 五味子哮喘汤对小鼠肺组织病变的影响
3 五味子哮喘汤对小鼠肺组织SIRT1、PI3K 和Akt mRNA表达的影响
与control 组比较,model 组小鼠肺组织SIRT1 mRNA 表达水平显著降低(P<0.05),而PI3K 和Akt mRNA 表达水平显著升高(P<0.05);与model 组比较,Dex 组、low-dose SAD 组、middle-dose SAD 组和high-dose SAD 组小鼠肺组织SIRT1 mRNA 表达水平均显著升高(P<0.05),而PI3K 和Akt mRNA 表达水平均显著降低(P<0.05),见图3。

Figure 3. Effect of Schisandra-asthma decoction (SAD) on mRNA expression of SIRT1,PI3K and Akt in lung tissue of mice. Mean±SD. n=10. *P<0.05 vs control group;#P<0.05 vs model group.图3 五味子哮喘汤对小鼠肺组织SIRT1、PI3K 和Akt mRNA表达的影响
4 五味子哮喘汤对小鼠肺组织SIRT1、PI3K、p-PI3K、Akt和p-Akt蛋白水平的影响
与control 组比较,model 组小鼠肺组织SIRT1 蛋白表达水平显著降低(P<0.05),p-PI3K/PI3K 和p-Akt/Akt 蛋白水平显著升高(P<0.05);与model 组比较,Dex 组、low-dose SAD 组、middle-dose SAD 组和high-dose SAD 组小鼠肺组织SIRT1 蛋白表达水平均显著升高(P<0.05),p-PI3K/PI3K 和p-Akt/Akt 蛋白水平显著降低(P<0.05),见图4。
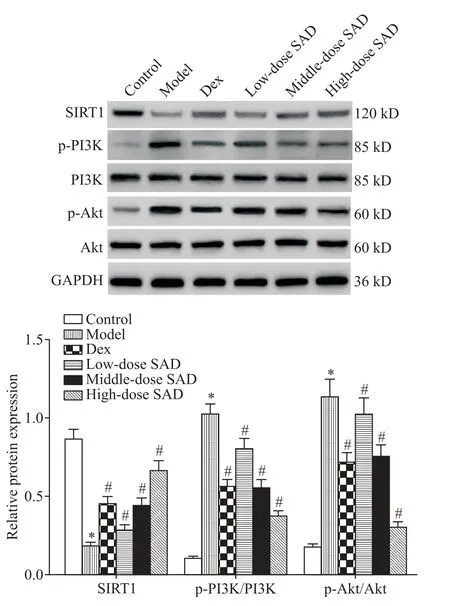
Figure 4. Effect of Schisandra-asthma decoction(SAD)on protein levels of SIRT1,PI3K,p-PI3K,Akt and p-Akt in lung tissue of mice. Mean±SD. n=10. *P<0.05 vs control group;#P<0.05 vs model group.图4 五味子哮喘汤对小鼠肺组织SIRT1、PI3K、p-PI3K、Akt及p-Akt蛋白表达的影响
讨论
本研究采用OVA 配合免疫佐剂Al(OH)3制备哮喘模型,结果显示,与control组比较,model组小鼠肺功能指标FEV0.1 和PEFR 均显著降低,肺组织结构破坏严重,炎症细胞浸润明显,与Mäkinen 等[10]和Song 等[11]的结果一致,提示哮喘模型小鼠制备成功。五味子哮喘汤由五味子、麻黄、干姜、款冬花、紫菀等十四味中药组成,其中主药五味子具有敛肺、滋肾、收汗、治肺虚咳喘、益气强阴之功效[12-13];麻黄可疏解肌表、发汗,还能化痰止咳、滋阴敛肺、运水祛湿,常用于伤风感冒、咳嗽气喘、风湿痹痛及阴疽、咳痰等病症[14];干姜则有温中散寒、回阳通脉、温肺化饮之功效;款冬花、紫菀和胆南星具有润肺下气、清热化痰止咳之功效[15]。有研究报道,五味子及其衍生物对哮喘具有较好的治疗效果,但其具体作用机制尚不完全明了[16]。本研究结果显示,哮喘小鼠经五味子哮喘汤治疗后,肺功能及肺组织病理病变改善显著,且高剂量治疗效果优于阳性药物地塞米松,提示五味子哮喘汤可改善哮喘小鼠肺功能,对哮喘具有一定治疗作用,其作用机制进行进一步研究。
哮喘以气道重塑及慢性炎症为主要病理特征,其中气道平滑肌过度增殖及凋亡不足是引起气管重塑、难治性哮喘的重要原因[17]。SIRT1可通过调控核因子κB(nuclear factor-κB,NF-κB)、p38 丝裂原活化蛋白激酶(mitogen-activated protein kinase,MAPK)及PI3K/Akt 通路,抑制氧化应激反应、炎症反应及细胞增殖凋亡过程,在哮喘中亦发挥重要作用[18-21]。刘楠等[22]的研究表明,SIRT1可通过Akt通路调节IL-6水平,影响哮喘患者肺功能。Akt磷酸化是PI3K/Akt通路发挥抗凋亡作用的关键因子,在肺部生理和病理过程中发挥重要作用。本研究结果显示,与模型组比较,五味子哮喘汤增加SIRT1 mRNA 及蛋白表达,降 低PI3K 和Akt mRNA 及p-PI3K/PI3K 和p-Akt/Akt蛋白水平,与孟芝等[23]的研究结果一致,提示五味子哮喘汤可能通过SIRT1/Akt 信号通路,提高FEV0.1和PEFR水平,从而改善肺功能。
综上所述,五味子哮喘汤可改善哮喘小鼠肺功能,减轻哮喘症状,可能与调控SIRT1/Akt 信号通路有关。但其具体机制及下游调控炎症信号通路还是其他信号通路,有待进一步深入探究。

