小动物精准放疗系统在小鼠肿瘤放疗模型中的应用
吴安庆,聂 晶
(苏州大学 放射医学与防护学院,江苏 苏州 215123)
恶性肿瘤是威胁人类健康的高死亡率疾病之一。人类对于恶性肿瘤还没有某种特别有效的治疗方法,常用的治疗手段为放射治疗、手术治疗和化学治疗,约有50%~70%的肿瘤患者需要不同程度地接受放射治疗[1]。随着医疗影像技术、计算机图像处理技术迅速发展,放射治疗设备不断升级,放射治疗进入了“精准放疗”的时代,定位精度越来越高,剂量聚集性越来越好,能够将放射线全部集中在肿瘤部位进行大剂量照射,并且避免肿瘤周围正常组织接受照射,有效地减少放疗的副作用[2]。因此,针对临床前基础研究的小动物精准放疗设备也应运而生,主要用于放射生物学效应机理、辐射防护药物、多模态治疗等研究的动物水平实验。
1 小动物精准放疗系统简介
小动物精准放疗系统是一种图像引导的可视化放射治疗系统(small animal image-guided radiation therapy system)是为了解决临床放疗的疑难点和找到新的放疗方法或途径而生产的一款用于临床前动物实验的放疗仪器,其特点是在实施放疗前,先对小动物进行精确的CT 三维成像,然后应用专门的软件,运用蒙特卡洛算法制定放疗计划,最后按照制定好的放疗计划引导仪器对小动物实施精确的放疗[3]。本文以美国Precision X-ray (PXi)公司生产的X-RAD SmART 小动物精准放疗系统为例,阐述小动物精准放疗系统在小鼠肿瘤放疗模型中的应用。
X-RAD SmART 小动物精准放射治疗系统基本结构包括自屏蔽主机、X 射线发生单元、动物平台控制单元、成像单元、辐照单元、软件控制单元,如图1所示。
1.1 X 射线发生单元
(1)X 射线球管,最大管电压225 kV,最大功率3 kW,双焦点,焦点大小0.4 mm/3.0 mm(640 W/3 000 W),其中小焦点用于高分辨率成像,大焦点用于精确辐照;靶材料钨;内过滤0.8 mm Be;冷却介质纯净水。
(2)高压发生器,最大输出电压225 kV,最小调节电压0.1 kV;最大输出电流45 mA,最小调节单位0.01 mA;最大输出功率4.5 kW。
1.2 动物平台控制单元
(1)控制模式:成像或辐照时,动物床固定不动,X 射线球管和探测器以动物床为轴做0°~360°圆周旋转;旋转速度可调节范围0.01~3 r/min;旋转定位精度6 arc/min。
(2)动物平台可三轴向同时调节,X 轴和Y 轴可调节距离(距等中心位置)±12.5 cm;Z 轴可调节距离(距等中心位置)±10.5 cm;调节速率36 mm/s;定位精度≤35 μm;定位可重复性≤±20 μm;动物平台可承受的动物的最大重量≤5.5 kg。
1.3 成像单元
(1)CT 成像,成像方式为标准的锥束CT 成像;等中心体积分辨率100 μm;等中心成像体积10 cm×10 cm×10 cm;成像和重建时间最快20 s;几何线性0.5 mm(不小于100 mm 距离);成像时产生的最小辐射剂量率≤1 cGy/min。
(2)平板探测器,类型CsI 非晶硅探测器;实际像素1024×1024;像素单元大小200 μm;成像面积20 cm×20 cm;成像帧率15 fps;定位精度,标准模式,±0.25 mm;高分辨率模式±0.1 mm。
1.4 辐照单元
辐照剂量率范围 1~400 cGy/min;X 射线过滤0.2 mm Al(用于成像),0.3 mm Cu(用于治疗);限束器(固定照射野)规格1~5 mm,圆孔或矩形孔;各向等中心距30 cm SSD;三束激光定位系统,方便对放射治疗区域的定位和标识;实时视频监控系统,方便对放射治疗全过程的监控。
1.5 软件单元
放射治疗计划系统(TPS),CBCT 扫描工具和重建工具,3D CT 图像的快速扫描和重建,最快速度20 s,最高分辨率100 μm,极大地缩短了整个放射治疗的时间;数据库管理工具,对获取的每一幅图像都建立独立的识别码,方便图像的编辑、灰度匹配、分析、传输和分享;DICOM 输入输出工具,对不同平台(MRI,PET-CT,SPECT-CT 等)的图像数据可以分享和融合,进一步增强了放射治疗计划的精确性和可评估重复性;剂量工具,采用最先进的蒙特卡洛算法(Monte Carlo algorithms)进行剂量的计算、校准和评估。

图1 X -RAD SmART 小动物精准放疗系统
2 X -RAD SmART 小动物精准放疗系统在小鼠肿瘤放疗模型中的应用
X-RAD SmART 小动物精准放疗系统能够在小动物进行治疗前、治疗中利用CT 扫描单元对肿瘤及正常器官进行实时的监控,并能根据器官位置的变化调整治疗条件使照射野紧紧“追随”靶区,使之能做到真正意义上的精确治疗。优点是通过三维的CT 成像,可精确地确定肿瘤在体内的空间位置、形状和大小,据此设计精准的放疗方案使得X 射线聚焦于肿瘤位置,并可以进行多角度的照射[4]。在小鼠肿瘤放疗实验中,一般常用的肿瘤模型是小鼠模型和人肿瘤裸鼠移植瘤模型。其中用得最多的是皮下移植、腹腔注射移植、尾静脉注射以及原位模型,本文以小鼠尾静脉注射肿瘤细胞建立肺部移植瘤模型为例[5-6]。
2.1 实验材料
SPF 级NOD/SCID 小鼠,雄性,6~8 周龄,体重18~22 g,购自上海斯莱克实验动物有限公司;人源非小细胞肺癌A549 细胞株由苏州大学哥伦比亚大学卫星实验室提供;携带有荧光素酶报告基因和嘌呤霉素抗性基因的慢病毒购于生工生物工程股份有限公司;D-萤光素钾盐购于碧云天生物技术有限公司;嘌呤霉素购于美国GIBCO 公司;Ki67 抗体购于碧云天生物技术有限公司。
2.2 小鼠肿瘤模型建立
首先将携带有荧光素酶报告基因和嘌呤霉素抗性基因的慢病毒载体转染非小细胞肺癌细胞系A549,然后使用含有嘌呤霉素的培养基筛选出能够稳定表达荧光素酶的A549 细胞株。将生长旺盛的稳定表达细胞株,消化离心清除培养基,重悬于生理盐水中,尾静脉注射进小鼠体内,每只小鼠注射200 μL 生理盐水,包含2×106个细胞,放回SPF 动物房,继续养殖20天后,观察小鼠肺部成瘤情况,并准备放射治疗。
2.3 小鼠肿瘤模型的鉴定
小鼠注射上述能够稳定表达荧光素酶的A549 细胞株20 d 后,将荧光素酶底物D-荧光素钾盐溶于生理盐水中,配制成15 mg/mL 的D-萤光素钾盐溶液,按照10 μL/g 的体重浓度,通过腹腔注射入小鼠体内,5 min 后使用小动物成像仪观察小鼠体内荧光分布,如图2 所示,荧光主要富集在小鼠的肺部,提示肿瘤细胞进入小鼠血液循环后,大部分迁移至肺部成瘤。然后处死部分荷瘤小鼠,取出肺部,可以看到肺部表面突起了大小不一的肿瘤组织(见图3),并制作石蜡病理切片,进行HE 染色,如图4(a)所示,肺部弥散浸润了大量的肿瘤灶,肿瘤区域与周围正常肺癌细胞结构明显不同。进一步通过免疫组化实验,对细胞增殖相关抗原Ki67 进行染色,如图4(b)所示,肿瘤部位着色明显比正常组织深,显示 Ki67 高表达。以上结果证明本实验用的小鼠肿瘤模型建立成功,可以用于下一步放射治疗。

图2 小鼠肿瘤模型的活体成像
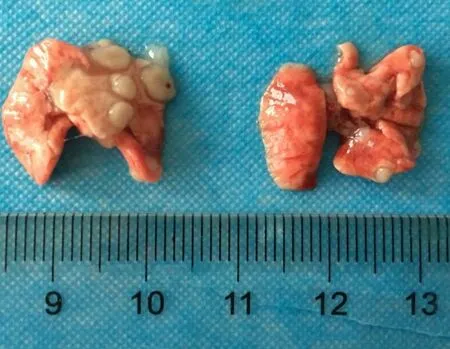
图3 小鼠肺部肿瘤
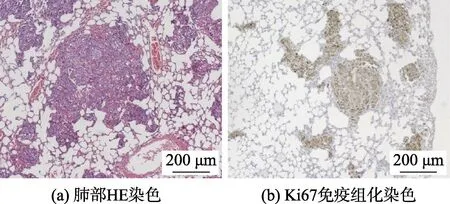
图4 小鼠肿瘤模型染色结果
2.4 放射治疗
将已经成瘤的小鼠随机分成两组,每组10 只,一组为不照射对照组,另一组为放射治疗组。放疗条件为每隔6 d 照射一次,剂量率为2 Gy/min,一次照射4 Gy,共照射3 次,累积剂量12 Gy,观察小鼠从第一次放疗起,30 d 内的生存率。照射方法:腹腔注射水合氯醛将小鼠麻醉,然后将小鼠放置在 X-RAD SmART 放射治疗系统的小动物床上,通过CT 控制软件,对小鼠进行CT 成像,然后在所成三维图像上画出照射靶区;再通过放疗控制软件,设置照射剂量,计算照射时间,并开始照射(见图5)。
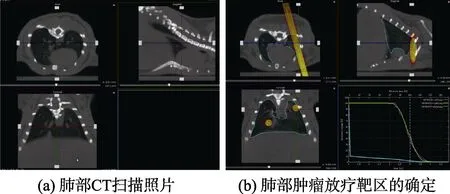
图5 小鼠肿瘤模型的肺部CT 扫描照片和肺部肿瘤放疗靶区的确定

图6 放射治疗组与未治疗对照组30 d 内的生存率比较(“↑”表示照射X 射线)
2.5 实验结果分析
连续3 次放疗结束后,统计小鼠放疗后30 d 的生存情况,如图6 所示,未进行放射治疗的小鼠,因为肺部肿瘤不断增殖恶化,第30 d 小鼠的存活率仅为20%,而给予放射治疗的小鼠,存活率为80%,说明放射治疗能够显著抑制肿瘤的生长,延长荷瘤小鼠的生存期。
3 小动物精准放疗系统的其他应用
X-RAD SmART 小动物精准放疗系统是专为临床前应用和研究而设计的精准放射治疗系统非常类似于临床放疗系统,即生物样本保持静止,检测器围绕样本360°旋转。这样就能够精确快速执行在复杂3D 图像引导下的精确治疗,为肿瘤放射治疗、放射生物学研究提供了高效率的临床前研究平台,可以加速临床转化进程。目前,X-RAD SmART 广泛用于临床前的基础和转化辐射生物学研究、肿瘤放射治疗研究等很多领域,包括:放射治疗的临床前验证、评估辐照风险、放射生物学效应研究、DNA 损伤应答研究、旁观者效应研究、辐射增敏剂研发、评估正常组织并发症概率、脑和神经及其他组织结构和功能的研究、药物有效性的研究[7-8]。
4 结语
放射治疗在癌症治疗过程中扮演着非常重要的角色,无论是早期还是晚期的病灶。随着医学技术的发展,新的放射治疗方法也不断地更新,目前临床治疗癌症的放射疗法有立体消融照射疗法(SABR)也称作立体全身照射疗法(SBRT)、强度调节照射疗法(IMRT)、三维适形放疗(3D-CRT)、网状照射方法(GRID)等[9-13]。但是单独使用放射治疗很难有效控制癌症发展,甚至联合最好的化疗药物治疗效果仍不理想。近几年,大量研究者报道了免疫疗法与传统的放射疗法相结合用于治疗肿瘤具有良好的效果[14]。而精准放疗联合其他癌症治疗方法的前期基础研究,需要做大量动物实验验证,本文以小鼠肺癌放疗模型为例,阐述了小动物精准放疗系统在动物实验中应用,为研究放射治疗与其他方法治疗癌症的协同效应提供实验技术方案。

