高效液相色谱法同时测定食品中10 种人工合成色素含量的研究
郭占魁
(山东新佳祥检测技术有限公司,山东 潍坊,261000)
根据功能不同,食品添加剂可以分为多种类别,如防腐剂、着色剂、增稠剂等。许多食品生产企业为了引起人们对食品味道的不同联想[1],使用色素将生产的食品进行着色。色素,根据其来源不同,可以分为天然色素和人工合成色素。与天然色素相比,人工合成色素因其成本低廉、着色力强等特点,现已被广泛应用于食品生产中。但是人工合成色素却不能为人体生长提供营养物质,违规使用甚至可能会危害人体健康[2-7]。《食品安全国家标准食品添加剂使用标准》(GB 2760-2014)对人工合成色素的使用范围及最大允许添加量[8]进行了明确的规定。而目前仍有不法商贩超限量及非法使用人工合成色素,因此,建立一种能快速、准确、灵敏检测人工合成色素的测定方法具有十分重要的意义。
食品安全国家标准食品中合成着色剂的测定》(GB 5009.35-2016)中规定了饮料、配制酒、硬糖、蜜饯、淀粉软糖、巧克力豆及着色糖衣制品中的柠檬黄、新红、苋菜红、胭脂红、日落黄、亮蓝、赤藓红的测定[9],并未涉及到靛蓝、诱惑红和酸性红的测定,中华人民共和国出入境检验检疫行业标准SN/T 1743-2006 中只规定了糖果、饮料中诱惑红、酸性红、亮蓝、日落黄的检测[10],GB/T 21916-2008 中只规定了水果罐头中柠檬黄、苋菜红、靛蓝、胭脂红、日落黄、诱惑红、亮蓝、赤藓红等8 种人工合成色素的高效液相色谱测定方法[11]。虽然文献[12-18]报道了几种合成色素的检测方法,但很少有同时测定食品中柠檬黄、新红、苋菜红、胭脂红、日落黄、亮蓝、赤藓红、诱惑红、酸性红等10 种色素的相关报道。本文研究确立了一种采用高效液相色谱法进行定性定量分析,同时测定食品中10 种人工合成色素的方法,该方法可适用于多种食品(熟肉制品、速冻食品、粉丝粉条等),具有检出限低、方法灵敏度高、分离效率好、回收率高等优点。
1 材料与方法
1.1 仪器
LC-2030C 3D 高效液相色谱仪(日本岛津,配二极管阵列检测器),RV10C-S096 旋转蒸发仪(德国IKA),3K15 冷冻离心机(SiGmA),BSM-520.3 电子天平(上海卓精电子科技有限公司),MS205DU 电子天平(梅特勒- 托利多仪器(上海)有限公司),GT-2120QTS 智能超声波清洗机(广东固特超声股份有限公司),ProElut PWA-2 固相萃取小柱(150 mg/6 mL)(迪马科技)
1.2 试剂
95%乙醇(AR,烟台远东精细化工有限公司)、乙腈(HPLC,美国天地TEDIA)、氨水(GR,国药集团)、甲酸(HPLC,天津大茂化学试剂有限公司)、甲醇(HPLC,飞世尔Fisher)、乙酸铵(HPLC,天津市科密欧化学试剂有限公司)、色素提取液A:140 mL 乙醇乙腈混合液(V:V=2:1),加入60 mL 水和2 mL 氨水混合制成。实验用水均为娃哈哈水(潍坊娃哈哈饮料有限公司)。
1.3 标准品
柠檬黄(92.5%,德国DrEhrenstorfer GmbH)、新红(89.0%,德国DrEhrenstorfer GmbH)、苋菜红(92.8%,德国DrEhrenstorfer GmbH)、靛蓝(90.0%,曼哈格)、胭脂红(89.8%,德国DrEhrenstorfer GmbH)、日落黄(90.5%,德国DrEhrenstorfer GmbH)、诱惑红(97.9%,曼哈格)、酸性红(95.4%,德国DrEhrenstorfer GmbH)、亮蓝(91.6%,德国DrEhrenstorfer GmbH)、赤藓红(86.0%,德国DrEhrenstorfer GmbH)
1.3.1 标准储备液(1 000 mg/L)配制
使用ME205DU 电子天平,准确称取各色素标准品于25 mL 容量瓶中,用少量水溶解,然后加水至刻度,混匀,得到各个色素的标准储备液,浓度均为1 000 mg/L,将配制好的储备液在4 ℃下保存备用。
1.3.2 标准工作液配制
分别移取1 mL 各色素储备液于25 mL 棕色安瓿瓶中,混匀后,各色素浓度为100 mg/L。临用时根据需要,准确移取相应体积的标准混合溶液,用水稀释配制成0.5 mg/L、1 mg/L、5 mg/L、10 mg/L、30 mg/L、70 mg/L、100 mg/L 系列标准工作溶液。
1.4 样品前处理过程
1.4.1 样品中色素的提取
糕点、熟肉等固体样品:称取1.0 g 已粉碎均匀的样品于50 mL 离心管中,加入30 mL 色素提取液A,手动震摇2 min 使之与样品充分混合,然后放入预先升温至50 ℃的超声波清洗机中,超声处理30 min(在此期间每隔10 min 手动震摇离心管数次),然后6 000 rpm/min 下离心4 min。将离心得到的上清液转入50 mL 鸡心瓶中,在旋转蒸发仪上旋蒸至上清液约15 mL,再加入3 mL 甲酸混匀,待净化。
1.4.2 净化
依次用5 mL 甲醇、5 mL 10%甲酸水溶液活化ProElut PWA-2 固相萃取小柱;加入待净化液,弃去流出液;加入5 mL 甲醇,弃去流出液;加入5 mL 15%氨水甲醇溶液,收集流出液;将收集到的流出液于50 ℃下N2吹至尽干,然后用水定容至1 mL,供上机检测。整个需要过程控制液体流下速度为1 滴/s。
1.4.3 仪器条件
色谱柱:Inspire C18(250 mm×4.6 mm,5 μm);流动相:乙腈(B)+0.02 mol/L 乙酸铵(A);流速:1.0 mL/min;柱温:40 ℃;进样量:10 μL;检测波长:254 nm,梯度洗脱程序见表1。
2 结果与讨论
2.1 分析方法的选择
目前,针对人工合成色素的检测方法已经有较多报道[19-24],而大部分方法采用高效液相色谱串联质谱仪,因所需仪器设备检测成本较高,并不适合日常检测工作。本研究采用高效液相色谱仪检测食品中10 种人工合成色素,为人工合成色素的日常检测提供了便捷。
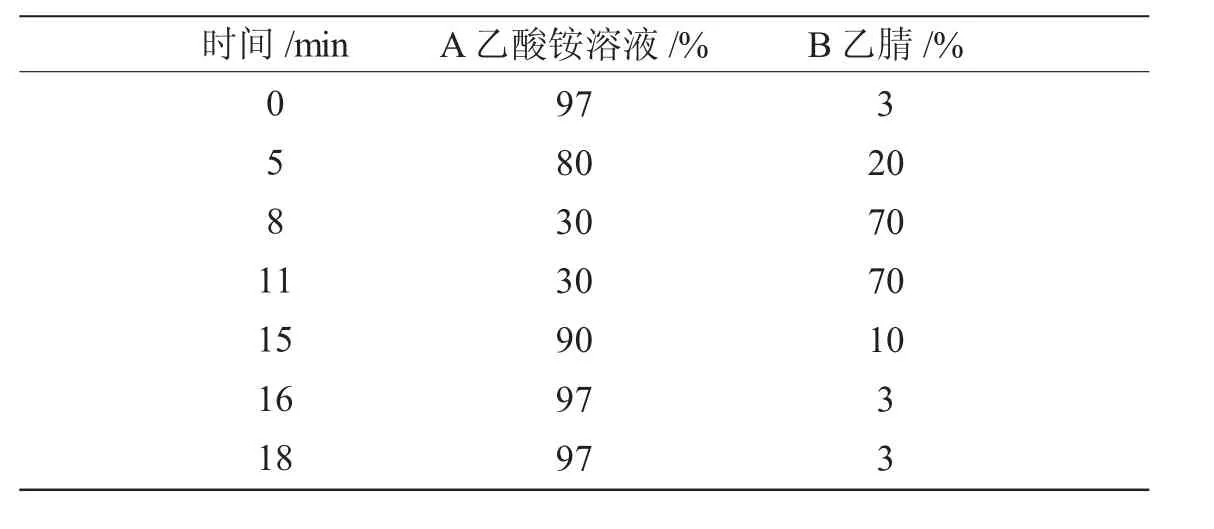
表1 梯度洗脱程序
2.2 流动相选择
GB 5009.35-2016 中采用的流动相为0.02 mol/L 的乙酸铵和甲醇作为流动相,为了实现10 种人工合成色素的有效分离,参考相关文献[19],本研究决定采用乙腈和0.02 mol/L 的乙酸铵作为流动相进行梯度洗脱。仍然采用254 nm 波长进行检测,10 种人工合成色素的标准色谱图(浓度为10 mg/L)如图1所示,各种色素的保留时间和分离度如表2 所示。由图可知,10 种人工合成色素的分离度均大于1.5,说明该方法所选用的流动相和梯度洗脱程序能够实现食品中10 种人工合成色素的有效分离。
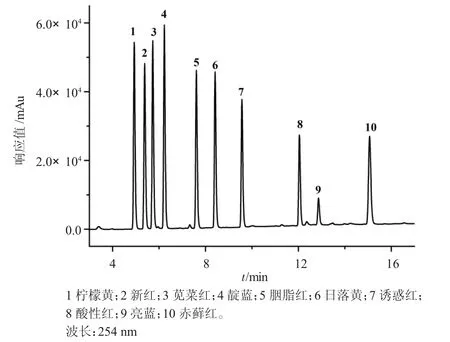
图1 10 种人工合成色素标准色谱图
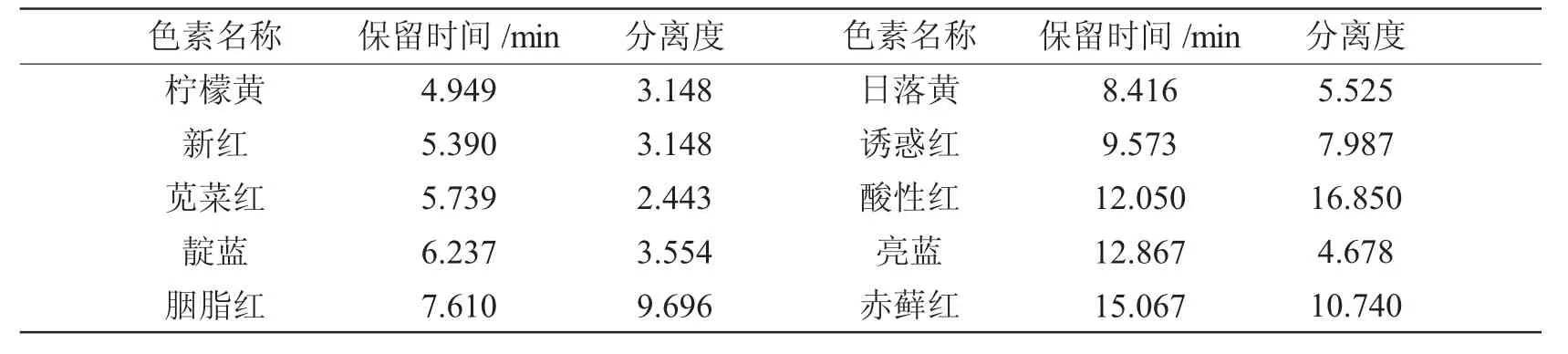
表2 10 种人工合成色素的分离度
2.3 提取方法的选择
GB 5009.35-2016 中采用的提取液为水,需将样品用水反复洗脱至无色,而由于样品基质复杂,有些样品中的色素并不能完全被水洗掉,于是夏宗艳等人[25]比较了水、乙醇- 氨水混合溶液(90:10,V/V)和丙酮- 水混合溶液(90:10,V/V)等3 种不同提取液对色素的提取效果,最后采用丙酮- 水(90:10,V/V)作为色素提取液,但是该提取液中使用了丙酮,丙酮为易制毒,且较容易挥发。本研究参考相关文献[26],采用一定比例的乙醇乙腈再与水和氨水混合制备得到的混合液作为色素提取液,经添加回收实验结果表明,该提取液具有良好的提取效果。
2.4 线性范围和检出限
分别配制浓度为0.5 mg/L、1 mg/L、5 mg/L、10 mg/L、30 mg/L、70 mg/L、100 mg/L 的10 种色素混合标准溶液,按照本方法的色谱条件,对不同浓度的标准系列混合溶液进行分析,以不同色素的质量浓度X为横坐标(mg/L),以峰面积Y 为纵坐标进行线性拟合,得到10 种色素的标准工作曲线和相关系数。实验结果表明,各种色素均呈现良好的线性关系,以3 倍信噪比确定检出限。方法的线性范围、线性相关系数及检出限见表3。

表3 方法的线性范围、相关系数及检出限
由表3 可以看出,该方法的线性相关系数均大于0.999 99,检出限在0.05~0.17 mg/kg 之间,说明该方法具有很好的线性范围和较低的检出限,能够实现食品中多种人工合成色素的灵敏检测。
2.5 方法可行性
为了验证方法的可行性,本研究选用基质比较复杂的粉丝、熟肉、水饺三种样品进行添加回收实验,添加水平为10 mg/kg,回收率结果详见表4。
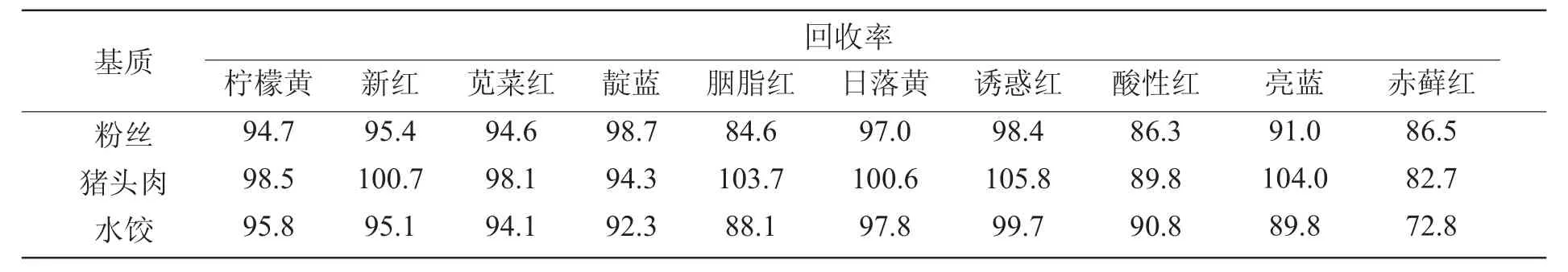
表4 不同基质加标回收率实验结果%
从表中可以看出,在3 种不同样品基质中,各种色素的添加回收率在72.8%~105.8%,说明该方法具有较好的回收率,能满足食品中人工合成色素的分析检测,说明本研究所确定的方法具有一定的可行性。
3 结论
本研究采用高效液相色谱法建立了一种同时检测食品中10 种人工合成色素的方法,并采用ProElut PWA-2 固相萃取小柱对样品进行净化,具有操作简单快速、测定结果准确等优点。所采用的色谱分离条件能有效地将10 种人工合成色素进行分离,并能在18 min 内完成对样品的分析检测。该方法具有样品处理简单、灵敏度高、检测结果准确、分析时间快等优点,可为我国食品检测行业提供参考和技术支持。

