冬虫夏草提取液对辐照诱导小鼠睾丸组织细胞凋亡的影响
魏闪闪,彭伟彪,汪家春,冯旭,苏笠,张阵阵,储智勇
随着科学技术的进步和社会的发展,电离辐射广泛应用于农业、工业和医疗[1]。然而,电离事故与放射医疗不可避免地会对正常组织细胞造成不良损伤,引起急性辐照综合征。在电离辐照过程中,正常细胞及组织均会受到一定程度的损伤,进而导致DNA双链的解开、凋亡等信号通路蛋白的表达,并进一步促进活性氧、活性氮、线粒体细胞色素C、促炎因子的释放,进而造成细胞的凋亡[1-3]。
由于无细胞再生系统和抗氧化防御的活性,睾丸组织被认为是最具辐射敏感性的器官之一,辐射对生殖能力的损伤较为突出[3]。Mohsen Marzban及Sivakumar等[4-5]研究证实,电离辐射影响着精子的形成、睾丸的形态及功能,引起了睾丸细胞生长激素损伤和改变,进而致使男性不育或亲代的畸形。为了减少辐射引起的睾丸损伤,人们已进行了大量的研究工作来探索可能有效的辐射保护剂。迄今为止,食品药品监督管理局(FDA)唯一批准的放射保护剂是氨磷汀,其在放射治疗期间显示出严重的组织毒性,临床上尚未出现有效治疗睾丸辐射损伤的药物[6]。
冬虫夏草是冬虫夏草菌和蝙蝠蛾科幼虫的复合体,主要产于青海、西藏、四川、云南、甘肃等地,具有无毒副作用、安全可靠等重要的药性特征[7]。古代《本草纲目拾遗》、《中药大辞典》中均记载冬虫夏草有补精益髓、治百虚百损等功效[7]。现代药理学研究结果表明,冬虫夏草可用于治疗慢性肝病与肾病、癌症、肥胖、高血压、糖尿病、免疫力低下等多种疾病[8-10]。冬虫夏草是一种极具潜力的中药,然而其功效研究依然处于初步阶段。本研究分析冬虫夏草提取液(CSE)对60Coγ射线辐照小鼠睾丸组织中自由基氧化、凋亡的保护功能,以期为CSE的临床应用提供理论依据。
1 材料与方法
1.1 材料
1.1.1 实验药品 野生冬虫夏草产自青海玉树,于雷允上药业集团有限公司购买,由海军军医大学药学院黄宝康教授鉴定为真品。冬虫夏草提取液(CSE)由海军医学研究所制剂室提供(批号:20161201),采用水提法制备:取500 g产于青海的野生冬虫夏草原料,分别加入2.5、1.5、1 L的蒸馏水,100 ℃各提取1 h,过滤得滤液,定容至每毫升含100 mg(生药含量)冬虫夏草提取液,测定腺苷含量为3.334 4 mg/100 ml,置于-80 ℃冰箱中保存备用[9]。
1.1.2 实验动物 SPF级C57BL/6雄性小鼠50只,体质量20~25 g,购自于上海西普尔必凯实验动物有限公司,生产许可证号: SCXK(沪)2013-2016。50只小鼠放于室内温度为22~26 ℃,湿度比例为44%~65%的动物房。给予所有小鼠正常饮食、饮水,饲养1周以适应生长。该实验已通过海军军医大学伦理委员会审核,均遵守实验动物管理规范和适用原则。
1.1.3 动物分组 SPF级C57BL/6雄性小鼠50只,按数字表法随机分为5组,每组10只,即低剂量CSE治疗(CSE-L)组、中剂量CSE治疗(CSE-M)组、高剂量CSE治疗(CSE-H)组,对照(Control)组、辐照组(Model)组。辐照前,5组小鼠正常饲养。
1.1.4 试剂 生理盐水(批号:160530D13)购于黑龙江福和华星制药集团股份有限公司;TUNEL检测试剂盒(货号:11684817910)购于Roche公司;体积分数为4%的多聚甲醛(P0099)、5×Loading Buffer(P0015L)、Western 及IP裂解液(P0013)、增强型BCA蛋白浓度测定试剂盒(P0010S)均购于碧云天公司;PrimeScriptTMRT Master Mix (Perfect Real Time,RR036A)、RNAiso Plus(9109)均购于Takara;SybrGreen qPCR Master Mix(QR-SG-M200)购于Rainbio公司;一抗内参蛋白GAPDH Rabbit mAb(#5174)、B淋巴细胞瘤-2(Bcl-2)Rabbit mAb(#3498)、Bax Rabbit mAb(#5023)、caspase 3 Rabbit mAb(#14220)、cleaved-caspase 3(#9661)Rabbit mAb均购于Cell Signaling Technology公司。
1.1.5 实验仪器 ECLIPSE TI-SR倒置荧光显微镜(日本 NIKON公司);ECLIPSE C1正置荧光显微镜(日本 NIKON公司);Bio-Chemi DocTMTouch化学发光成像系统(美国 Bio-rad公司)、CFX96 Touch定量PCR仪(美国 Bio-rad公司)。
1.2 方法
1.2.1 建立电离辐照损伤模型 称量各组小鼠体质量,每隔7 d进行体质量检测。将Model组、CSE治疗组的小鼠置于带有10个小格子塑料盒中固定,给予单次8 Gy60Coγ射线全身辐照。辐照条件为:8 Gy,辐照率为0.96 Gy/min。辐照后4 h,CSE-L、CSE-M与CSE-H组灌胃给予相应生药剂量的CSE,CSE-L组生药剂量312.5 mg/kg、CSE-M组生药剂量625 mg/kg、CSE-H组生药剂量1 250 mg/kg。同时,非治疗组小鼠给予等体积量的生理盐水。5组小鼠在相同的实验条件下,每日于14∶00进行灌胃给药/生理盐水1次,共持续28 d。5组小鼠分别于辐照前2 h,辐照后第7、14、21、28天称重并记录。实验结束前,Model组、CSE-L组小鼠分别死亡4只、1只,其余组的小鼠均无死亡现象出现。
1.2.2 标本收集 给药28 d后,用150 μl的3%水合氯醛麻醉小鼠,切开小鼠阴囊后,将小鼠的2只睾丸组织取出,用生理盐水反复清洗除去异物后,一只置于体积分数为4%的多聚甲醛中,另一只液氮速冻后置于-80 ℃冰箱保存。
1.2.3 TUNEL检测小鼠睾丸组织中凋亡的生精细胞数目[7]将石蜡切片进行脱蜡,加入蛋白酶K修复,破膜,加TUNEL试剂盒试剂1与试剂2孵育,然后DAPI复染细胞核,封片,最后于正置荧光显微镜下观察并采集Control组、Model组、CSE-H组小鼠组织的TUNEL染色图像并计算凋亡的生精细胞的数目。其中DAPI颜色显示为蓝色,TUNEL颜色显示为绿色。
1.2.4 qPCR检测睾丸组织中凋亡相关基因的表达[10]取(10±2)mg睾丸组织至1.5 ml EP管,加入1 ml的Trizon,放于细胞粉碎机中研碎。按照5∶1比例加入氯仿,充分漩涡,静置10 min,12 000 g离心10 min取上清至新的EP管中(离心半径8.6 cm),加入等量的异丙醇,轻轻混匀后静置10 min,12 000 g离心5 min弃上清(离心半径8.6 cm)。用无酶水配置的体积分数为75%的乙醇洗涤3次,干燥,依据沉淀量加入适量的无酶DEPC水,将沉淀弹匀即为RNA。测定RNA浓度后,定量,在20 μl体系下进行逆转录,于96孔PCR板中进行qPCR,并计算Control组、Model组、CSE-H组小鼠睾丸组织中Bcl-2、Bax、caspase 3基因的表达量。引物序列见表 1。

表1 PCR引物序列
1.2.5 Western blot检测小鼠睾丸组织中凋亡相关蛋白的表达[5]称取(20±2)mg睾丸组织,加入200 μl的Western及IP裂解液,放于细胞粉碎机中研碎,12 000×g离心10 min后取上清总蛋白,采用BCA法检测蛋白浓度并定量,沸水浴热变性。将等量的蛋白进行电泳,转膜,封闭,一抗4 ℃摇床过夜孵育,二抗避光孵育1.5 h后,放入Bio-Chemi DocTMTouch化学发光成像系统中显影,使用Image J软件对Control组、Model组、CSE-H组小鼠睾丸组织中的Bcl-2、Bax、caspase 3、cleaved-caspase 3蛋白进行定量分析。
1.3 统计学处理
采用Graphpad 7.0软件对实验数据进行分析,组间比较采用单因素方差分析(one-way ANOVA)。P<0.05表示差异有统计学意义。
2 结果
2.1 CSE对60Coγ射线辐照诱导小鼠体质量的影响
与Control组相比,Model组中小鼠体质量显著降低,差异有统计学意义(P<0.01);与Model组相比,CSE-L、CSE-M、CSE-H治疗组中小鼠体质量呈剂量依赖性明显上升(P<0.05或P<0.01);与Control组相比,CSE-M与CSE-H治疗组小鼠体质量均差异无统计学意义(P>0.05)。见表2。这提示CSE对60Coγ射线辐照后小鼠体质量减轻有保护作用。

表2 8 Gy60Co γ射线辐射后不同时间各组小鼠体质量变化(g,x±s)
2.2 CSE对60Coγ射线辐照诱导小鼠睾丸组织TUNEL阳性细胞数目的影响
睾丸组织TUNEL切片中的阳性细胞即为凋亡的生精细胞。TUNEL染色结果显示,Model组小鼠凋亡的生精细胞数目[(58.33±4.41)个]比Control组[(9.00±0.58)个]显著增加,差异有统计学意义(P<0.01)。与Model组相比,CSE-H组小鼠睾丸组织TUNEL阳性细胞数目[(21.33±4.67)个]明显降低,差异有统计学意义(P<0.01)。因此,TUNEL实验结果显示,高浓度CSE能有效地抑制由辐照引起的睾丸组织中生精细胞的凋亡。见图1。
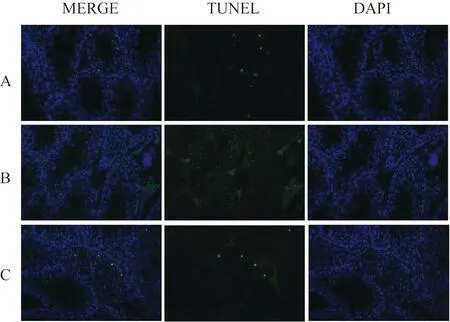
注:A代表对照组,B代表模型组,C代表高剂量CSE治疗(CSE-H)组。CSE为冬虫夏草提取液图1 CSE对8 Gy 60Co γ射线辐照小鼠睾丸组织TUNEL阳性细胞数目的影响
2.3 CSE对60Coγ射线辐照诱导小鼠睾丸组织中Bcl-2、Bax、caspase 3基因mRNA相对表达量的影响
qPCR结果所示,与Control组相比,Model组中小鼠睾丸组织中促凋亡基因Bax、caspase 3 mRNA相对表达量显著增加,抑凋亡基因Bcl-2 mRNA相对表达量明显降低,差异均有统率学意义(P<0.01)。与Model组相比,CSE-H组中Bax、caspase 3 mRNA相对表达水平显著下调,Bcl-2基因mRNA相对表达水平明显上调,差异均有统计学意义(P<0.05或P<0.01)。见表4。该实验结果表明,CSE能有效地改善上述与凋亡相关的基因表达。
2.4 CSE对60Coγ射线辐照诱导小鼠睾丸组织中Bcl-2、Bax、caspase 3、cleaved-caspase 3蛋白表达量的影响
与Control组相比,Model组中Bax、cleaved-caspase 3蛋白水平显著上调,Bcl-2蛋白水平明显下调,差异均有统计学意义(P<0.01)。这提示60Coγ射线辐照增强了促凋亡蛋白cleaved-caspase 3的发生。与Model组相比,CSE-H治疗组中抑凋亡蛋白Bcl-2表达水平显著升高,促凋亡蛋白Bax、cleaved-caspase 3表达水平明显降低,差异均有统计学意义(P<0.05或P<0.01)。见表5。该实验结果显示,CSE可以逆转由辐照引起的上述凋亡相关蛋白表达。

表5 CSE对8 Gy 60Co γ射线辐照诱导小鼠睾丸组织中Bcl-2、Bax、caspase 3、cleaved-caspase 3蛋白表达量的影响(x±s)
3 讨论
冬虫夏草具有多种生物学和药理学功能,已被广泛应用于性功能、生殖功能障碍[9]。目前已有体外研究表明,CSE不仅可以与正常小鼠间质细胞结合,诱导睾丸激素的产生,而且刺激MA-10小鼠睾丸间质肿瘤细胞分泌睾酮与类固醇[10]。体内实验报道显示,CSE可以提高未成熟和成熟B6小鼠的血浆睾酮水平,改善野猪和大鼠的精子质量和数量,从而增强雄性的性功能[10]。然而,CSE对电离辐照后的睾丸组织是否有保护作用尚不清楚[11]。因此,本课题对CSE治疗辐照诱导小鼠睾丸组织损伤的潜在保护机制进行了探索。
本研究从宏观及微观基因蛋白调控方面,阐述了CSE保护辐照后睾丸组织损伤的分子生物学机制。电离辐照引起的最直观的损伤为小鼠的体质量、睾丸器官指数的降低[12-13]。小鼠受到全身辐照损伤后,总体质量会显著降低,代表此次造模成功。CSE治疗后小鼠体质量明显上升,表明CSE对辐照后的小鼠体质量减轻有显著的改善功能。电离辐照会增加氧化自由基的释放与DNA的损伤,从而导致细胞凋亡及组织结构的损伤[13-14]。为深入探索CSE对电离辐照的保护作用机制,本研究通过采用TUNEL染色来探讨睾丸组织电离损伤细胞凋亡情况。TUNEL染色结果显示,Model组小鼠睾丸组织中阳性细胞数目增加,CSE治疗后凋亡细胞数目减少,提示CSE降低了辐照后小鼠睾丸组织中凋亡的生精细胞数目,其作用机制可能与抗凋亡相关。
既往有研究认为,电离辐射主要通过产生细胞毒性,促使一系列的调控基因、蛋白表达,从而产生了细胞凋亡[6]。60Coγ射线辐照后,作用于pro-caspase 9,启动了线粒体通路释放更多的细胞色素C[14]。同时,pro-caspase 9能够与细胞色素C及信号分子Apaf-1结合形成复合物,自身被剪切成cleaved-caspase 9,从而进一步激活下游Bax、Bcl-2、cleaved-caspase 3蛋白,导致了细胞凋亡[15-16]。qPCR与Western blot实验结果显示,CSE-H组与Model组相比,能显著上调Bcl-2基因与蛋白表达,下调Bax蛋白表达。此外,CSE治疗后,促凋亡基因Bax、caspase 3 mRNA相对表达量下降,促凋亡蛋白Bax、cleaved-caspase 3表达量下降。该结果表明,CSE保护睾丸组织可能是通过抑制线粒体凋亡通路来起作用的。
综上所述,CSE对60Coγ射线辐照后的小鼠睾丸组织损伤有明显的改善作用,其保护机制可能与降低小鼠睾丸组织的细胞凋亡,下调促凋亡相关基因与蛋白表达,以及上调抑凋亡相关基因与蛋白表达有关。这为研究辐照引起的生殖器官损伤提供了新的思路,可能为临床治疗因辐照引起的男性生殖系统功能障碍提供了新的治疗手段。

