前列腺癌组织CHK2和Rsf1蛋白表达及其与临床病理和预后的关系
程蔚蔚,孙硕彤,邓青,徐鹏育,田笑笑
(河南科技大学第一附属医院病理科,河南 洛阳 471000)
前列腺癌多发于老年男性,其发病率在我国泌尿系统恶性肿瘤中居于第三位,仅次于膀胱癌与肾癌[1]。根治性手术是目前治疗前列腺癌的主要手段,但术后复发率高达20%-50%,而复发后采用化疗、放疗等补救性治疗的效果不佳[2]。因此,寻找前列腺癌早期诊治与预后评价的可靠的生物学指标,对于改善患者预后具有重要意义。细胞周期检测点激酶2(CHK2)是参与受损DNA的修复过程的重要因子,近年研究报道,CHK2表达水平与胃癌等多种肿瘤的发生风险以及治疗预后密切相关[3]。染色质重染色质重塑因子-1(Rsf-1)是乳腺癌患者中高表达,且其表达水平与肿瘤体积、分期、化疗药物耐药性等具有明显相关性[4]。但关于前列腺癌患者CHK2、Rsf1的研究还较少见,本研究检测了前列腺癌组织中CHK2与Rsf1的表达情况,并分析其与病理特征及患者预后的相关性,报告如下。
1 资料与方法
1.1 一般资料 选取2016年1月至2017年 12月在我院治疗的前列腺癌患者121例为观察组,纳入标准:⑴经病理检查确诊前列腺癌;⑵均行根治性手术;⑶自愿参加研究,临床及随访资料完整;排除标准:⑴非首次确诊;⑵合并糖尿病、冠心病等基础疾病;⑶合并其他恶性肿瘤。另选取同期行手术治疗的良性前列腺增生患者148例为对照组。观察组年龄53~74岁,平均(65.24±9.48)岁;前列腺特异抗原(PSA)水平:≤20 ug/L 67例,>20 ug/L 54例;TNM分期:Ⅰ期26例,Ⅱ期31例;Ⅲ期46例,Ⅳ期18例;Gleason评分:<8分52例,≥8分69例;淋巴结转移45例。对照组年龄59~78岁,平均年龄(66.84±11.42)岁,两组年龄差异无统计学意义(P>0.05)。
1.2 方法
1.2.1 检验方法 采用免疫组化法检测癌组织、良性增生组织中CHK2、Rsf1表达情况,癌组织进行石蜡包埋、切片、脱水、修复后,HE染色,光学显微镜下(400×)随机选择5个视野,每个视野选择200个细胞,分别由2位工作经验丰富的病理医师双盲阅片,观察染色强度与阳性细胞百分比。当两位医师评估结果不一致时,取评估结果平均值。染色强度计分,无着色为0分,浅黄色为1分,棕黄色为2分,棕褐色为3分;按照参考文献CHK2阳性细胞百分比计分标准为:5%及以下计0分,6%~25%计1分,26%~50%计2分,51%~75%计3分,75%以上计4分。Rsf-1阳性细胞百分比计分标准为:25%及以下计0分,26%~50%计1分,51%~75%计2分,75%以上计3分。结果判读取二者之积,选取中位数,分数大于等于中位数为高表达;反之为低表达。
1.2.2 随访情况 术后通过电话以及门诊复查对观察组患者进行随访,随访时间至2020年12月。
1.3 统计学方法 使用SPSS 19.0软件进行统计分析。计量资料符合正态分布采用t检验;计数资料采用χ2检验。生存分析用Kaplan-Meier法,组间生存率比较用Logrank检验;采用Cox比例风险回归模型分析影响生存预后的因素。P<0.05为差异有统计学意义。
2 结果
2.1 CHK2与Rsf1的表达情况 观察组CHK2低表达、Rsf1高表达比例明显高于对照组(P<0.001),见表1。
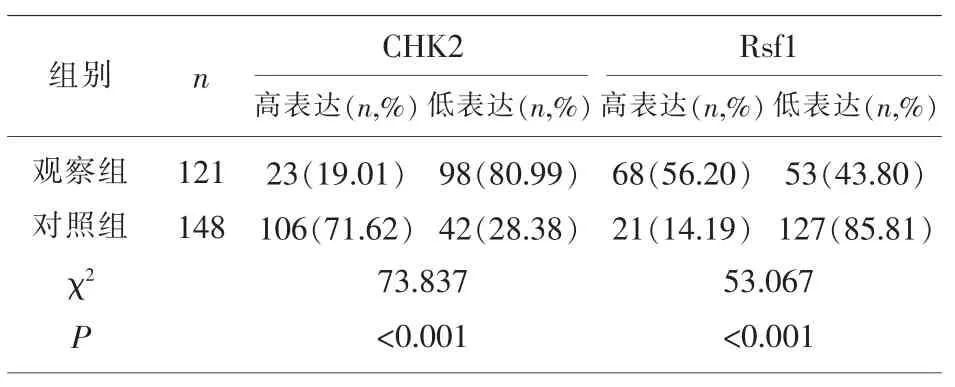
表1 CHK2与Rsf1的表达情况
2.2 CHK2与Rsf1表达水平与前列腺癌临床特征的相关性 见表2。
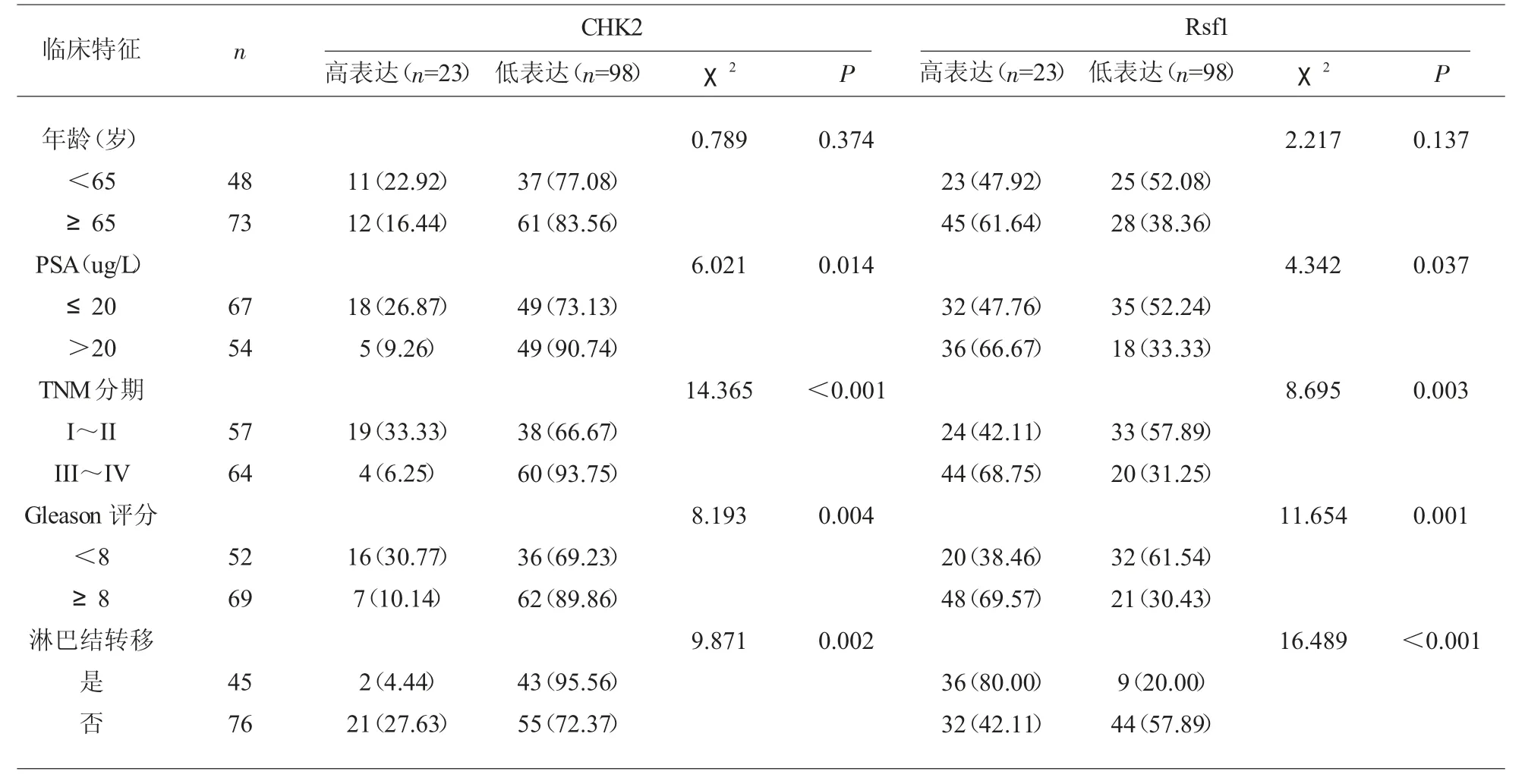
表2 CHK2与Rsf1表达水平与前列腺癌临床特征的相关性
2.3 CHK2与Rsf1表达水平对前列腺癌患者3年生存情况的影响 术后随访3年,观察组共32例患者死亡,89例患者生存,总生存率73.55%。Kaplan-Meier生存分析表明,CHK2高表达患者3年总生存率 (56.52%)低于CHK2低表达患者(77.55%)(χ2=4.235,P=0.039);Rsf1高表达患者总生存率(82.35%)高于Rsf1低表达患者(62.26%)(χ2=6.179,P=0.013),见图1、图2。
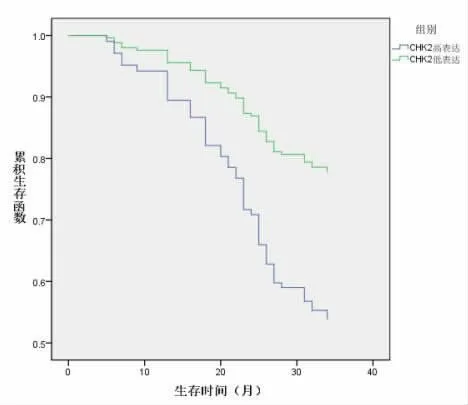
图1 不同CHK2水平患者生存曲线
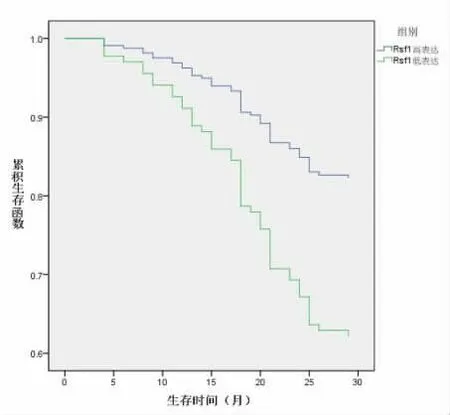
图2 不同Rsf1水平患者生存曲线
2.4 影响前列腺癌患者预后不良的危险因素分析单因素分析结果显示,年龄(HR=1.235,95%CI:0.743~1.530)与患者总生存时间无关(P>0.05)。PSA(HR=3.157,95%CI:1.335~3.285)、TNM分期(HR=3.328,95%CI:1.834~4.245)、Gleason评 分(HR=2.288,95%CI:1.628~3.382)、淋 巴 结 转 移(HR=1.729,95%CI:1.598~3.453)以及CHK2(HR=3.693,95%CI:1.894~4.553)、Rsf1(HR=1.839,95%CI:1.678~3.552)是影响前列腺癌患者总体生存时间的因素(均P<0.05)。
以患者是否生存为因变量,以上述单因素分析有统计学意义的因素为自变量,建立Cox回归模型,见表3。
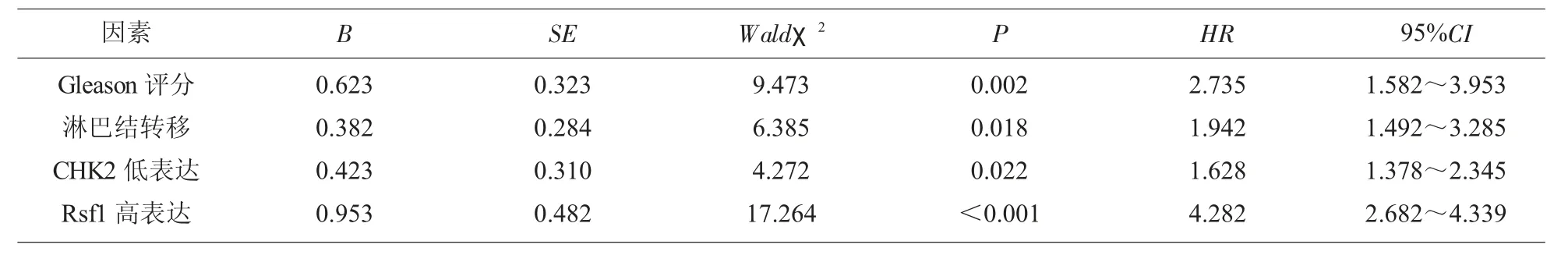
表3 影响前列腺癌患者总生存时间的危险因素分析
3 讨论
手术、激素治疗和放疗等对局限性前列腺癌的治疗效果较好,患者5年生存率可达95%,然而一旦发生远处转移或激素非依赖性前列腺癌,患者治疗效果不佳[1]。寻找利于前列腺癌诊治和预后评价的指标是临床及基础研究的重点。
在肿瘤的发病过程中,细胞受到自身以及外界等多种因素的影响,可造成细胞内DNA的损伤,从而导致体内原癌或者抑癌基因、DNA修复基因等出现病理改变,继而促使细胞向异常方向转化。CHK的重要作用是在DNA双链受损时,延缓细胞周期的进行,为DNA修复提供充足时间[3]。已有多项研究证实,CHK2在胃癌、卵巢癌、前列腺癌等多种恶性肿瘤中呈现低频突变状态[5-7]。此外,研究还报道,在甲状腺癌患者中普遍存在CHK2基因座丢失[8];在头颈鳞状细胞癌患者中发现CHK2表达的表观遗传沉默[9]。因此多数研究者认为CHK2可能是重要的抑癌基因,其通过调节细胞周期,参与DNA损伤修复过程,从而影响恶性肿瘤发生的风险[5-8]。本研究结果显示,观察组CHK2低表达比例明显高于对照组,且PSA>20μg/L、III~IV期、Gleason评分≥8分、淋巴结转移患者普遍存在CHK2低表达,表明CHK2水平与前列腺癌患者临床病理特征密切相关。
Rsf-1是由染色体11q13.5区域基因所表达的一种特殊蛋白质,它能够作用于蔗糖非发酵蛋白2同源物(h SNF2H),形成染色质重塑因子(RSF)复合物,参与多种细胞生长信号的调节过程,可引起核小体的空间重构,诱发正常细胞恶变,在肿瘤进展过程中起着重要作用[4]。已有研究表明,Rsf-1在胃癌、子宫内膜癌、宫颈癌组织中高表达,并且其表达水平与肿瘤体积、TNM分期存在正相关[10-12]。谢兆光等[13]研究报道,Rsf-1高表达与肿瘤细胞的侵袭性相关,Rsf-1表达水平越高,患者对化疗药物的耐药性越高,预后越差。本研究结果显示,观察组Rsf1高表达比例高于对照组,且Rsf1表达水平与PSA水平、TNM分期、Gleason评分及淋巴结转移情况密切相关,表明Rsf1与前列腺癌的进展有关,与上述关于其他恶性肿瘤的研究结论一致。
影响前列腺癌预后的因素较多,本研究显示,Gleason评分和淋巴结转移是前列腺癌3年总体生存时间的独立危险因素,这与既往研究一致[14]。本研究中,CHK2高表达患者3年总生存率(56.52%)低于CHK2低表达患者(77.55%);Rsf1高表达患者总生存率 (82.35%)高于Rsf1低表达患者(62.26%)。多因素分析显示,CHK2低表达(HR=1.628,95%CI:1.378~2.345)、Rsf1高 表 达 (HR=4.282,95%CI:2.682~4.339)是影响患者生存时间的独立危险因素,表明CHK2、Rsf1的表达水平均与前列腺癌患者的总体生存时间密切相关,可作为评估患者长期预后的生物学指标。
综上所述,前列腺癌组织中CHK2呈明显低表达、Rsf1明显高表达,两者均与患者PSA水平、TNM分期、Gleason评分以及淋巴结转移密切相关,提示此两种蛋白参与前列腺竞品的发生及发展,可作为评估前列腺癌病情及预后的参考指标。

