SPG膜乳化法制备槲皮素缓释微球的工艺优化与表征及体外释放研究*
张尚前,周先泰,覃秋宜,齐娜
(桂林医学院药学院,桂林 541004)
槲皮素(Quercetin,QT),是一种五羟黄酮,大部分以苷的形式存在于植物的花、叶或果实中,具有化痰、止咳、平喘的功效,用于治疗慢性支气管炎,还具有降低血压的疗效,可用于辅助治疗冠心病及高血压[1]。目前,有研究表明其还可用于治疗肝癌[2-3]。槲皮素可溶于甲醇、吡啶、丙酮等有机溶剂,易溶于乙醇,但不溶于水,所以药物溶出和吸收比较受限,导致其生物利用度较低[4]。
微球是指药物溶解或分散在载体材料中形成的微小球状实体。微球粒径范围一般为1~500 μm,根据制备微球的载体材料不同,主要分为天然高分子微球,如淀粉微球、白蛋白微球、明胶微球、壳聚糖等,和合成聚合物微球,如聚乳酸微球等[5-6]。其中聚乳酸-羟基乙酸共聚物[poly(lactic-co-glycolic acid),PLGA]微球可使药物在体内几周或几个月内以一定速率缓慢释放,实现缓释的目的。与现有常规制剂比较,微球减少了给药次数,且提高了患者的顺应性[7]。
槲皮素水溶解性差,将其制备成缓释微球制剂可以提高溶解性,改善其吸收和分布,提高其生物利用度,为槲皮素的开发与利用提供了新选择。Shirasu porous glass(SPG)膜乳化技术在控制微球粒径分布方面具有独特优势,SPG膜是由亲水性玻璃材料Al2O3-SiO2制成的一种多孔玻璃膜,通过SPG膜制备的脂溶性载体PLGA微球,粒径均一可控,是制备微球最常用的方法之一[6-8]。PLGA为生物可降解材料,降解产物无毒,具有生物相容性好、生物降解可控、缓控释等优点。本实验采用SPG膜乳化的方法,以PLGA为药物的载体材料来制备槲皮素缓释微球。实验通过改变过膜压力、连续相搅拌速度、油水相体积比、聚乙烯醇[poly(vinyl alcohol),PVA]浓度来优化微球形态、粒径及其分布,考察不同的槲皮素用量和PLGA用量来优化包封率和载药量,以此得到槲皮素微球最优处方。利用直接释药法和超速离心法[9-10]结合对槲皮素微球的体外释放行为进行考察。以期得到表征良好的槲皮素长效缓释微球。
1 仪器与试药
1.1仪器 MG-20型SPG膜乳化机,SPG膜(孔径1.1 μm)(嘉盛(香港)科技有限公司),TGL-16台式高速离心机(金坛区金城春兰实验仪器厂),CP225D电子天平(德国Sartorius公司),ZD-85恒温振荡仪(北京国华科技集团有限公司),UV-1800PC紫外可见分光光度计(上海美普达仪器有限公司),Olympus CX22光学显微镜(日本Olympus公司),ZS90型激光粒度分析仪(英国Malvern公司)。
1.2药品与试剂 槲皮素(西安小草植物科技有限责任公司,批号:XC081218,含量≥ 98%),聚乳酸-羟基乙酸共聚物(PLGA,LA/GA=50/50,Mr 200 000,广州创赛生物医用材料有限公司),二氯甲烷(广东光华科技股份有限公司),聚乙烯醇(PVA-1799,上海信裕生物科技有限公司),十二烷基硫酸钠(sodium dodecyl sulfate,SDS,上海埃彼化学试剂有限公司),无水乙醇(分析纯,西陇科学股份有限公司)。
2 方法与结果
2.1槲皮素含量测定方法建立 紫外-可见分光光度法190~600 nm范围内全波长扫描,配制2,5,8,10,12和15 μg·mL-1的槲皮素标准溶液,测定吸光度(A),以浓度(C,μg·mL-1)为横坐标,A为纵坐标,绘制标准曲线[1]。取适量对照品溶液高、中、低浓度组,各溶度组分别连续测定3次,计算组内相对标准偏差(RSD)评价精密度,0,2,4,8,12 h测定各组间RSD评价不同时间的稳定性[5],反复取高、中、低浓度组连续测定6次吸光度,计算RSD评价含量测定方法的重复性。
紫外-可见分光光度法测定槲皮素最大吸收波长在375 nm,选择375 nm波长处进行吸光度测定,槲皮素2~15 μg·mL-1范围内线性关系良好,标准曲线方程A=0.049 8C+0.001 4,r=0.999 2。不同溶度组RSD分别为1.98%,0.90%,1.09%精密度良好,表明不同浓度之间该测定方法干扰性小。12 h内3组间RSD为1.75%,1.53%,1.76%,表明12 h内该测定方法干扰性小。重复性考察RSD为1.46%,1.76%,1.77%,表明该测定方法重复性良好,由此可知该方法符合方法学要求[6]。
2.2槲皮素微球的制备 精密称取适量槲皮素用无水乙醇溶解,称取适量PLGA,二氯甲烷溶解,将两溶液混合均匀制得分散相液体,倒入分散相罐中。称取适量PVA,配置成不同浓度的PVA溶液,即得连续相。安装膜乳化装置,氮气将分散相挤出使其通过SPG膜进入到分散相,进行乳化反应。连续相中产生大量的气泡时关掉氮气。然后乳液搅拌4~6 h,最终得槲皮素微球混悬液[11-12]。取少量微球混悬液,显微镜观察;粒径分析仪测粒径及其分布。离心(8 000 r·min-1),除去上清液,去离子水洗涤3次,冷冻干燥,即得槲皮素微球。
2.3槲皮素微球载药量与包封率的测定 精密称量槲皮素缓释微球10 mg,二氯甲烷溶解,无水乙醇定容至刻度,离心(10 000 r·min-1)10 min后,在375 nm波长下测定上清液的吸光度,代入标准曲线计算药物浓度与质量,按照以下公式计算微球包封率(encapsulation efficiency,EE)和载药量(drug loading,DL)[13]:
EE(%)为包封率,DL(%)为载药量,W1,W2和W3分别表示包封于微球中槲皮素的质量,槲皮素的总质量和槲皮素微球总质量
2.4槲皮素缓释微球的处方优化 槲皮素缓释微球的处方优化从两个方面进行,一方面考察过膜压力,连续相搅拌速度,油水相体积比,外水相PVA浓度对微球粒径及其分布的影响;另一方面考察槲皮素用量,PLGA用量对微球包封率和载药量的影响,从而得到制备槲皮素缓释微球的最优处方。
2.4.1过膜压力对载药微球粒径及其分布的影响 按“2.2”项下的方法制备微球,实验采用厚度1.1 μm SPG膜,设置过膜压力分别为0.012,0.017,0.026,0.031 MPa。制得微球并在光学显微镜下观察[4],在粒径分析仪中测定平均粒径和多分散系数(polydispersity index,PDI)。
由图1可知,随着过膜压力增大,其粒径逐渐减小,当过膜压力最小时,其PDI最大。当压力为0.017 MPa时,其粒径较小,PDI为0.728,数值最小,此时槲皮素微球的分布较其他压力下相对均匀。当过膜压力大于0.017 MPa,并压力逐渐增大时,其PDI并没有很明显的变化。因此本实验选择过膜压力为0.017 MPa进行后续的实验。

图1 过膜压力对载药微球粒径及其分布的影响
2.4.2连续相搅拌速度对载药微球粒径及其分布的影响 按“2.2”项下的方法制备微球,设置连续相搅拌的速度为300,400,500,600 r·min-1制备微球,并在光学显微镜下观察微球形态,在粒径分析仪中测定平均粒径和PDI。
由图2可知,随着连续相搅拌速度的提高,粒径逐渐减小,到达600 r·min-1时,粒径变化不大,但搅拌速度的变化对微球的PDI影响不大。当连续相的搅拌速度为500 r·min-1时,其PDI最小,此时显微镜表观槲皮素微球分布也相对较为均匀,因此选用500 r·min-1转速作为后续实验的条件。

图2 连续相搅拌速度对载药微球粒径及其分布的影响
2.4.3油水相体积比对载药微球粒径及其分布的影响 按“2.2”项下的方法制备微球,设置油水相的体积比为1:6,1:7,1:8,1:9制备微球[6],并在光学显微镜下观察微球,在粒径分析仪中测定平均粒径和PDI。
由图3可知,油水相体积比为1:8时,其PDI最小,为0.476,槲皮素微球分布相对较为均匀,且此时平均粒径与SPG膜孔径大小也较为接近。所以本实验选择油水相体积比1:8进行后续实验。

图3 油水相体积比对载药微球粒径及其分布的影响
2.4.4外水相PVA浓度对载药微球粒径及其分布的影响 按“2.2”项下的方法制备微球,设置PVA浓度分别为0.25%,0.5%,1%,2%制备微球,并在光学显微镜下观察微球,在粒径分析仪中测定平均粒径和PDI。
由图4,5可知,平均粒径的大小随着PVA浓度的增大而增大。当PVA浓度为0.5%时,其PDI最小,其平均粒径也较小,为0.623 μm。本实验选择PVA浓度0.5%进行后续实验。

图4 PVA浓度对载药微球粒径及其分布的影响
经粒径分析仪的测定结合单因素考察,制备微球粒径及其分布较好的处方条件是:过膜压强为0.017 MPa,搅拌速度定为500 r·min-1,油水相体积比为1:8,外水相PVA浓度为0.5%。
2.4.5槲皮素用量对载药微球包封率和载药量的影响 按“2.2”项下的方法制备微球,考察槲皮素用量为5,10,15 mg对微球包封率和载药量的影响[14]。
由图6可知,不同的槲皮素用量对载药微球的载药量和包封率都有一定的影响。当槲皮素用量增加时,载药微球的载药量随之增大,但其包封率却逐渐减小,所以当槲皮素用量为5 mg时,其包封率最大,为91.61%。均衡分析,选择了槲皮素用量为5 mg来进行后续实验。

图5 槲皮素微球的光学显微图(×100)

图6 槲皮素用量对载药微球包封率和载药量的影响
2.4.6PLGA用量对载药微球包封率和载药量的影响 按“2.2”项下的方法制备微球,考察PLGA 50,100,150 mg的用量对微球包封率和载药量的影响[15]。
由图7可知,当PLGA用量增加时,其载药量随之减小,PLGA用量为50 mg和用量为100 mg的载药量近似,而包封率在PLGA用量为100 mg时最大,为91.61%。所以综合考虑包封率和载药量,选择PLGA的用量为100 mg来进行后续实验。

图7 PLGA用量对载药微球包封率和载药量的影响
综上考察,最优处方为:过膜压力0.017 MPa,搅拌速度500 r·min-1,油水相体积比1:8,外水相PVA浓度0.5%,槲皮素为5 mg,PLGA为100 mg。
2.4.7验证实验 使用最优处方制备槲皮素微球,使用激光粒度仪对其粒径及其分布进行考察,通过光学显微镜对形态进行验证。
制得的槲皮素微球干燥后呈黄色粉末状,粒径为(0.623±0.05)μm,PDI为(0.467±0.10),见图8,粒径较小且分布较均匀,经显微镜观察该微球形态圆整,如图9,包封率较高,为(91.61±4.15)%,载药量为(6.97±0.45)%。结果见表1。
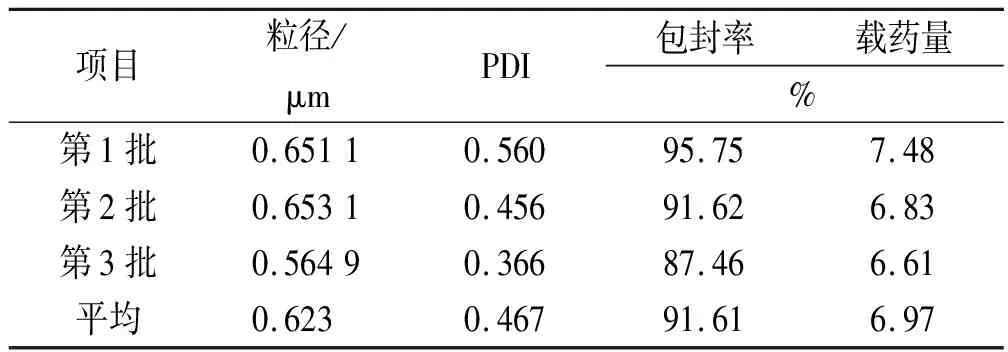
表1 最佳处方验证

图8 处方优化后槲皮素微球的粒径分布

图9 处方优化后槲皮素微球的光学显微图(×100)
2.5槲皮素缓释微球的体外释放 本实验是利用直接释药法和超速离心法结合来测定槲皮素缓释微球的体外释放行为[12,16-18]。取冻干的载药微球10 mg,置于离心管中,加入磷酸盐缓冲液(phosphate buffer solu tion,PBS)(pH值=7.4)4 mL,将离心管置于恒温振荡器中(37 ℃,100 r·min-1)振荡,分别于0.5~576 h取出上清液4 mL并在10 000 r·min-1的转速下离心5 min,采用紫外分光光度法测定吸光度,并再加入PBS缓冲液4 mL,继续振荡。测得吸光度计算累积释放率,绘制槲皮素微球的体外释药曲线。公式如下:
式中Cn为各时间点取样时测的槲皮素浓度,V为加入的释放介质的体积,W称取的微球质量,D为微球的载药量。
选择最优处方制备槲皮素微球3组平行样品,参考药典[13]微粒制剂指导原则,体外释放实验中关于突释效应,要求开始0.5 h内的释放量要求低于40%,本试验中0.5 h时累积释放率为2.45%,没有出现突释效应。12 h时累积释放率达到16.41%,576 h时累积释放率为80.84%,见图10,槲皮素微球的释放率曲线明显平缓,说明该微球释放平稳,有明显的缓释特征。
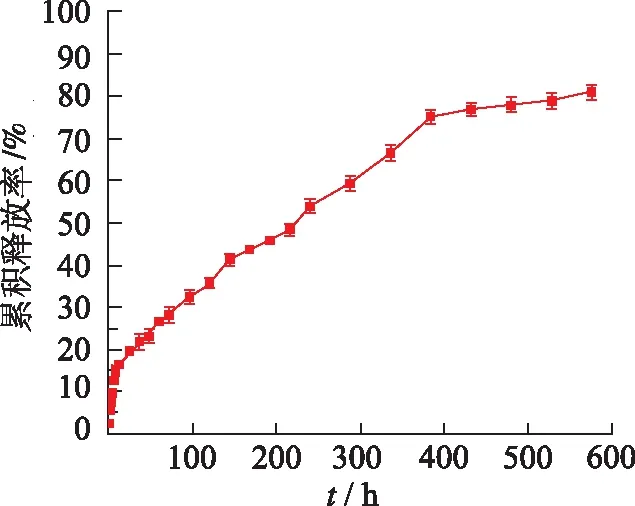
图10 槲皮素微球体外释放曲线
3 讨论
当过膜压力较小时,则无法克服分散相与连续相之间的界面张力的作用,分散相就无法迅速从膜上脱离下来,于是在膜表面形成的乳液滴变大,当分散相流速不变,剪切力剪切下来的液滴粒径就会相对较大,导致粒径分布不均匀,压力为0.012 MPa时,平均粒径及其PDI都较大。压力较大时,分散相从膜上脱离的速度变快,但流速不变,剪切力也不变,使剪切的液滴粒径相对较小[19]。
在膜乳化过程中,液滴的形成是由于流动相搅拌速度产生流速剪切力的结果,流速剪切力作用于膜表面的分散相液滴,使其从膜上剪切脱离下来。搅拌速度越小,流速剪切力越小,剪切液滴的速度变慢,液滴粒径变大,反之,粒径变小[20-21]。当流动相搅拌速度为300 r·min-1时,搅拌速度最小,其平均粒径最大,随着压力增大,其平均粒径变小。
连续相的体积越小时,分散相和连续相的体积比变小,此时液滴之间空间变小,容易发生碰撞,较易融合,所以会导致液滴粒径变大,影响粒径分布。当分散相与连续相的比值为1:6时,其粒径最大,PDI也最大。当连续相体积增大时,液滴之间碰撞概率变小,从而液滴融合的几率减少,所以微球粒径的均一性较好[22]。
改变外水相PVA浓度的情况下,外水相溶质的浓度越大,乳滴的粒径越大,同理,当浓度变小时粒径变小。当浓度变大时,其平均粒径也逐渐增大,其原因是连续相的溶质浓度增大其粘度增大,连续相的流速变慢,其流速剪切力变小,会导致乳滴从膜表面上脱离的速度变慢,形成液滴的分散相增多[23],微球的粒径变大。
槲皮素用量增加时,一方面,在乳化过程中,油相中的槲皮素浓度增加,初乳液中油相的粘度增加,其稳定性会变好,从而减少了油水相融的现象,提高了药物的包封率[24]。而本实验中的槲皮素用量增加而包封率却逐渐减小,则可能是由于选取投入的药量已超过PLGA的载药范围[19]。同时,槲皮素用量增加,水相包裹和吸附的量也增加,所以微球的载药量增加,另一方面,在做破乳实验时槲皮素微球里的槲皮素浓度大,内外水相的浓度差较大,槲皮素扩散到外水相的量增多,测得槲皮素浓度较大,从而载药量随投药量的增加而增大[13]。
乳化过程中,PLGA用量影响着油相的浓度与粘度,当PLGA用量加大,则油相的浓度和粘度变大,二氯甲烷会加快挥发速度,从而加快微球的固化,也就提高了药物的包封率[25]。而当PLGA量增加的同时,槲皮素的量不变,导致一部分PLGA过剩,从而使载药量减小。
药物在PLGA微球中的释放有两种机制[26-27]:一种是吸附或者嵌入在微球表面的药物快速扩散到释放介质中去;另一种是在微球表面的药物快速释放之后,包入微球中的药物依靠PLGA载体在释放介质中缓慢释放。通常情况下,药物的扩散贯穿整个释药过程。由于槲皮素难溶于水,参考文献[1]和药典[18]缓释、控释和迟释制剂指导原则加入2%的SDS,在释放初期吸附和嵌入在微球表面的槲皮素快速释放,微球会吸水稍微膨胀,包入微球中的槲皮素也会通过微球表面细小的孔道释放出来,开始释放的药物浓度较大,而当溶胀达到平衡[28]时,槲皮素的释放以PLGA降解的方式扩散,因此后面的释药速率相对较慢,累积释放率曲线相对平缓[29-30]。

