益肠内营养联合益生菌对非酒精性肝病肝纤维化的治疗效果及临床应用价值
徐惠圆,李昌平
非酒精性脂肪肝病(non-alcoholic fatty liver disease,NAFLD)已成为全球最流行的慢性进行性肝病,在全球的发病率约为24%,其中有2%~3%会发展成为非酒精性脂肪肝纤维化[1]。肝纤维化是NAFLD渐进性病理改变过程,属可逆性病变,积极科学合理抗纤维化治疗是减轻肝细胞损伤、逆转肝纤维化、抑制肝硬化的重要措施,对患者预后改善具有重要的意义[2]。肝纤维化病理特点会导致患者营养不良,严重影响预后,因此给予积极的营养支持治疗意义重大[3]。营养支持包括肠内营养和肠外营养两种方式,而肠内营养直接与肠黏膜作用有助于维护肠道黏膜障功能和完整性,更满足患者生理需求,改善病情效果更佳[3]。研究表明,肝纤维化患者常伴有肠黏膜屏障功能的损伤,而益生菌可调节机体肠道菌群的结构,改善肠道黏膜屏障功能,促进营养物质的吸收[4]。因此,在合理药物治疗基础上配合科学营养干预已成为现阶段临床治疗NAFLD重点研究方向。本研究首次将益生菌、营养干预联合应用于非酒精性肝病肝纤维化患者的临床治疗,以随机、对照方法从肝功能、肝纤维化、营养状况、凝血功能、炎症反应、氧化应激等多方面分析其应用价值。现报道如下。
1 资料与方法
1.1 研究对象
回顾性选取西南医科大学附属医院2018年1月至2020年1月收治的非酒精性脂肪肝病肝纤维化患者,诊断标准为[5]:①无饮酒史或饮酒折合乙醇量,男性过去12个月每周<210 g,女性每周<140 g;②未应用乙胺碘呋酮、甲氨蝶呤、他莫昔芬、糖皮质激素等药物,并排除基因3型HCV感染、肝豆状核变性、自身免疫性肝炎、全胃肠外营养、先天性脂质萎缩症、乳糜泻等可以导致脂肪肝的特定疾病;③伴有一定程度右上腹胀痛、食欲不振、乏力、体质量减轻、黄疸等表现,部分患者存在肝脏肿大、压痛;血液化验检查可见总胆红素(total bilirubin,TBiL)、丙氨酸氨基转移酶(alanine aminotransferase,ALT)、天门冬氨酸氨基转移酶(aspartate aminotransferase,AST)、缺糖转铁蛋白(carbohydrate deficient transferrin,CDT)等指标异常升高;④肝脏组织学表现符合非酒精性脂肪肝纤维化诊断的病理改变。纳入标准:①符合上述诊断标准,且经临床症状、体征、肝脏B超、CT、肝功能检查等确诊,肝细胞活体组织病理学检查显示均存在肝纤维化病变;②签署知情同意书且经医院医学伦理委员会审批者。排除标准:①合并其他恶性肿瘤、白血病及结缔组织病;②妊娠期与哺乳期妇女;③存在严重脏器功能障碍者;④病毒感染、药物等其他原因引起的肝病肝纤维化;⑤病历资料不完善者;⑥对本研究治疗干预方案存在使用禁忌证或不耐受;⑦认知、沟通能力、精神状态异常,或依从性差,无法有效配合临床治疗、干预及相关检查。根据纳入标准和排除标准,最终纳入80例患者。两组患者性别、年龄、体质量指数(BMI)、NRS2002评分等基础资料均衡可比(P>0.05),见表1。

表1 两组一般资料比较
1.2 观察指标
收集记录两组患者年龄、性别,治疗前NRS2002评分和体质量指数。收集记录两组患者治疗前和治疗4周后AST、ALT、TBiL及直接胆红素(direct bilirubin,DBiL),营养指标血清总蛋白(total protein,TP)、白蛋白(albumin,ALB)及转铁蛋白(transferrin,TF),凝血功能凝血酶原时间(prothrombin time,PT)、活化部分凝血活酶时间(activated partial thromboplastin time,APTT),炎症指标C反应蛋白(C-reactive protein,CRP),白介素-6(IL-6)、白介素-10(IL-10)和肿瘤坏死因子-α(TNF-α),氧化应激指标超氧化物歧化酶(superoxide dismutase,SOD)、谷胱甘肽过氧化物酶(glutathion peroxidase,GSH-Px)、丙二醛(malondialdehyde,MDA)以及肝纤维化指标透明质酸(hyaluronic acid,HA)、Ⅲ型前胶原(Procollagen type III,PC-Ⅲ)、层黏蛋白(Laminin,LN)、Ⅳ型胶原(Collagen type IV,Ⅳ-C)。
1.3 方法
按治疗方法不同分为对照组和干预组各40例,其中对照组给予保肝、维持水电解质平衡等常规治疗,干预组在常规治疗基础上予以肠内营养混悬液(TPF)500 mL/d(纽迪希亚制药有限公司生产)和双歧杆菌四联活菌片(杭州远大生物制药有限公司生产)4.5 g/d,于早、中、晚分三次口服。两组的治疗周期均为4周。在治疗前、治疗后4周分别抽取患者空腹静脉血,检测两组患者各项观察指标。
1.4 统计学方法

2 结果
2.1 肝功能指标对比
治疗前,两组的肝功能指标AST、ALT、TBiL和DBiL无明显统计学差异(P>0.05);治疗4周后,两组的AST、ALT、TBiL和DBiL水平均低于治疗前,且干预组低于对照组(P<0.05),见表2。
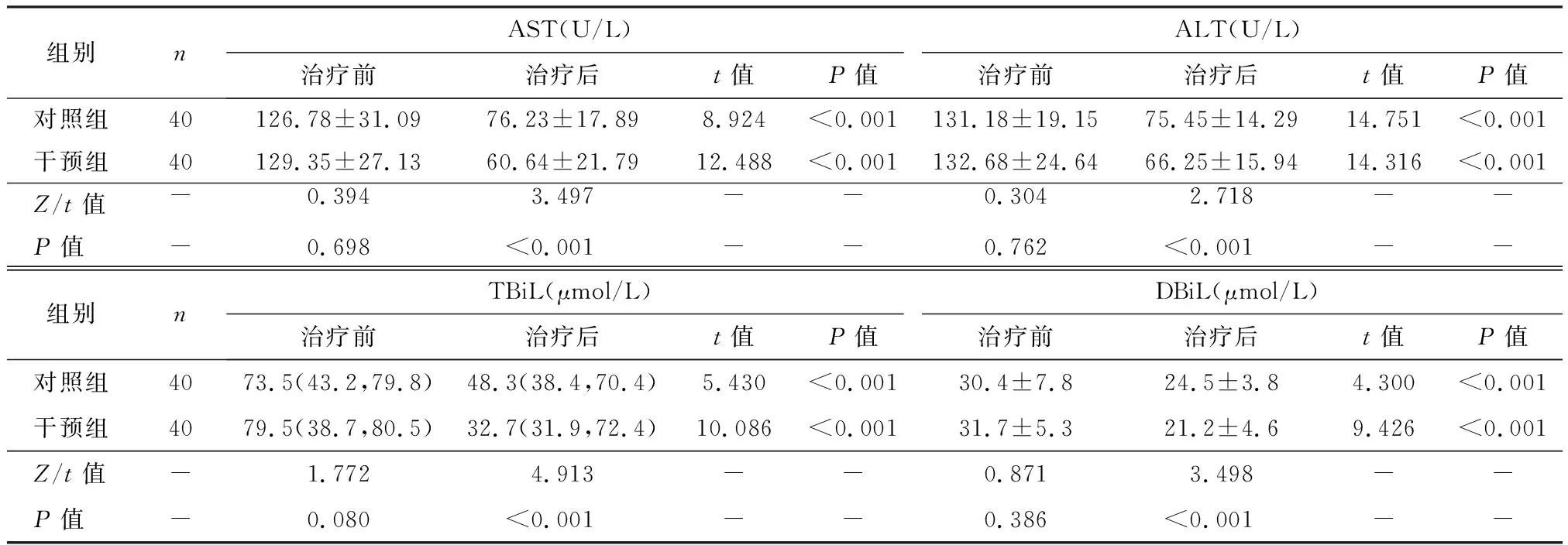
表2 两组肝功能治疗前后的比较
2.2 肝纤维化对比
两组治疗前HA、PC-Ⅲ、LN、Ⅳ-C比较,差异无统计学意义(P>0.05);治疗4周后,干预组HA、PC-Ⅲ、LN、Ⅳ-C水平低于对照组(P<0.05),见表3。
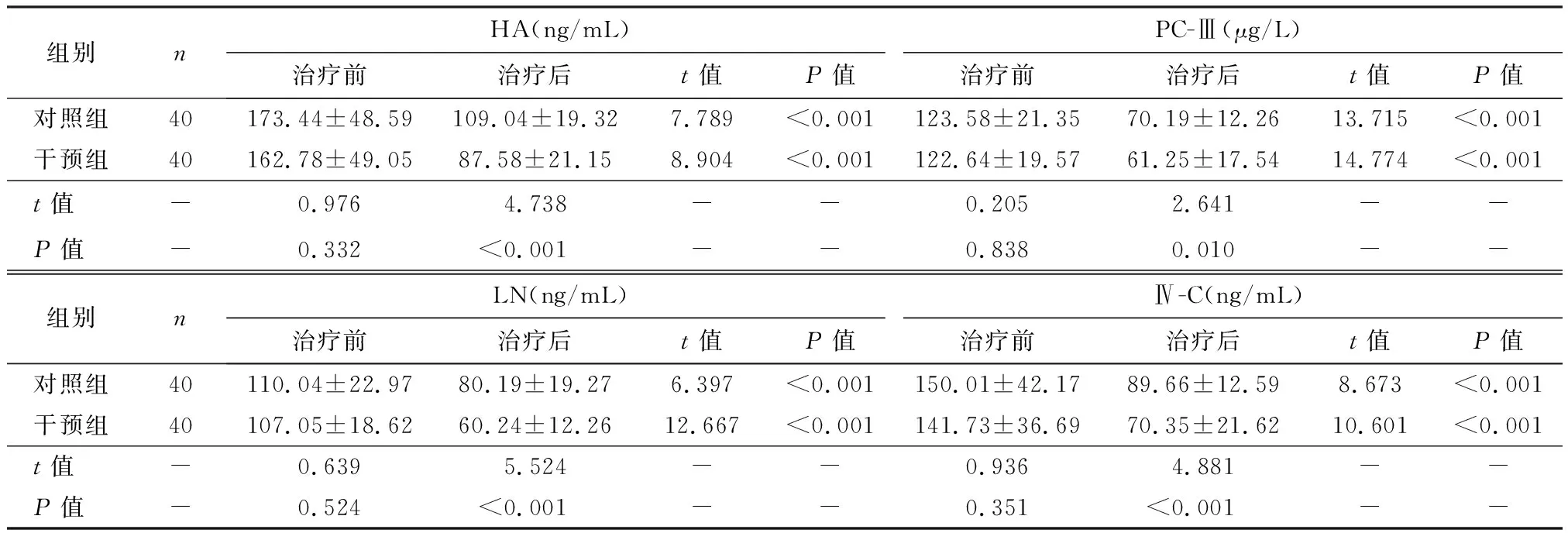
表3 两组治疗前后肝纤维化指标比较
2.3 营养指标对比
治疗前,两组血清TP、ALB和TF均无明显统计学差异(P>0.05);治疗4周后,两组TP、ALB和TF水平明显升高(P<0.05),同时与对照组相比,干预组血清TP、ALB和TF指标显著升高(P<0.05),见表4。

表4 两组治疗前后肝功能比较
2.4 凝血功能指标对比
治疗前,两组血清PT和APTT均无明显统计学差异(P>0.05);治疗4周后,两组血清PT和APTT较治疗前明显下降(P<0.05),同时与对照组相比,干预组血清PT和APTT指标显著降低(P<0.05),见表5。

表5 两组治疗前后凝血功能比较
2.5 炎症指标对比
治疗前,两组血清CRP、IL-6、TNF-α和IL-10均无明显统计学差异(P>0.05);治疗4周后,两组血清CRP、IL-6和TNF-α较治疗前明显降低,IL-10较治疗前升高(P<0.05),同时与对照组相比,干预组CRP、IL-6和TNF-α指标显著降低,IL-10显著升高(P<0.05),见表6。
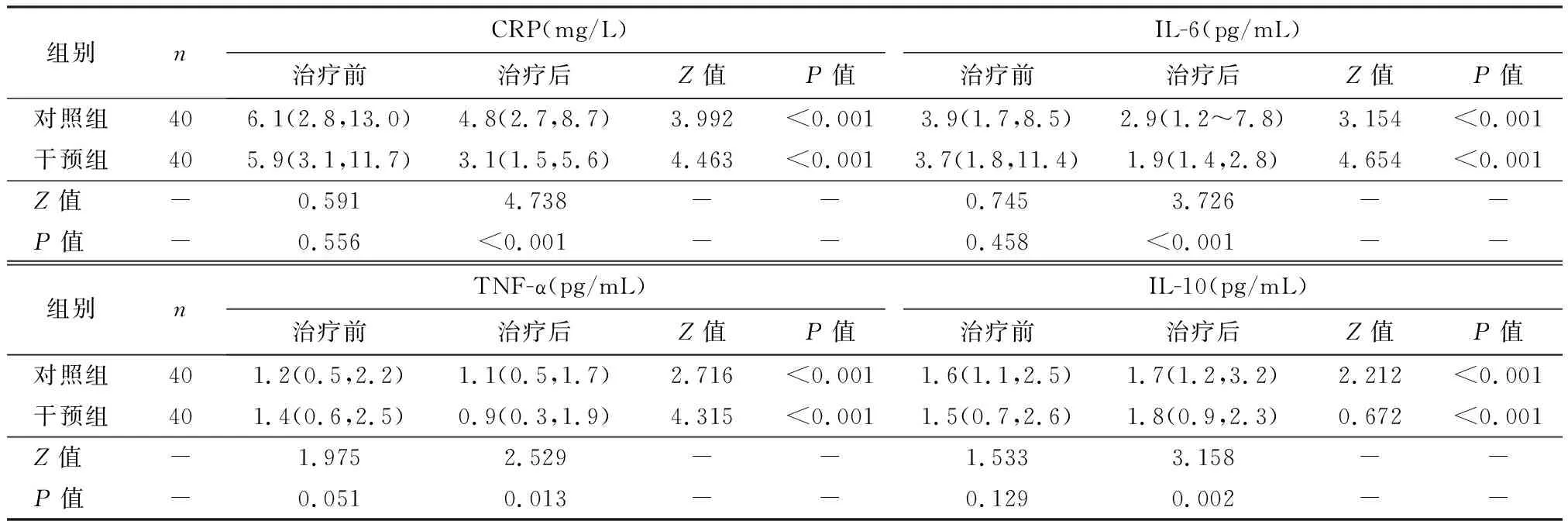
表6 两组治疗前后炎症指标比较
2.6 氧化应激指标对比
治疗前,两组血清SOD、GSH-Px、MDA均无明显统计学差异(P>0.05);治疗4周后,两组血清SOD、GSH-Px、MDA较治疗前有所改善(P<0.05),且干预组SOD、GSH-Px高于对照组,MDA低于对照组(P<0.05),见表7。
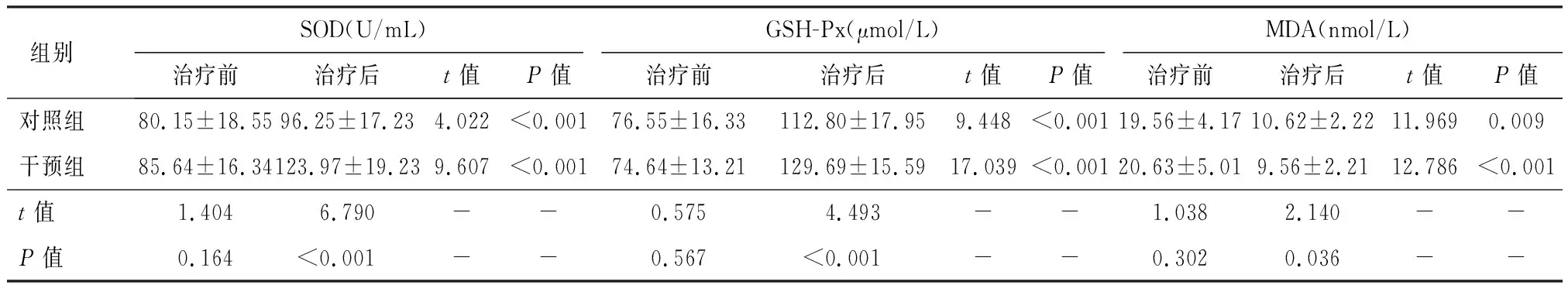
表7 两组治疗前后氧化应激指标比较
2.7 安全性
两组疗程中均未发生不良反应。
3 讨论
NAFLD是目前临床常见的一种慢性肝病,是指除外酒精和其他明确的损肝因素所致的肝细胞内脂肪过度沉积为主要特征的临床病理综合征,多发生于代谢异常的患者,如血脂异常、代谢综合征及糖尿病,常并发蛋白质能量营养不良[6]。随着人类生活水平的提高,NAFLD的发病率和死亡率呈逐年上升趋势,对人类健康构成了巨大的威胁,成为现代医学一项重大挑战[7]。有数据显示,非酒精性脂肪肝炎患者在3至4年内会发生肝纤维化,肝纤维化是对各种肝损伤的创伤愈合反应,其病理过程特征主要是以细胞外基质生成和降解失衡,造成大量细胞外基质在肝内沉积造成的[8-9]。迄今为止,临床指南表明饮食干预和生活方式的改变是治疗NAFLD的标准,尚无治疗NAFLD的特效药物,许多新药目前也只处于临床试验阶段,其安全性与有效性仍需进一步论证。在疾病进展过程中,患者存在极大消耗,易形成营养不良,因此加强营养支持治疗十分重要[10]。有相关研究指出,与单一基础护肝方案比较,联合营养治疗的方案可对NAFLD患者治疗发挥促进作用,可有效改善肝功能,抑制肝纤维化。肝纤维化标志物、肝功能相关指标联合检测对患者病情及预后评估具有重要参考意义[11]。现阶段,许多国家已经将营养治疗纳入为肝病的常规治疗,旨在改善患者营养状态,减少营养相关并发症的发生发展[12-13]。非酒精性脂肪肝病肝纤维化患者的营养支持治疗包括肠内营养及肠外营养两种方式,其中肠内营养是指经胃肠道提供代谢需要的营养物质及其他各种营养素的营养支持方式[14]。肠内营养有助于维持肠黏膜屏障作用,降低肠黏膜通透性,避免肠道细菌易位,抑制细菌的生长和肠道内毒素的吸收,从而极大地降低感染的发生率[15],长期的肠外营养易增加肝脏负担,并导致胃肠功能萎缩,不仅为细菌提供了有利的繁殖场所,同时肠道屏障功能受损,肠黏膜通透性增加,增加肠道细菌易位的可能,从而增加感染并发症发生率[16]。肠内营养混悬液(TPF)是一种以整蛋白为基础的肠内营养制剂,其营养素全面,容易消化,生物利用度高,同时能调整患者肠道菌群,增强患者免疫力[17]。
益生菌是一类对宿主有益的活性微生物,能产生有益的功效从而改善宿主微生态平衡、发挥肠道有益作用的活性微生物的总称[18]。研究表明,益生菌可通过调节肠道菌群来改善肠道屏障功能、调节肠道通透性,有利于调节患者免疫功能,减轻炎症和降低氧化应激等[19-20]。由于NAFLD患者存在肠道菌群失调,因此益生菌应用于NAFLD的临床治疗中,成为了目前新的研究热点[21]。因此,本研究对肠内营养支持联合肠道益生菌治疗NAFLD进行分析,以研究非酒精性脂肪肝硬化患者最佳的治疗方案。
本研究结果显示,干预组肠内营养联合肠道益生菌治疗方案可提高临床疗效,在促进非酒精性肝病肝纤维化患者肝功能恢复,逆转纤维化方面均有积极作用,可有效控制病情[22]。对照组与干预组相比,干预组营养指标改善情况均优于对照组,这与联合疗法降低患者蛋白质分解,促进肝脏蛋白质合成,同时恢复了肠道屏障功能,促进肠内营养的吸收,进而改善患者营养状态[23-24]。研究结果显示,干预组联合治疗后,改善了凝血功能。
NAFLD作为一种复杂的疾病,其发病机制尚不明确,研究表明该疾病可能与代谢异常、氧化应激、炎症反应等多种因素密切相关[25]。故在上述结论基础上,本研究围绕氧化应激及炎症因子作进一步分析,以综合评估益生菌联合营养干预的治疗效果及相关机制。血清TNF-α可通过诱导炎性因子分泌同时参与炎症反应进程,进而促进机体炎性损伤;IL-6、IL-10作为肝脏病变的重要炎症因子,IL-6升高可加快机体炎症反应的发生,进而加重病情;IL-10水平的升高可抑制机体炎症反应,同时具有抗纤维化作用,从而减轻肝脏损伤[25-26]。本研究结果显示,治疗4周后两组患者的炎症指标都得到改善,但干预组的炎症指标改善程度明显优于对照组。MDA是评估氧化损伤的重要血清学指标之一,其细胞毒性较强,可改变细胞膜通透性,影响酶活性及线粒体代谢;而SOD、GSH-Px具有保护细胞结构及功能作用,其中SOD属生物活性酶,还可抑制超氧阴离子毒性[27-28]。非酒精性肝病肝纤维化患者血清SOD、GSH-Px、MDA均处于异常表达状态,可使自由基生成、清除失衡,进而造成肝细胞抗氧化能力降低,加剧肝损伤[29]。本研究结果显示,治疗4周后,干预组血清SOD、GSH-Px、MDA水平均优于对照组(P<0.05),可见联合疗法可有效减轻氧化应激反应。
综上所述,肠内营养联合肠道益生菌是治疗非酒精性肝病肝纤维化的理想方案,可改善肝功能,减轻营养障碍,改善凝血功能,抑制炎症反应,同时抑制氧化应激,进而逆转肝纤维化,值得临床参考应用。

