卡介苗诱导巨噬细胞训练免疫中的糖代谢重编程研究进展
刘昀彤,丁茹,梁舒,马小惠,邓斐尔,宋田田,闫东梅
(吉林大学基础医学院 免疫学系,长春 130000)
随着免疫细胞在活化和分化期间的代谢重编程过程被发现,“免疫代谢”这一概念被提了出来。糖代谢重编程通过多种机制调控免疫细胞的活化和功能,包括糖酵解关键酶的非代谢功能、代谢中间产物调控表观遗传修饰和信号传导等。增强的糖酵解和谷氨酰胺驱动的三羧酸(tricarboxylic acid, TCA)循环已被证明是卡介苗(bacillus Calmette-Guérin vaccine,BCG)诱导训练免疫的重要途径,但这一过程在单核巨噬细胞系统训练免疫中的具体机制尚不清楚。
1 BCG诱导单核巨噬细胞系统发生训练免疫
1.1 训练免疫一直以来,先天免疫系统被认为没有免疫记忆。然而,Netea等[1]基于BCG、β-葡聚糖等诱导先天免疫发挥非特异性保护作用的研究发现,哺乳动物也存在先天免疫记忆,并将其称为“训练免疫”,即先天免疫细胞在第1次接触病原体时被训练,当它们再次接受同一种或不同病原刺激时宿主表现出更高的反应性和更强的抵抗力。训练免疫不针对特定病原体,而是主要依赖于表观遗传修饰介导的先天免疫细胞功能的长期激活,但这种状态并不能永久维持[2]。
1.2 BCG通过训练单核巨噬细胞系统发挥非特异性保护作用BCG是唯一被证明对结核病有效的疫苗,自1970年以来,BCG免疫疗法成为了治疗非肌肉浸润性膀胱癌的“黄金标准”[3]。大量临床随机试验发现,BCG可以抵抗其他病原体的感染[4],比如对人类皮肤利什曼病和疟疾的非特异性作用[5]。流行病学统计资料显示,接种BCG可降低由非结核分枝杆菌引起的感染和死亡。来自小鼠的实验研究表明,BCG可以抵抗各种DNA和RNA病毒感染[6]。最近发现,BCG依靠训练免疫清除结核分枝杆菌[7],而其发挥的非特异性保护作用也是由单核巨噬细胞系统产生的训练免疫所介导[8]。
接种BCG可改变人单核细胞的功能状态,表现为二次刺激后表面活化标志和细胞因子的上调,并证明发生在组蛋白的修饰是在转录水平对相关基因表达进行了长期调控。同时小鼠实验表明,BCG诱导的非特异性保护不依赖于T细胞和B细胞[9]。相关研究检测了BCG诱导的体外人单核细胞全基因组的一项组蛋白修饰标记,发现除了炎症相关基因,包括磷脂酰肌醇3-激酶/蛋白激酶B(phosphatidylinositol 3-kinase/serine threonine kinase,PI3K/Akt)信号通路在内的多种信号通路的相关基因在表观遗传学水平被上调,这与β-葡聚糖诱导的训练免疫相似[10]。
1.2.1 单核巨噬细胞系统与免疫代谢 目前认为巨噬细胞在极化的过程中有2个极端:M1型经典途径和M2型替代途径,前者通常分泌炎性分子并发挥杀灭病原微生物和抗肿瘤的功能,后者则主要发挥抑炎作用,促进损伤组织修复和纤维化以及肿瘤发展等病理过程[11]。随着免疫细胞在活化和分化期间代谢重编程过程被发现,研究者提出了“免疫代谢”这一概念。研究表明,M1型巨噬细胞表现为糖酵解增强和乳酸产生增加,而M2型巨噬细胞似乎依赖于氧化磷酸化、脂肪酸摄取和β-氧化[12]。
1.2.2 单核巨噬细胞系统的训练机制 先天免疫细胞依靠表达多种模式识别受体(pattern recognition receptor,PRR)及其组合将刺激信号传入后,通过不同信号通路介入表观遗传机制,调节相关基因的转录过程,继而促进促炎细胞因子的生成,形成先天免疫记忆[13-14],其中代谢相关信号通路以及代谢相关酶的基因在转录水平的上调也是组蛋白表观遗传修饰的结果,这种免疫和代谢系统的长期训练起始于造血干细胞等前体细胞[15]。另外,某些代谢产物可以调节表观遗传酶的活性从而影响训练免疫[16],因而代谢重编程与表观遗传修饰的相互作用是介导训练免疫的重要分子机制。表观遗传是指在一级结构不发生改变的情况下,DNA甲基化、组蛋白共价修饰、染色质重塑、非编码RNA调控等修饰作用导致的生物性状产生可遗传变异。通过各种表观遗传修饰的相互作用可促进转录因子、RNA聚合酶Ⅱ的招募,从而介导了训练免疫中二次刺激后的快速转录,而转录因子也反过来募集组蛋白修饰酶和染色质重塑因子[2]。目前人们认为,表观遗传学、转录组学和代谢重编程共同介导训练免疫[14]。
2 糖代谢重编程和训练免疫
Penkov等[17]认为细胞代谢的变化可能遵从低等动物到哺乳动物的先天免疫记忆的祖传原则。最近的研究表明,增强的糖酵解及由谷氨酰胺驱动的TCA循环已被证明是BCG和β-葡聚糖诱导训练免疫的重要代谢途径[18-20]。
2.1 糖酵解正常哺乳动物细胞在有氧条件下,以葡萄糖氧化磷酸化途径代谢产能;在缺氧条件下,分解葡萄糖生成的丙酮酸无法进入TCA循环,而是转化为乳酸,产能效率远低于前者[21]。1927年,德国生化学家Warburg[22]发现,在氧气充足的条件下,恶性肿瘤细胞糖酵解同样活跃,这种有氧糖酵解的代谢现象称为Warburg效应。1970年,有学者发现LPS诱导M1型巨噬细胞也依赖于Warburg效应[23]。
糖酵解中乳酸生成增多是训练免疫代谢的核心标志之一[24]。BCG刺激单核细胞24 h后,乳酸生成量和葡萄糖消耗量均增加,且二者比值接近2,表明葡萄糖是乳酸的主要来源[19],BCG诱导的单核细胞糖酵解和氧化磷酸化均增强,而不同的是,β-葡聚糖的作用结果被认证是经典的Warburg效应,即糖酵解增强而氧化磷酸化减弱[18]。
BCG诱导的训练免疫依赖于Akt-mTOR途径的糖代谢重编程,抑制这一信号通路或糖酵解限速酶以阻止糖代谢重编程都会逆转训练免疫的训练效果,而在β-葡聚糖诱导的训练模型中,表观遗传抑制剂也会抑制乳酸的产生[18]。这进一步说明代谢重编程与表观遗传学是相互依赖的关系。糖酵解的核心地位还体现在限速酶在转录和表观遗传水平均上调,且通过对接种BCG的健康人外周血单核细胞中糖酵解限速酶的单核苷酸多态性位点分析,发现其显著影响志愿者的训练免疫[19]。
2.1.1 糖酵解酶在单核巨噬细胞系统中发挥非代谢作用 大量研究表示,增强的糖酵解除了提供能量和中间代谢产物,还能影响巨噬细胞的功能[25](表1)。如丙酮酸激酶M2(pyruvate kinase M2, PKM2)二聚体可以易位至细胞核稳定低氧诱导因子1α(hypoxia inducible factor 1α,HIF1-α),从而调节HIF1-α靶基因的转录过程。维持PKM2的高活性四聚体形式,将逆转LPS的作用[26]。但糖酵解酶在训练免疫中是否发挥非代谢作用尚待研究。

表1 糖酵解相关酶对巨噬细胞功能的影响
2.1.2 诱导Warburg效应的信号通路 研究证明,在BCG和β-葡聚糖诱导的训练免疫中,Akt和哺乳动物雷帕霉素靶蛋白(mammalian target of rapamycin, mTOR)组成的信号通路介导的高糖酵解速率具有关键的作用[19],多种抑制剂对Akt/mTOR和糖酵解通量的抑制都削弱了单核细胞训练效果。敲除HIF1-α的小鼠完全失去了β-葡聚糖训练免疫,这证明HIF1-α介导的糖酵解对在体内诱导的训练免疫是至关重要的[18]。
mTOR作为代谢环境的传感器[36],通过诱导下游HIF1-α、c-Myc(一种原癌基因)调节氧化磷酸化向糖酵解转变,且直接调节磷酸戊糖途径(pentose phosphate pathway,PPP)中酶的表达。上游信号传入时,HIF由α和β亚基组成异二聚体,HIF-α/β复合物易位至细胞核,与含有缺氧反应元件(hypoxia response element,HRE)靶基因的启动子结合,从而启动一系列糖代谢和免疫相关基因的表达[37]。
HIF信号转导主要受α亚基稳定性的调节,在静息细胞中,HIF1-α被脯氨酰羟化酶(prolyl hydroxylase,PHD)羟基化而降解。缺氧诱导因子抑制因子(factor inhibiting HIF,FIH)通过羟基化阻断其形成有效的转录复合物。PHD和FIH都需要O2和α-酮戊二酸(α-ketoglutaric acid,α-KG)作为底物和辅助因子。缺氧会抑制PHD而使HIF1-α积累,肿瘤细胞中原癌基因的突变等也会导致HIF1-α积累[38]。在LPS激活的巨噬细胞中,HIF1-α的稳定性是由代谢中间体调节的,PHD活性依赖于α-KG,而富马酸盐和琥珀酸通过抑制PHD而使HIF稳定表达[36],线粒体产生的活性氧(reactive oxygen species,ROS)也可以上调HIF1-α的表达[38]。
2.2 磷酸戊糖途径研究表明,糖酵解代谢的上调不仅为促炎型巨噬细胞提供ATP,而且还增强PPP。PPP通过产生氨基酸、核苷酸和还原型烟酰胺腺嘌呤二核苷酸磷酸(reduced nicotinamide adenine dinucleotide phosphate,NADPH)来支持炎症反应[25]。NADPH用于生产还原型谷胱甘肽以控制M1型巨噬细胞的氧化应激水平[39]。BCG刺激24 h后,核糖类物质有所增加,说明BCG也诱导磷酸戊糖途径的增强。β-葡聚糖诱导的PPP增强并不返回到糖酵解,6-氨基烟酰胺抑制PPP也并不会影响训练后细胞因子的增加,这表明PPP在β-葡聚糖诱导的训练免疫中的必要性远不如糖酵解[19-24]。
2.3 TCA循环BCG训练的单核细胞中谷氨酸和苹果酸浓度升高,而富马酸和乙酰辅酶A无变化,提示增强的谷氨酰胺代谢提高了TCA循环的通量,而抑制谷氨酰胺代谢会减弱BCG和β-葡聚糖诱导的训练免疫[19-24],这似乎解释了氧化磷酸化为何增强的原因。苹果酸可以生成丙酮酸从而增加乳酸的产量,但已知乳酸的唯一来源是葡萄糖,所以谷氨酰胺代谢似乎并没有参与到糖酵解中。另外,在抑制电子传递链复合物Ⅴ时,未观察到明显影响,而当通过二氯乙酸使丙酮酸流入TCA循环时,训练的免疫力减弱。这表明,氧化磷酸化在BCG诱导的训练免疫中可能只与生物合成有关[19]。
LPS诱导的M1型巨噬细胞表现为柠檬酸盐和琥珀酸的积累[25]。柠檬酸盐被证明是一种炎症信号,其积累会产生3种重要的促炎介质:NO、ROS和前列腺素。有研究发现,长期活化的单核细胞在低糖环境下会促进柠檬酸外排来维持PPP提供不足的NADPH(图1),这一过程伴随着苹果酸的耗竭及柠檬酸转变为谷氨酸进入谷氨酰胺代谢的过程[40],这能否解释BCG诱导谷氨酸和苹果酸积累而乙酰辅酶A没有大量产生,还需要进一步研究。另外,BCG诱导细胞中ROS增多,而β-葡聚糖训练后ROS却减少,这是否暗示BCG相对β-葡聚糖的训练有更强的抗感染潜力也有待验证[41]。
β-葡聚糖也诱导谷氨酰胺代谢驱动TCA循环,实验证明谷氨酰胺代谢增加2-羟基戊二酸(2-hydroxyglutaric acid,2-HG)、琥珀酸、富马酸和苹果酸的积累量,不参与丙酮酸和乳酸的生成,其中富马酸被发现可以通过拮抗作用抑制组蛋白去甲基化从而诱导与β-葡聚糖诱导的训练免疫相类似的表观遗传修饰[20]。包括琥珀酸、2-HG、α-KG、富马酸、乳酸、烟酰胺腺嘌呤二核苷酸(nicotinamide adenine dinucleotide,NAD)、乙酰辅酶A在内的糖代谢中间产物均被发现可以调控表观遗传修饰,其中α-KG是去甲基化酶的辅助因子,富马酸、琥珀酸、2-HG作为α-KG的拮抗剂则促进组蛋白甲基化,而乙酰辅酶A和NAD分别是组蛋白乙酰化转移酶和组蛋白脱乙酰酶的辅助因子[42],这表明代谢物可以通过表观遗传机制影响训练免疫的状态。
3 BCG在临床治疗中的前景
训练免疫可增强免疫功能从而治疗疾病,如纠正肿瘤、各种病原感染和败血症中的免疫麻痹,但也可以促进一些慢性代谢性炎症疾病的持续发展。如DM患者持续的高血糖状态可以训练巨噬细胞产生免疫记忆,继而可能促进动脉粥样硬化斑块的发展。
然而BCG诱导的训练免疫却对DM患者有长远的治疗效果。最近报道的Ⅰ期随机临床试验发现,接受至少2次BCG接种的1型DM患者在大约3年后血糖恢复正常水平,其治疗效果可持续5年以上。1型DM患者中高度活跃的氧化磷酸化导致葡萄糖利用不足,BCG通过激活有氧糖酵解,增加外周血细胞的葡萄糖消耗从而降低血糖,这种降血糖方式有效规避了胰岛素带来的低血糖风险。BCG的治疗机制也可能部分依赖于TNF的表观遗传激活Treg和选择性诱导攻击胰岛细胞的CTL死亡,从而改善自身免疫状态[43]。此外,BCG可以降低小鼠血浆胆固醇水平并延缓动脉粥样硬化的进程[44]。
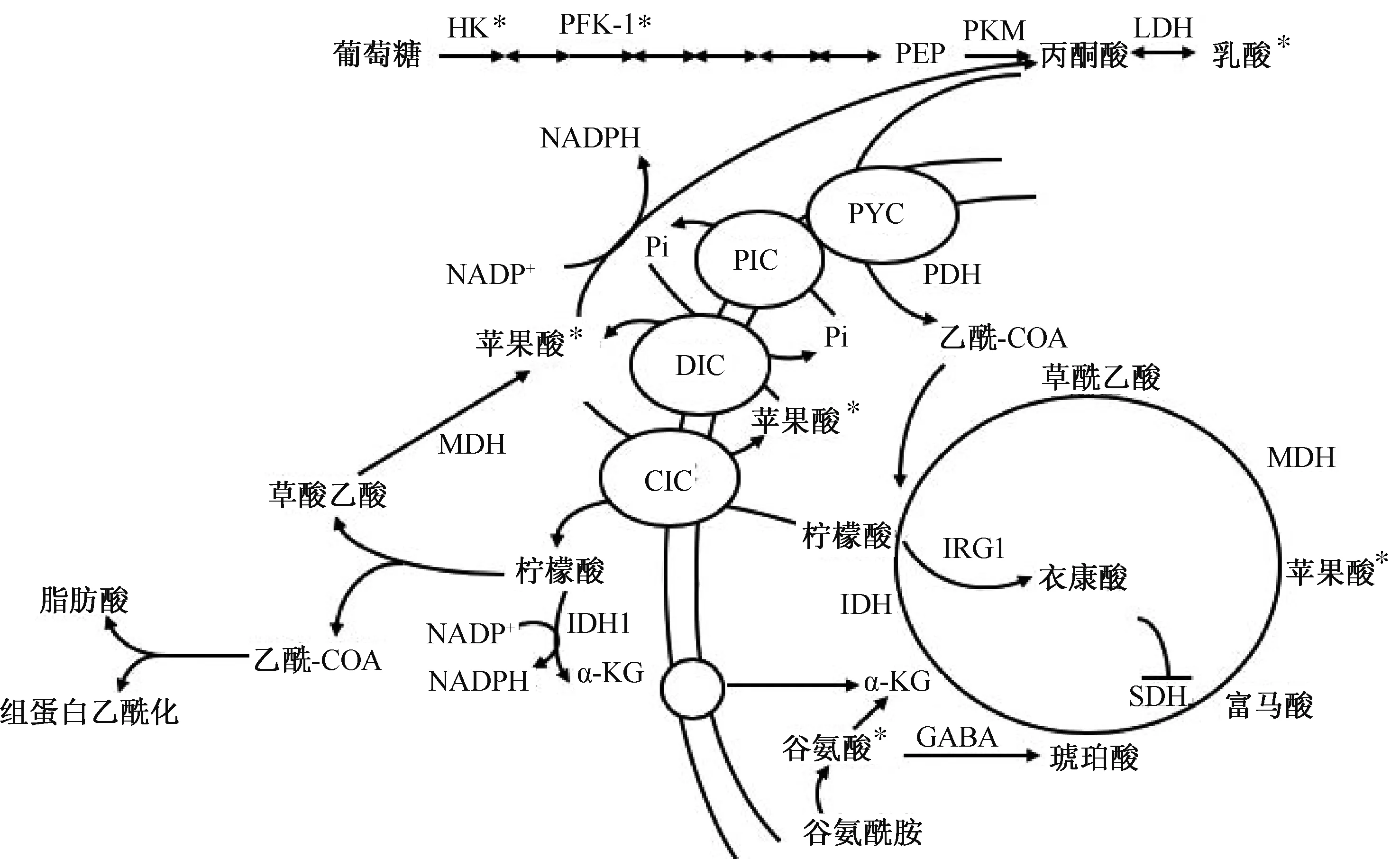
注:PFK-1,6-磷酸果糖激酶 1(phosphofructokinase 1);PEP,磷酸烯醇式丙酮酸(phosphoenolpyruvate);LDH,乳酸盐脱氢酶(lactic dehydrogenase);NADP,烟酰胺腺嘌呤二核苷酸磷酸(nicotinamide adenine dinucleotide phosphate);PYC,丙酮酸载体(pyruvic acid carrier);PDH,丙酮酸脱氢酶(pyruvate dehydrogenase);DIC,二羧酸盐载体(dicarboxylate carrier);CIC,柠檬酸载体(citric acid carrier);IDH,异柠檬酸脱氢酶(isocitrate dehydrogenase);MDH,苹果酸脱氢酶(malate dehydrogenase);SDH,琥珀酸脱氢酶(succinate dehydrogenase);IRG1,免疫应答基因1(immune-responsive gene 1);*标注的是BCG诱导后上调的代谢物。图1 BCG在巨噬细胞中参与糖代谢途径示意
BCG诱导的训练免疫和糖代谢重编程对各种病原感染、肿瘤、败血症和一些慢性代谢性炎症疾病表现出有益的作用。那么如何利用代谢组学技术和表观遗传学技术寻找治疗慢性炎症疾病的新靶点,如何最大化利用疫苗或其他刺激物诱导训练免疫发挥非特异性保护作用将是未来的研究方向之一。

