胃癌开腹手术与腹腔镜手术的腹腔灌洗结果分析※
武 明
(山西省运城市中心医院,山西 运城044000)
胃癌发病率在恶性肿瘤中位居第5位,死亡率位居第3位,主要表现为食欲缺乏、消瘦乏力、上腹疼痛等,针对体内癌细胞尚未肆意转移或扩散的患者临床多行胃癌根治术治疗,以延长患者生存期[1]。开腹手术能在直视下彻底切除病灶,改善患者病情,但创伤较大且患者应激反应强,不利于术后早期恢复[2]。腹腔镜手术能弥补开腹手术的不足,具有创伤小、出血少、恢复快等优点,逐渐应用于临床。本研究分析胃癌开腹手术与腹腔镜手术治疗效果。现报道如下。
1 临床资料
1.1 一般资料 选择2018年1月至2020年3月运城市中心医院接诊的胃癌患者84例,按照随机数字表法分为对照组和研究组,每组42例。对照组男21例,女21例;年龄40~72岁,平均(54.15±3.20)岁;TNM分期:Ⅰ期4例,Ⅱ期15例,Ⅲ期23例。研究组男24例,女18例;年龄41~75岁,平均(54.21±3.22)岁;TNM 分期:Ⅰ期3例,Ⅱ期13例,Ⅲ期26例。两组患者一般资料比较,差异无统计学意义(P>0.05),具有可比性。
1.2 纳入标准 术前病理确诊并拟行手术,TNM分期为Ⅰ~Ⅲ期;年龄18~80岁;签署知情同意书。
1.3 排除标准 严重器官功能损害者;既往有严重脑血管疾病史。
2 治疗方法
2.1 研究组 行腹腔镜手术。气管插管全麻后患者取仰卧位,在脐孔下缘穿刺,置入12 mm Trocar与腹腔镜,创建气腹,气腹压约为13 mm Hg(1 mm Hg≈0.133 kPa)。在左侧腋前线肋缘下穿刺,置入12 mm Trocar、超声刀,作为主操作孔,分别穿刺脐左侧5 cm偏上处、右侧腋前线肋缘下方、脐与右侧锁骨中线平行偏上方,置入5 mm Trocar。腹腔镜下观察肿瘤种植、转移等情况,沿横结肠边缘用超声刀切断大网膜、胃结肠韧带,解剖胃网膜右动静脉,并切断其根部。清扫第6组淋巴结。向上提起胃,超声刀置入胃后间隙,沿胃、十二指肠动脉游离肝固有动脉与总动脉,清除第12a组淋巴结。解剖、离断胃右血管,清扫第5组淋巴结。十二指肠球部至幽门下3 cm,用超声刀沿胰腺上缘解剖肝中动脉、脾动脉、胃左动脉。清扫第7、8、9、11组淋巴结。离断胃左动静脉根部,挑起肝左外叶,使肝胃韧带彻底显露,沿肝缘切断肝胃韧带,游离胃小弯,清扫第3组淋巴结。解剖胃网膜左动静脉,并将其根部离断,清扫第4组淋巴结。于脾门处切断脾胃韧带,离断胃短动脉,向上解剖游离胃底。离断膈胃韧带,将膈肌腹膜返折处切开,清扫第1、2组淋巴结。食管下段游离至距贲门口上缘约5 cm,离断食管两侧迷走神经干,在幽门下2 cm用一次性直线切割闭合器将十二指肠切断、闭合。停止气腹,在上腹正中做一切口,长约7 cm,肿瘤上缘5 cm处切断食管,空肠上段在距屈氏韧带20 cm离断。完成后实施食管、空肠端侧吻合,以荷包缝合法闭合空肠远侧断端,彻底止血后,关闭切口。
2.2 对照组 行开腹手术。在上腹正中做1个约23 cm右绕脐切口,麻醉、取位、淋巴结清扫程度、切除范围同研究组。
3 疗效观察
3.1 观察指标 ①围术期指标。比较两组患者切口长度、手术用时、淋巴结清扫数量、术中失血量、术后住院时间等。②脱落细胞学检查:包括多巴胺脱酸酶(DDC)和癌胚抗原(CEA)。手术开始时即刻行腹腔脱落细胞学检查,对于腹腔积液≥200 m L者可于盆底直接收集腹腔积液行脱落细胞学检查;对于无腹腔积液或腹腔积液<200 m L者,则以500 m L温生理盐水依次冲洗双侧膈顶、肝下、双侧结肠旁沟、大网膜和盆底行腹腔灌洗(应尽量避免直接冲洗原发病灶),然后于双侧膈下区、肝下和盆底收集灌洗液(≥100 m L),行细胞学检查。手术结束关腹前收集术野灌洗液行脱落细胞学检查。③并发症发生情况。比较两组患者术后切口感染、肺部感染等发生情况。
3.2 统计学方法 采用SPSS 21.0统计软件分析数据。计数资料以例(%)表示,采用χ2检验;计量资料以均数±标准差(±s)表示,采用t检验。P<0.05为差异具有统计学意义。
3.3 结果
(1)围术期指标比较 研究组切口长度、术后住院时间短于对照组(P<0.05),术中失血量低于对照组(P<0.05);两组患者手术用时、淋巴结清扫数量比较,差异无统计学意义(P>0.05)。见表1。
表1 两组胃癌患者围术期指标比较(±s)
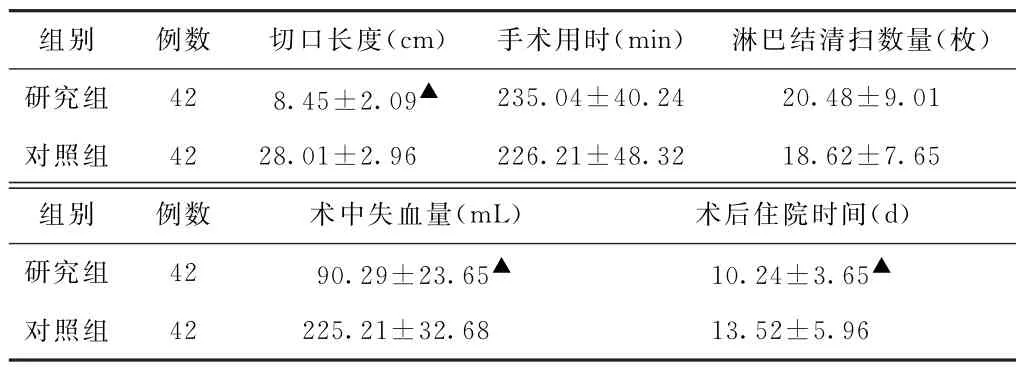
表1 两组胃癌患者围术期指标比较(±s)
注:与对照组比较,▲P<0.05。
组别 例数 切口长度(cm) 手术用时(min) 淋巴结清扫数量(枚)研究组 42 8.45±2.09▲ 235.04±40.24 20.48±9.01对照组 42 28.01±2.96 226.21±48.32 18.62±7.65组别 例数 术中失血量(mL) 术后住院时间(d)研究组 42 90.29±23.65▲ 10.24±3.65▲对照组 42 225.21±32.68 13.52±5.96
(2)脱落细胞学比较 术前,两组患者DDC、CEA含量比较,差异无统计学意义(P>0.05),术后两组患者DDC、CEA含量升高(P<0.05),但研究组低于对照组(P<0.05)。见表2。
表2 两组胃癌患者多巴胺脱酸酶、癌胚抗原含量比较(ng/mL,±s)
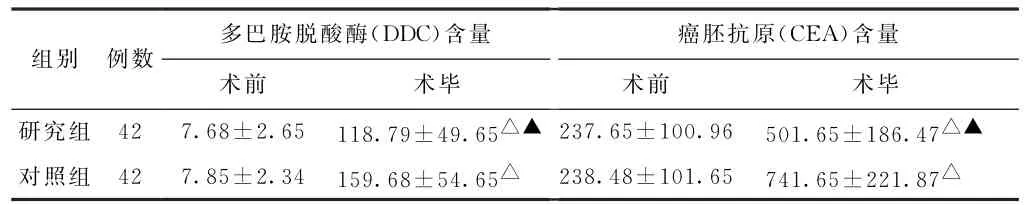
表2 两组胃癌患者多巴胺脱酸酶、癌胚抗原含量比较(ng/mL,±s)
注:与本组术前比较,△P<0.05;与对照组术毕比较,▲P<0.05。
组别 例数癌胚抗原(CEA)含量术前 术毕研究组 42 7.68±2.65 118.79±49.65△▲ 237.65±100.96 501.65±186.47△▲对照组 42 7.85±2.34 159.68±54.65△ 238.48±101.65 741.65±221.87△多巴胺脱酸酶(DDC)含量术前 术毕
(3)并发症发生情况比较 研究组术后并发症发生率为16.67%(7/42),其中肺部感染3例,吻合口瘘1例,切口感染1例,肠梗阻2例;对照组术后并发症发生率为11.90%(5/42),其中切口感染1例,肺部感染3例,肠梗阻1例。两组患者并发症发生率比较,差异无统计学意义(P>0.05)。
4 讨论
胃癌发病与吸烟、饮酒、遗传、幽门螺杆菌感染等因素有关,可导致患者出现黑便、腹痛和不同程度食欲减退等症状,发病率与死亡率较高[3]。手术是临床治疗胃癌的主要手段,其中开腹胃癌根治术较为常见,可清晰观察病灶大小和胃组织病变情况,彻底清除病灶和淋巴结,改善病情[4-5]。但开腹手术切口较长,对腹部损伤较大,患者失血量多,不利于早期恢复,且会延长住院时间。
术中脱落的游离癌细胞或术后腹腔内可能残留的微小病灶可着床于腹膜上,是胃癌术后复发或转移的病理基础[6]。DDC、CEA属于肿瘤敏感标志物,与胃癌发生、发展关系密切。本研究中,研究组切口长度、术后住院时间短于对照组,术中失血量、DDC、CEA水平低于对照组,两组患者手术用时、淋巴结清扫数量、术后并发症发生率比较无明显差异,提示腹腔镜手术治疗胃癌可达到与开腹手术相似的治疗效果,安全性相当,但腹腔镜手术可降低术后发生微转移率,加快术后恢复进程。在肿瘤离断前,腹腔镜手术能避免切口与切除组织接触,降低肿瘤细胞增殖转移风险[7-8]。术中超声刀操作能避免或减少对肿瘤及其周围组织的刺激,超声刀对淋巴管、血管具有凝闭作用,可降低出血与淋巴渗漏,减少肿瘤转移与远处种植的发生[9]。腹腔镜手术清扫淋巴结是在封闭腹腔内完成,能避免或大幅度减少腹腔脏器暴露时间,减少体液丢失,维持腹腔内环境的稳定。此外,腹腔镜手术仅需在腹部穿刺几个5~10 mm的切口便可实施操作,经透光试验,手术入路可以避开血管区域,减少腹壁组织损伤,同时腹腔镜具有放大功能,能清晰显示局部解剖结构,利于术者精细操作,减少手术对机体造成的创伤和术中失血量,减轻术后疼痛程度,缩短术后恢复进程。
综上所述,腹腔镜手术与开腹手术治疗胃癌效果、安全性相当,但腹腔镜手术能减小手术创伤,缩短住院时间,降低术后发生微转移率,值得临床推广。

