一测多评法同时测定复明片中7种成分的含量
姚建华,赵博,王婧宁,赵志国,黄群*
1.辽宁中医药大学 附属医院,辽宁 沈阳 110032;2.辽宁大熊制药有限公司 研究所,辽宁 本溪 117004
复明片由酒萸肉、车前子、决明子、枸杞子、地黄等24味中药加工而成,临床上主要用于肝肾阴虚所致的羞明畏光、视物模糊,青光眼初、中期白内障见上述证候的治疗[1]。现代研究表明,复明片改善初发期老年性白内障患者[2]、糖尿病视网膜病变患者[3]的视力水平,治疗玻璃体混浊[4]、原发性开角型青光眼视功能[5-6],改善中晚期青光眼术后眼底血液循环,提高视力[7]等临床效果明显。中药及其制剂具有多组分、多靶点、整体调节的特点,单一组分控制模式难以全面评价其产品的内在质量,多指标控制模式近年来已逐步应用于中药及其制剂的质量评价中。复明片现收载于《中华人民共和国药典》(以下简称《中国药典》)2015年版一部,现行标准和文献报道中仅对复明片所含单一成分进行定量控制,尚未建立复明片多组分质量控制模式[8]。本实验首次采用HPLC同时测定复明片中活性成分红镰霉素-6-O-β-龙胆二糖苷、大车前苷、莫诺苷、决明子苷、马钱苷、山茱萸新苷和橙黄决明素-6-O-葡萄糖苷含量,建立复明片多组分质量控制模式,同时以莫诺苷为内参物,建立其与其他6种成分的相对校正因子,实现一测多评法(QAMS)对复明片中7种活性成分含量的同时测定,有效地解决了传统多指标成分控制模式部分对照品不易得、价格昂贵、检验成本过高的不足,为进一步完善复明片的质量标准和全面反映复明片的产品质量提供支持。
1 仪器与试药
1.1 仪器
1100型高效液相色谱仪(美国Agilent公司);Prominence型高效液相色谱仪(日本Shimadzu公司);AB265-S型电子天平(瑞士Mettler-Toledo仪器有限公司)。
1.2 试药
莫诺苷对照品(批号:111998-201703,CAS号:25406-64-8,纯度:97.4%)、马钱苷对照品(批号:111640-201808,CAS号:18524-94-2,纯度:99.0%)、大车前苷对照品(批号:111914-201604,CAS号:104777-68-6,纯度:90.2%)均来源于中国食品药品检定研究院;红镰霉素-6-O-β-龙胆二糖苷对照品(批号:CFS201701,CAS号:24577-90-0,纯度:98.0%)、决明子苷对照品(批号:CFS201702,CAS号:123914-49-8,纯度:98.0%)均来源于武汉天植生物技术有限公司;橙黄决明素-6-O-葡萄糖苷对照品(批号:PRF8062622,CAS号:129025-96-3,纯度:99.5%)、山茱萸新苷对照品(批号:14082202,CAS号:131189-57-6,纯度:97.8%)均来源于成都普思生物科技股份有限公司;乙腈为色谱纯;其余试剂均为分析纯。
复明片(规格:0.31 g/片,批号分别为PC218110591、PC219030101、PC219040171)来源于于西安碑林药业股份有限公司。
2 方法与结果
2.1 溶液的制备
2.1.1对照品储备液 分别精密称取7种待测目标成分对照品适量,用60%甲醇溶液制成红镰霉素-6-O-β-龙胆二糖苷1.052 mg·mL-1、大车前苷0.176 mg·mL-1、莫诺苷1.126 mg·mL-1、决明子苷0.754 mg·mL-1、马钱苷0.572 mg·mL-1、山茱萸新苷0.126 mg·mL-1、橙黄决明素-6-O-葡萄糖苷0.438 mg·mL-1的7种对照品储备液。
2.1.2混合对照品溶液 精密吸取2.1.1项下7种对照品储备液各2.5 mL,用60%甲醇制成红镰霉素-6-O-β-龙胆二糖苷52.6 μg·mL-1、大车前苷8.8 μg·mL-1、莫诺苷56.3 μg·mL-1、决明子苷37.7 μg·mL-1、马钱苷28.6 μg·mL-1、山茱萸新苷6.3 μg·mL-1、橙黄决明素-6-O-葡萄糖苷21.9 μg·mL-1的混合对照品溶液。
2.1.3复明片供试品溶液 取复明片样品(批号:PC218110591)适量,除去薄膜衣,研成细粉,取2.0 g,精密称定,精密加入60%甲醇25 mL,加热回流提取60 min,取出放冷,用60%甲醇补足减失质量,滤过,制成复明片供试品溶液。
2.1.4阴性样品溶液 按《中国药典》2015年版一部复明片质量标准项下的处方比例和制法,分别制备缺车前子、缺决明子、缺酒萸肉的3种阴性样品,再按2.1.3项下方法制备阴性样品溶液。
2.2 色谱条件及系统适用性试验
色谱柱:Diamonsil C18(250 mm×4.6 mm,5 μm)柱;检测波长分别为330 nm[9-11](0~17.0 min检测大车前苷)、278 nm[12](17.0~36.0 min检测红镰霉素-6-O-β-龙胆二糖苷、决明子苷、橙黄决明素-6-O-葡萄糖苷)和240 nm[13-15](36.0~65.0 min检测莫诺苷、马钱苷、山茱萸新苷);流动相:乙腈(A)-0.1%磷酸溶液(B),梯度洗脱(0~11.0 min,15.0%A;11.0~17.0 min,15.0%~19.0%A;17.0~36.0 min,19.0%~25.0%A;36.0~57.0 min,25.0%~41.0%A;57.0~65.0 min,41.0%~15.0%A);体积流量:1.0 mL·min-1;柱温:30 ℃;进样量:10 μL。精密吸取2.1.2~2.1.4项下制备的各溶液依法进样检测,记录所检测色谱图,见图1。结果显示,所记录色谱图基线平稳,复明片中7种待测目标成分与其他杂质峰分离度均大于1.5,理论塔板数按各成分色谱峰计均不低于4500,阴性样品对复明片中7种成分的同时测定无干扰。
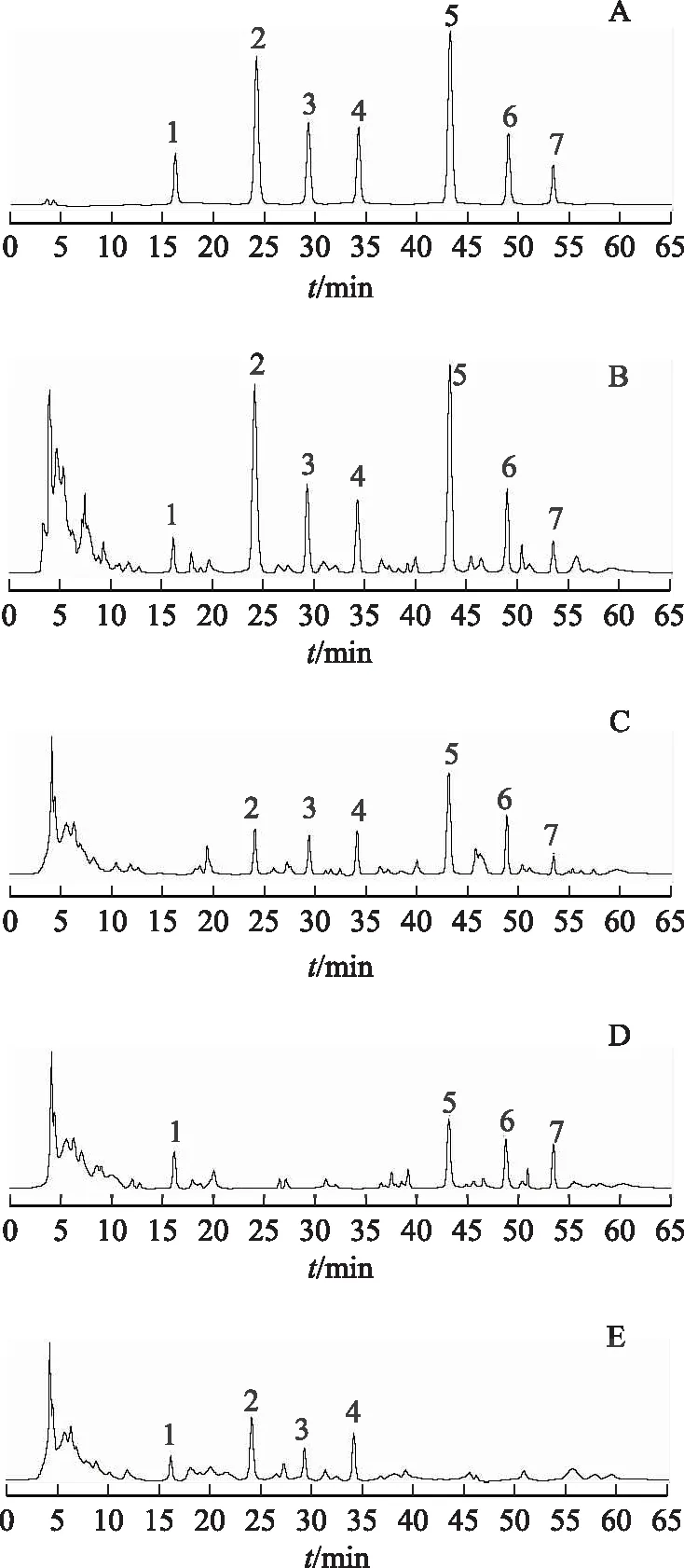
注:A.混合对照品;B.复明片;C.车前子阴性样品;D.决明子阴性样品;E.酒萸肉阴性样品;1.大车前苷;2.红镰霉素-6-O-β-龙胆二糖苷;3.决明子苷;4.橙黄决明素-6-O-葡萄糖苷;5.莫诺苷;6.马钱苷;7.山茱萸新苷。图1 混合对照品及复明片的HPLC图
2.3 线性关系考察
分别精密吸取2.1.1项下7种对照品储备溶液适量,用60%甲醇溶液制成红镰霉素-6-O-β-龙胆二糖苷、大车前苷、莫诺苷、决明子苷、马钱苷、山茱萸新苷和橙黄决明素-6-O-葡萄糖苷25倍质量浓度差的6个混合对照品溶液,依法进样检测,记录待测目标成分红镰霉素-6-O-β-龙胆二糖苷、大车前苷、莫诺苷、决明子苷、马钱苷、山茱萸新苷和橙黄决明素-6-O-葡萄糖苷峰面积,以质量浓度为横坐标,峰面积为纵坐标,进行回归,结果见表1。
2.4 精密度试验
取2.1.2项下的混合对照品溶液重复进样6次,测得复明片中红镰霉素-6-O-β-龙胆二糖苷、大车前苷、莫诺苷、决明子苷、马钱苷、山茱萸新苷和橙黄决明素-6-O-葡萄糖苷色谱峰峰面积的RSD分别为0.94%、1.28%、0.65%、1.03%、1.05%、1.36%和1.17%。
2.5 重复性试验
按2.1.3项下方法平行制备同一批次复明片(批号:PC218110591)样品6份供试品溶液,依法进样检测,记录复明片中红镰霉素-6-O-β-龙胆二糖苷、大车前苷、莫诺苷、决明子苷、马钱苷、山茱萸新苷和橙黄决明素-6-O-葡萄糖苷色谱峰的峰面积,计算得7种待测成分含量的RSD分别为1.16%、1.71%、0.98%、0.35%、1.64%、0.87%和1.59%。
2.6 稳定性试验
临用新配1份复明片(批号:PC218110591)供试品溶液,于制备后0、2、4、8、12、24 h依法进样检测,记录复明片中红镰霉素-6-O-β-龙胆二糖苷、大车前苷、莫诺苷、决明子苷、马钱苷、山茱萸新苷和橙黄决明素-6-O-葡萄糖苷色谱峰的峰面积,结果复明片供试品溶液24 h内稳定,各成分峰面积的RSD分别为1.01%、1.29%、0.62%、1.08%、0.98%、1.33%和1.15%。
2.7 加样回收率试验
取同一批次红镰霉素-6-O-β-龙胆二糖苷、大车前苷、莫诺苷、决明子苷、马钱苷、山茱萸新苷和橙黄决明素-6-O-葡萄糖苷含量已知的复明片(批号:PC218110591)样品适量,除去薄膜衣,研细,取9份,每份1.0 g,精密称定,随机分成3组,依据《中国药典》2015年版四部对加样回收率试验数据的要求,分别精密加入根据供试品溶液含量另行配制的混合对照品溶液(红镰霉素-6-O-β-龙胆二糖苷0.397 mg·mL-1、大车前苷0.049 mg·mL-1、莫诺苷0.435 mg·mL-1、决明子苷0.256 mg·mL-1、马钱苷0.197 mg·mL-1、山茱萸新苷0.037 mg·mL-1、橙黄决明素-6-O-葡萄糖苷0.128 mg·mL-1)1.0、2.0、3.0 mL各1组,再按2.1.3项下方法制备加样样品溶液,依法进样检测,结果所测成分大车前苷、红镰霉素-6-O-β-龙胆二糖苷、决明子苷、橙黄决明素-6-O-葡萄糖苷、莫诺苷、马钱苷和山茱萸新苷的平均加样回收率及RSD分别为99.02%(1.21%)、97.43%(1.09%)、100.11%(0.64%)、98.49%(0.76%)、97.96%(1.19%)、96.98%(1.15%)和98.40%(1.51%)。
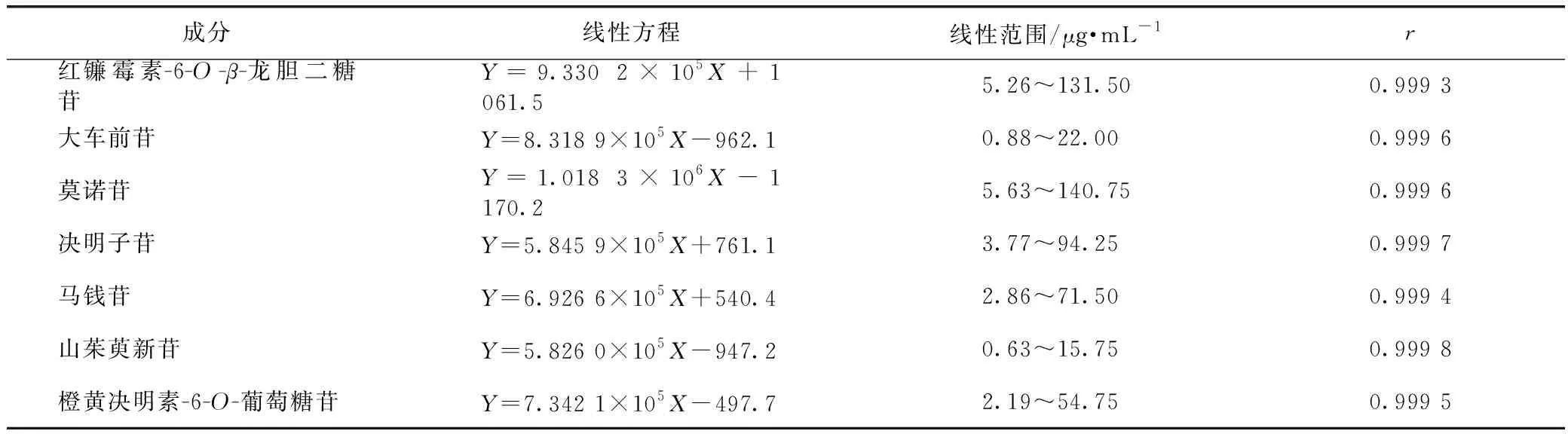
表1 复明片7种成分线性关系和范围
2.8 相对校正因子的测定
精密吸取2.3项下6个混合对照品溶液适量,依法进样测定复明片中红镰霉素-6-O-β-龙胆二糖苷、大车前苷、莫诺苷、决明子苷、马钱苷、山茱萸新苷和橙黄决明素-6-O-葡萄糖苷色谱峰的峰面积,以莫诺苷为内参物,按照公式(1)分别计算其他6种成分的相对校正因子,结果见表2。
fk/s=fk/fs=(Ck×As)/(Cs×Ak)
(1)
式中C代表质量浓度,A代表峰面积,k代表内参物,s代表其他目标成分。
2.9 相对校正因子耐用性考察
2.9.1不同仪器、色谱柱 取2.1.2项下制备的混合对照品溶液依法进样测定复明片中红镰霉素-6-O-β-龙胆二糖苷、大车前苷、莫诺苷、决明子苷、马钱苷、山茱萸新苷和橙黄决明素-6-O-葡萄糖苷色谱峰的峰面积,对比考察Agilent 1100型、Shimadzu Prominence型2种品牌高效液相色谱仪和Diamonsil C18(250 mm×4.6 mm,5 μm)、Shimadzu wondasil C18-WR(250 mm×4.6 mm,5 μm)、Agilent TC-C18(250 mm×4.6 mm,5 μm)3种型号色谱柱对相对校正因子的影响,结果见表3。
2.9.2不同体积流量 取2.1.2项下制备的混合对照品溶液依法进样,测定复明片中红镰霉素-6-O-β-龙胆二糖苷、大车前苷、莫诺苷、决明子苷、马钱苷、山茱萸新苷和橙黄决明素-6-O-葡萄糖苷色谱峰的峰面积,对比考察不同体积流量(0.8、0.9、1.0、1.1、1.2 mL·min-1)对相对校正因子的影响,结果见表4。
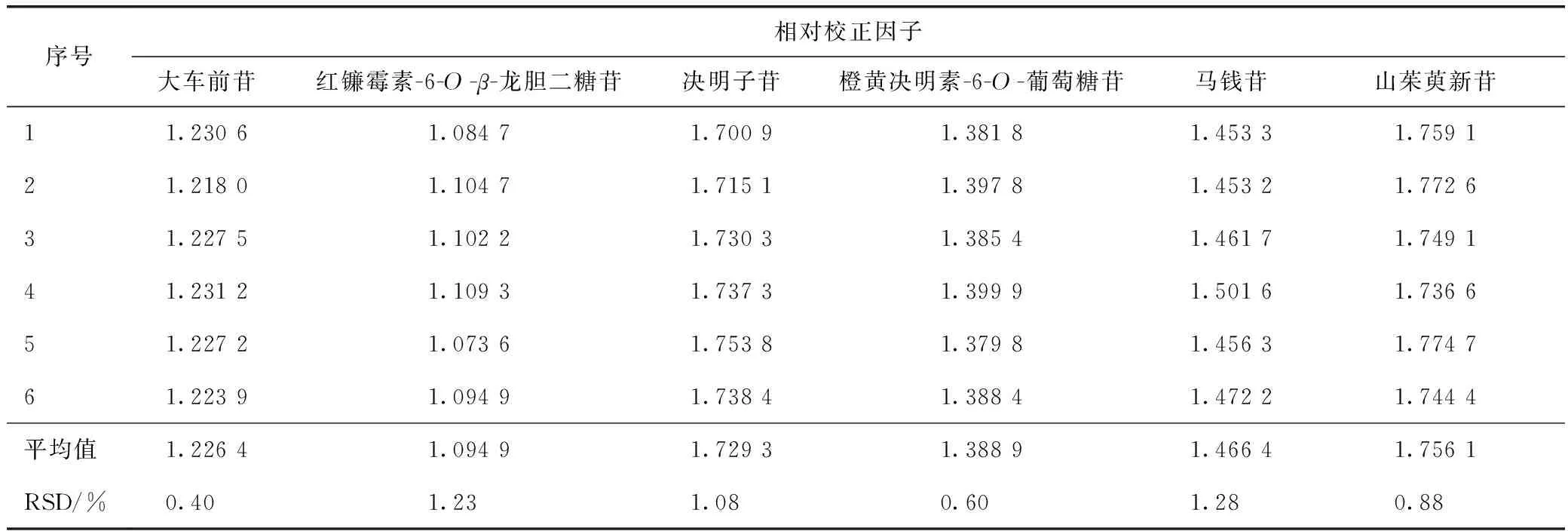
表2 以莫诺苷为内参物的相对校正因子
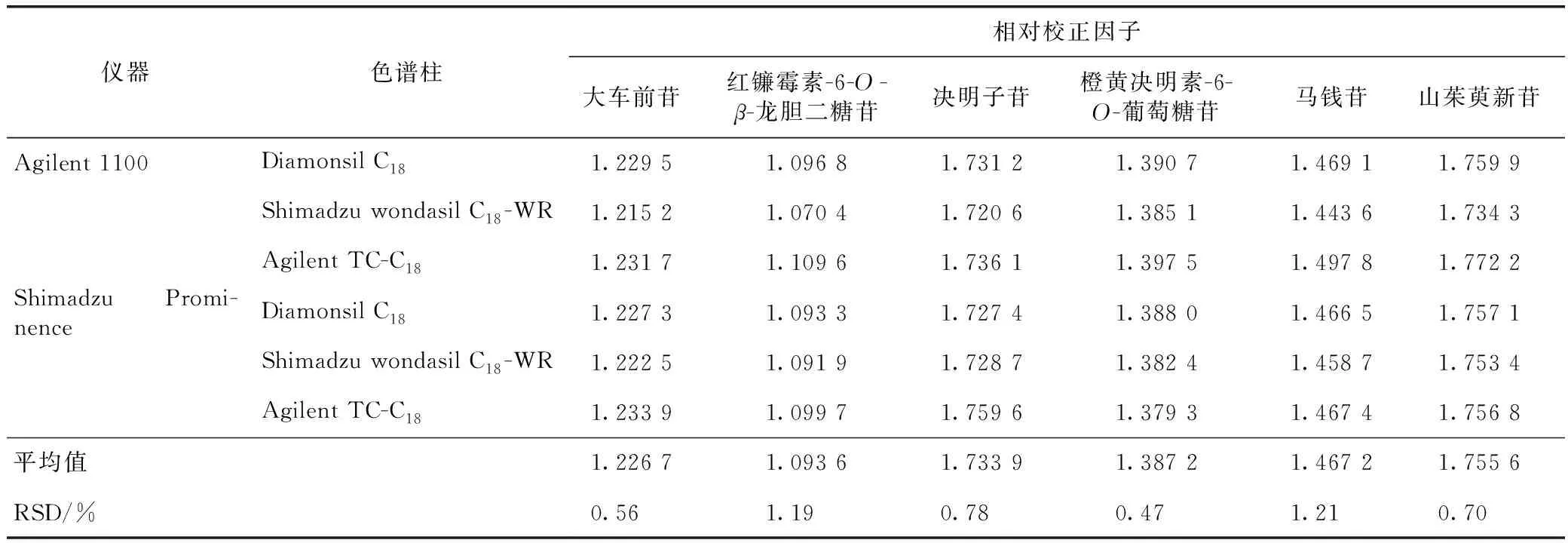
表3 不同仪器、不同色谱柱对相对校正因子的影响
2.9.3待测组分色谱峰的定位 以内参物莫诺苷色谱峰为基准峰,采用相对保留时间值法考察在不同仪器、不同色谱柱条件下其他待测6种成分与内参物莫诺苷的相对保留时间,结果见表5。
2.10 样品含量测定
取3批复明片样品(批号分别为:PC218110591、PC219030101、PC219040171)依法进样测定,记录复明片中待测目标成分红镰霉素-6-O-β-龙胆二糖苷、大车前苷、莫诺苷、决明子苷、马钱苷、山茱萸新苷和橙黄决明素-6-O-葡萄糖苷峰面积,分别采用外标法(ESM)和QAMS计算红镰霉素-6-O-β-龙胆二糖苷、大车前苷、莫诺苷、决明子苷、马钱苷、山茱萸新苷和橙黄决明素-6-O-葡萄糖苷的含量,结果见表6。
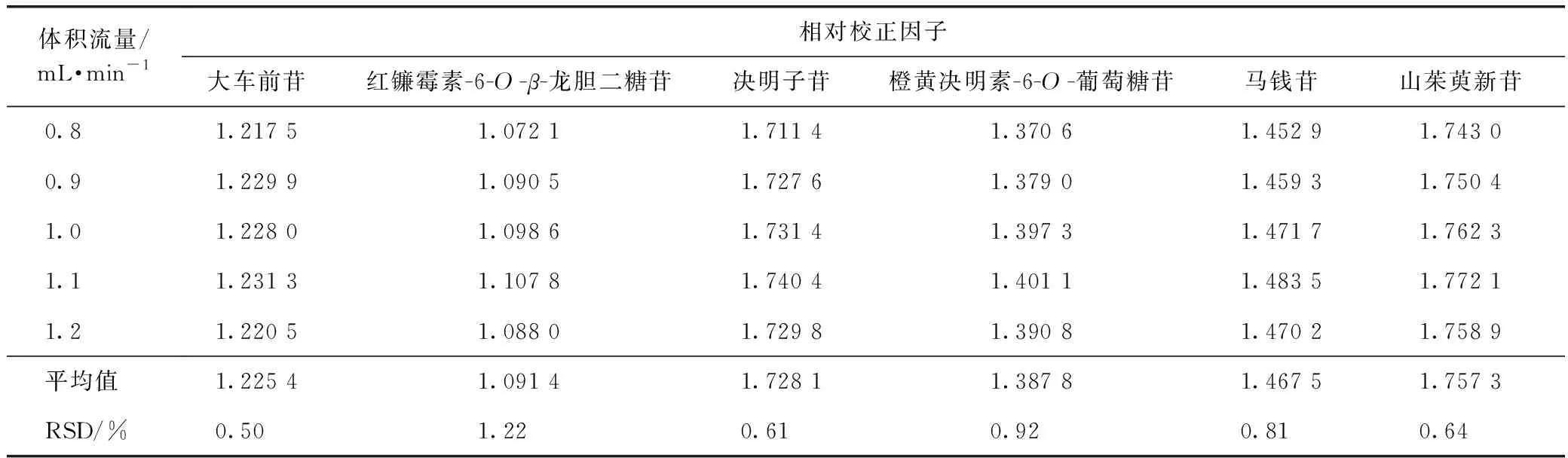
表4 不同体积流量对相对校正因子的影响

表5 不同仪器、不同色谱柱对相对保留时间的影响
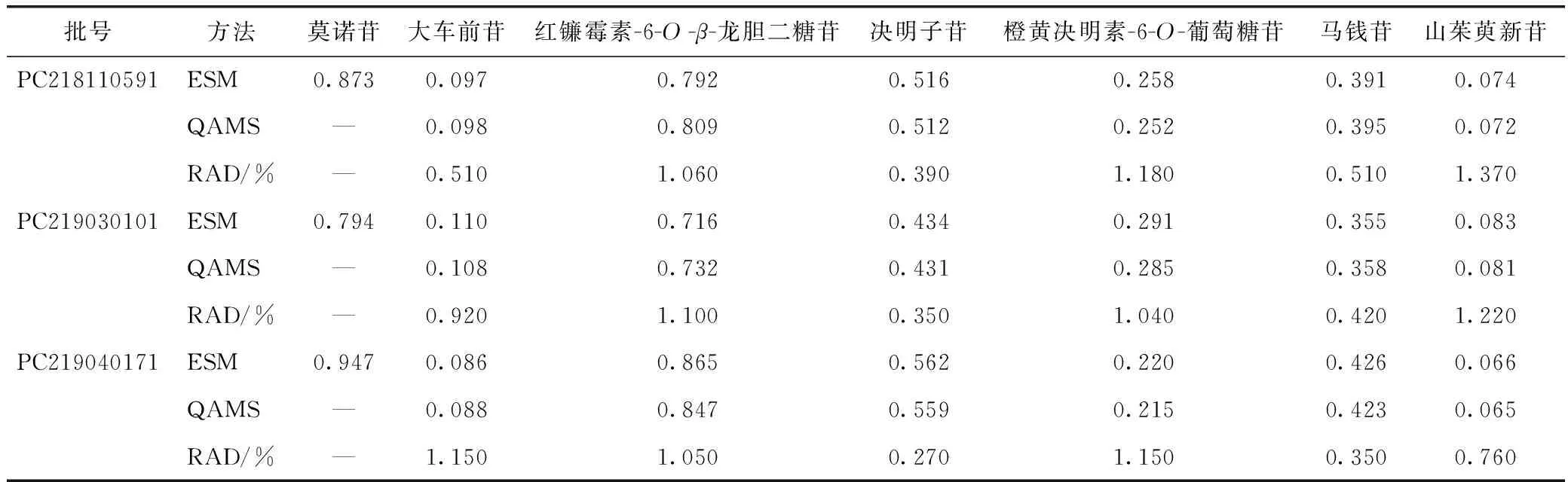
表6 复明片7种成分含量测定结果(n=3) mg·g-1
3 讨论
3.1 指标性成分的确定
复明片由酒萸肉、车前子、决明子、枸杞子、地黄等24味中药配伍而成,方中酒萸肉、枸杞子、菟丝子滋补肝肾、生精明目,女贞子、熟地黄、地黄补肾滋阴、益肝养血,石斛滋阴生津,合为君药;附以决明子清热明目,木贼、谷精草疏散风热、明目退翳,黄连、夏枯草清肝泻火、明目消肿,菊花平肝明目,牡丹皮清热凉血,车前子清利湿热,木通利尿通淋、清心除烦,羚羊角、蒺藜、石决明平肝潜阳、清热开郁,泽泻利湿泄热,茯苓健脾渗湿,槟榔下气行水,人参、山药健脾补气,诸药共奏,以达滋补肝肾、养阴生津、清肝明目之功效。参考中药质量标志物以君药为首选,兼顾臣佐使药的选定原则,选取复明片方中君药酒萸肉所含主要活性成分莫诺苷、马钱苷和山茱萸新苷,臣药决明子所含特征成分红镰霉素-6-O-β-龙胆二糖苷、决明子苷和橙黄决明素-6-O-葡萄糖苷,佐药车前子所含主要成分大车前苷为定量测定目标成分,为全面评价复明片的产品质量提供参考。
3.2 色谱条件流动相的确定
本实验首先对流动相乙腈-水[8]、甲醇-水[14]进行考察,以复明片待测目标成分大车前苷、红镰霉素-6-O-β-龙胆二糖苷、决明子苷、橙黄决明素-6-O-葡萄糖苷、莫诺苷、马钱苷和山茱萸新苷色谱峰的峰形、分离效果、色谱图基线平稳情况及检测时间等为考察指标,结果发现,乙腈-水为流动相时综合效果较好,但镰霉素-6-O-β-龙胆二糖苷、决明子苷、莫诺苷和马钱苷色谱峰存在拖尾现象,遂以乙腈为有机相,对比考察了不同水相(0.1%磷酸溶液[13,15-16]、0.1%甲酸溶液[10-11])对考察指标的影响,同时对梯度洗脱比例不断摸索,最终确定采用乙腈-0.1%磷酸溶液为流动相,按照正文中的流动相比例进行梯度洗脱,对复明片中7种指标性成分进行同时检测。
4 结语
本实验首次采用QAMS对复明片中红镰霉素-6-O-β-龙胆二糖苷、大车前苷、莫诺苷、决明子苷、马钱苷、山茱萸新苷和橙黄决明素-6-O-葡萄糖苷含量进行同时测定,建立了复明片多指标成分质量控制模式,为全面评价复明片的产品质量提供了数据支持。

