集胞藻Synechocystis sp.PCC 6803脂质组的分析
郭晓烨 李艳华 韩丹翔
(1.中国科学院水生生物研究所, 武汉 430072; 2.中国科学院大学, 北京 100049)
类囊体膜是光合作用的发生场所, 为光合作用相关的蛋白复合物提供了一个连续的封闭膜系统,使两个横向分离的光系统之间移动的电子传输元件得以扩散[1]。蛋白质与脂质作为类囊体膜及光合系统的主要组成成分, 对维持类囊体膜的结构与功能非常重要, 分别约占类囊体膜质量的60%和40%[2]。到目前为止, 大部分的光合作用相关的蛋白质已经被很好地解析, 而对脂质的生理学功能的研究还非常有限。类囊体膜的脂质组成在高等植物和各种藻类中都具有高度相似性[3], 主要为单半乳糖甘油二脂 (Monogalactosyldiacylglycerol, MGDG)、双半乳糖甘油二脂(Digalactosyldiacylglycerol, DGDG)、磷脂酰甘油 (Phosphatidyl glycerol, PG) 和硫代异鼠李糖甘油二酯 (Sulfoquinovosyl diacylglycerol,SQDG)[4]。已有的研究表明, 脂质具有多种重要功能, 包括与光合蛋白复合物和色素相互作用从而影响光合作用和光保护等生物学过程, 在稳定双层膜中起重要作用, 与生物适应变化的环境条件的能力有关等[5—7]。
为了更好地研究光合作用生物脂质组分的功能, 需要对其进行更加准确、系统的定性及定量分析。目前常用的脂质的分析方法主要有薄层色谱法(Thin-layer chromatography, TLC)、气相色谱(Gas chromatography, GC)和液相色谱(Liquid Chromatography, LC)等[8,9]。传统的方法有耗时长、样品需求量大等缺点。例如, 薄层色谱法虽能有效分离不同的脂质组分, 但由于多步骤操作中样品的损失和硅胶等杂质的引入会影响后续的进一步分析。气相色谱则需要对脂肪酸组分进行甲酯化, 因此只能测定脂肪酸的含量, 而不能对甘油酯分子进行直接的分析。液相色谱具有分离效率高, 检测灵敏度高等优点, 能在降低对样品成分影响的前提下有效地分离出多种细微差别的脂质。基于油脂的多样性, 除分离技术外, 质谱(Mass Spectrometry, MS)、核磁共振(Nuclear magnetic resonance, NMR)和其他光谱方法是现今最有效的脂质鉴定方法[10—12]。Welt等[13,14]利用电喷雾离子化串联质谱法(Electrospray Ionization Spray-Tandem Mass Spectrometry,ESI-MS/MS)实现了对植物油脂粗提物中脂质分子的定性分析, 该项技术具有仅需少量的测量样品且前处理步骤少等优势。许多报道表明, 在ESI条件下大部分甘油磷酯和糖脂可以通过粗脂提取物直接分析, 这种方法被称为“鸟枪法脂质组学”, 它是基于在三重四极杆上直接进行的单个脂质分子的特征碎片离子扫描和中性丢失模式扫描, 该方法具有较高的通量[13—15]。Shui等[16]研究中表明在ESIMS中各甘油酯离子的响应在生物学浓度范围内是线性的, 因此可通过在样品内添加内标样品进行半定量分析。超高效液相色谱(Ultra Performance Liquid Chromatography, UPLC)与质谱技术联用后, 更是成为定量分析比较复杂样品中油脂成分的有效工具。
集胞藻Synechocystissp.PCC 6803作为成熟的模式蓝藻, 已被广泛地应用在对脂质代谢的研究中[17]。为了实现对脂质进行定量分析, 本研究以Synechocystissp.PCC 6803为研究对象, 建立了基于超高效液相色谱耦合串联质谱法(UPLC-ESIMS/MS)的脂质定性及定量分析方法, 为进一步研究蓝藻中甘油酯的生理功能奠定了基础。
1 材料与方法
1.1 藻的培养和收获
Synechocystissp.PCC 6803藻种由本实验室保藏。在BG11[17]固体培养基的平板中挑单藻落转移至三角瓶中培养, 采用液体 BG11培养基(pH 7.0)扩培两次后, 以起始浓度为 2×106cells/mL转接至容积为 750 mL 的柱状光反应器, 于20 μmol/(m2·s)光照强度, 1.5%(v/v)CO2通气量, 30℃条件下连续培养。
高光及低光条件下培养: 将对数期的藻细胞设起始浓度为 5×107cells/mL, 转接至容积为 750 mL的光反应柱, 采用BG11培养基, 分别于低光100 μmol/(m2·s)和高光300 μmol/(m2·s) 光照强度, 1.5%(v/v)CO2通气量, 在30℃条件下连续培养, 于0、2h和12h取样。
藻细胞的收获: 以5000×g离心10min 收集藻细胞, 用0.2 mol/L 磷酸盐缓冲液(Phosphate buffer,PB), 即10.8 g/L NaH2PO4和43.7 g/L Na2HPO4·7H2O混合溶液, 洗涤3次, 收集并冷冻干燥, 于-80℃保存。
1.2 总脂提取
总脂提取方法参照文献[18]并有改进, 称取5 mg冻干藻粉, 加入 6 mL甲醇∶氯仿∶甲酸(20∶10∶1,v∶v∶v), 室温下在旋涡振荡器上充分振荡1h, 再加入3 mL的1 mol/L氯化钾和0.2 mol/L磷酸混合溶液去除蛋白杂质, 充分振荡。在4℃下以1000×g的离心力离心5min, 取下层有机相, 氮吹去除有机溶剂并于-20℃保存。
1.3 鸟枪质谱法定性分析
提取的油脂溶解于2 mL含有10 mmol/L乙酸铵的甲醇∶氯仿(1∶1,v∶v)溶液中, 以10 μL/min流速进入Xevo TQ-S三重四极杆质谱仪(美国Waters公司)的ESI源。ESI-MS/MS实验(母离子和中性丢失扫描)以正极和负极两种离子模式, 正极用于检测MGDG和DGDG[19,20], 负极用于检测PG和SQDG[21],扫描速度为200 Da/s。高纯氮气作为雾化和干燥气体, 流速为600 L/h, 去溶剂温度为300℃。毛细管电压和锥孔电压分别为3000 V和40 V(正离子模式),2500 V和30 V(负离子模式)。碰撞气体为高纯氩气, 碰撞能量根据化合物的不同设为5—50 V, 扫描范围100—1100 Da。
1.4 液相色谱-质谱定量分析
色谱条件参考Li等[22]的方法。ACQUITY超高效液相色谱仪(美国Waters公司)与Xevo TQ-S联用,经BEH C18 色谱柱(2.1 mm×50 mm, 1.7 μm; 美国Waters公司)分离, 采用多反应监测(Multiple reaction monitoring, MRM)扫描模式分析。
正离子模式下的流动相为A: 甲醇∶乙腈∶超纯水(19∶19∶2,v∶v∶v)+10 mmol/L醋酸铵+ 0.1%甲酸;B: 异丙醇+10 mmol/L 醋酸铵+0.1% 甲酸。梯度洗脱程序设为: 0, 10% B; 1min, 10% B; 6min, 25% B;10min, 60% B; 10.1min, 10% B; 13min, 10% B。
负离子模式下的流动相为A: 甲醇∶超纯水 (85∶15,v∶v)+10 mmol/L醋酸铵; B: 异丙醇+10 mmol/L醋酸铵。梯度洗脱程序设为: 0, 20% B; 1min,20% B; 8min, 40% B; 9min, 80% B; 11min, 80% B;11.1min, 20% B; 14min, 20% B。
流速为0.2 mL/min, 每个样品的进样量为1 μL。
1.5 化学试剂和标准样品
甲醇(Methanol, 质谱级)和乙腈(Acetonitrile, 质谱级)购自德国Merck公司, 异丙醇(Isopropanol, 质谱级)购自美国 Fisher公司, 三氯甲烷(Chloroform,色谱级)、甲酸(Formic acid, 质谱级)和乙酸铵(NH4Ac,质谱级)购自美国Sigma公司; 实验用水为Milli-Q超纯水。色谱级试剂用于油脂提取, 质谱级试剂用于超高效液相色谱耦合串联质谱法对脂质组学分析。
2种内标 MGDG 18∶0/18∶0和DGDG 18∶0/18∶0购自美国Matreya公司, PG 17∶0/20∶4 购自美国Avanti Polar Lipids公司。标样MGDG 16∶3/18∶3、DGDG 18∶3/18∶3和PG 16∶0/18∶1购自Avanti Polar Lipids,SQDG 16∶0/18∶3购自英国Indofine Chemical公司。
1.6 数据处理
每组实验数据设3个平行, 结果用平均值±标准偏差表示。数据采集和处理采用Waters Micromass MassLynx v 4.1数据处理系统, 使用Microsoft Excel进一步分析处理。
脂肪酸链表示方式为:w∶x/w∶x,w为碳原子总数,x为每条脂肪酸链所含双键数。指代的脂肪酸链无先后顺序, 测量结果不能判断脂肪酸链在sn-1或sn-2位上。
2 结果
2.1 建立基于质谱的脂质定性分析方法
Synechocystissp.PCC 6803各脂质组分根据质谱产生的特征碎片用以定性分析。甘油酯的碎片机理的研究是根据分析各甘油酯标准样品的质谱图, 来确定最合适的特征碎片粒子和优化质谱仪分析参数。MGDG和DGDG采用ESI-MS/MS正极离子模式分析, PG和SQDG采用ESI-MS/MS负极离子模式。
以ESI-MS/MS正极离子模式下MGDG 18∶0/18∶0为例, 根据子离子质谱图(图1A)分析MGDG的酰基组成。由于正极模式下流动相含醋酸铵, 母离子为m/z804.16 [M+NH4]+, 碎片离子m/z607.38[M+NH4-197]+,m/z625.2 [M+NH4-179]+, 分别为中性丢失m/z197的碎片(C6H12O-H+NH4)和m/z179(C6H12O-H-H2O+NH4), 所丢失的碎片是MGDG所特有的单半乳糖基衍生片段。除MGDG 18∶0/18∶0外, 在所有已知标准样品的质谱图中都具有相同的碎片离子。由于质谱分析中检测得中性丢失模式m/z197比m/z179更灵敏, 能同时检测到更多种类的MGDG, 因此MGDG以中性丢失m/z197为定性分析的特征碎片, 用于后续不同酰基组成的MGDG的鉴定。碎片离子m/z341.16 [RXCO+74]+(X=1, 2)是中性丢失的sn-1或sn-2位上的酰基,根据荷质比可推算酰基为C18∶0, 元素组成为C18H36O2-OH+74。因此根据丢失MGDG所特有的单半乳糖基衍生片段m/z197和m/z179的碎片离子可以断定化合物为MGDG, 根据另2个经中性丢失产生的碎片离子的荷质比可以推算酰基的碳数和双键数, 对MGDG进行定性分析。
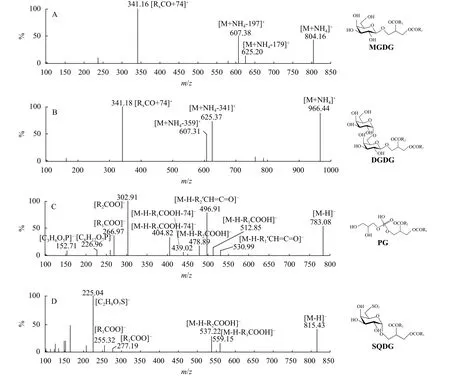
图1 糖脂和磷脂的子离子扫描质谱图Fig.1 The product-ion scanning mass spectra of glycolipids and phospholipid
DGDG的碎片结构和MGDG非常接近, 根据子离子质谱图定性方法参考MGDG。以DGDG 18∶0/18∶0为例, 在ESI-MS/MS正极离子模式下质谱图如图1B所示。母离子为m/z966.44 [M+NH4]+,碎片离子:m/z607.31 [M+NH4-359]+和m/z625.37 [M+NH4-341]+, 分别为中性丢失m/z359(C12H22O11-H+NH4)和m/z341(C12H22O11-H-H2O +NH4), 所丢失的碎片是DGDG所特有的双半乳糖基衍生片段。由于质谱分析中检测得中性丢失模式m/z341比m/z359更灵敏, 能同时检测到更多种类的DGDG, DGDG以中性丢失m/z341为定性分析的特征碎片用于后续不同脂肪酸组成的DGDG的鉴定。碎片离子m/z341.18 [RXCO+74]+(X=1, 2), 所丢失的片段是sn-1或sn-2位上的酰基, 且根据荷质比可推算酰基为C 18∶0, 元素组成为C18H36O2-OH+74。因此, 根据中性丢失DGDG所特有的双半乳糖基衍生片段m/z359和m/z341的碎片离子可以断定化合物为DGDG, 根据另两个经中性丢失产生的碎片离子的荷质比可以推算酰基的碳数和双键数, 对DGDG进行定性分析。
对于PG的定性分析以17∶0/20∶4为例。图1C为PG 17∶0/20∶4的子离子质谱图, 母离子为m/z783.08[M-H]-。产生两个羧酸阴离子碎片[RXCOO]-(X=1,2),m/z268.97和 302.91。根据荷质比可推算酰基分别为C 17∶0和C 20∶4, 元素组成为C17H34O2-H和C20H32O2-H。碎片离子m/z478.89和m/z512.85是[M-H-RXCO2H]-(X=1, 2),m/z496.91和m/z530.99是[M-H-RX’CH=C=O]-(X=1, 2), 分别为丢失sn-1和sn-2位的脂肪酸链后的游离酸和烯酮。m/z404.82和m/z439.02的碎片(表示为[M-H-RXCO2H-74]-(X=1,2)), 由丢失酰基和磷酸基团头部产生。表示特征极性磷酸基团头部的离子为m/z226.96([C6H12O7P]-)和m/z152.71([C3H6O5P]-), 由甘油磷酸酯或甘油磷酸脱水形成。由于m/z152.71片段同样可以作为其他磷脂(Phosphatidic acid, PA; Phosphatidylserine,PS; Phosphatidylinositol, PI和Phosphatidyl-ethanolamine, PE等)的特征离子, 因此选用m/z227为PG的特征片段来定性分析。
SQDG 的分析鉴定以SQDG 16∶0/18∶3为例, 在ESI-MS/MS负极离子模式下质谱图如图1D所示,母离子为m/z815.43 [M-H]-。产生两个m/z255.32和m/z277.19的碎片羧酸阴离子[RXCOO]-(X=1, 2),根据荷质比可推算酰基分别为C 16∶0和C 18∶3, 元素组成为C16H32O2-H和C18H30O2-H。碎片离子m/z537 [M-H-RXCO2H]-(X=1, 2), 和m/z559 [M-HRXCO2H]-(X=1, 2), 分别为母离子中性丢失sn-1和sn-2位的酰基所得。离子m/z225([C6H9O7S]-)是磺基-6-脱氧葡糖基头部, 作为SQDG所独有的特征片段可用以SQDG鉴定。
根据以上讨论所得4种甘油酯MGDG、DGDG、PG和SQDG各自的特征碎片, 确立了相应质谱分析参数如表1所示, 后续实验都以下表参数进行分析。
2.2 鸟枪质谱法分析鉴定Synechocystis sp.PCC 6803脂质组分
Synechocystissp.PCC 6803油脂粗提样品直接进入ESI源通过鸟枪质谱法检测分析膜脂组分,先通过中性丢失(或母离子扫描)模式找到MGDG、DGDG(或PG和SQDG)的种类, 再通过子离子扫描鉴定其脂肪酸组成。根据确立的4种极性甘油酯MGDG、DGDG、PG和SQDG的质谱分析参数设置LC-MS测定Synechocystissp.PCC 6803所含的4种甘油酯, 对所得的质谱图分析后得到四种甘油酯的主要脂肪酸组成种类如表2所示, 共鉴定有21种MGDG、21种DGDG、7种PG和12种SQDG。

表1 质谱分析参数Tab.1 Mass spectrometry analysis parameters
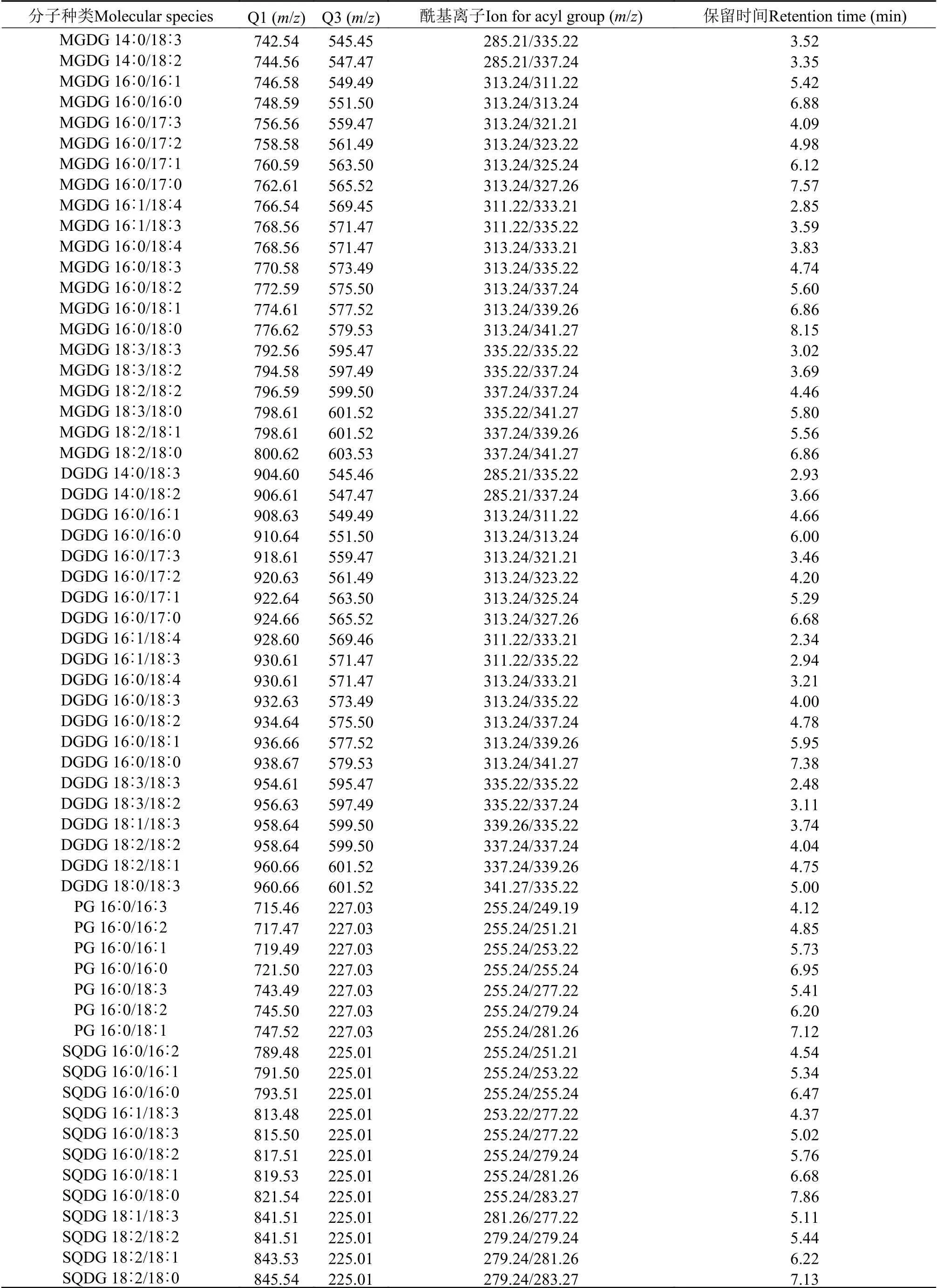
表2 Synechocystis sp.PCC 6803脂质的主要脂肪酸组成种类Tab.2 Major acyl species of membrane lipid molecular species in Synechocystis sp.PCC 6803
2.3 定量分析Synechocystis sp.PCC 6803脂质组分
通过超高效液相色谱耦合串联质谱法的正极模式, 能在BEH C18色谱柱内有效分离Synechocystissp.PCC 6803油脂粗提样品中所含的不同脂肪酸组成的MGDG和DGDG, 负极模式有效分离不同脂肪酸组成的PG和SQDG(图2)。不同甘油酯采用的对应质谱分析扫描模式为: MGDG([M+NH4]+→ [M+NH4-197]+)、DGDG([M+NH4]+→ [M+NH4-341]+)、PG([M-H]-→m/z227)和SQDG([M-H]-→m/z225)。根据已知浓度的混合标准样品建立标准曲线表2, 配制梯度浓度的外标分别为MGDG 16∶3/18∶3、DGDG 18∶3/18∶3、PG 16∶0/18∶1和SQDG 16∶0/18∶3, 定量的内标MGDG 18∶0/18∶0(0.5 μmol/L)、DGDG 18∶0/18∶0(0.5 μmol/L)和PG 17∶0/20∶4(0.5 μmol/L), 在相应的质谱分析参数模式下测定各标准样品的峰面积。以样品的峰面积Ax与内标的峰面积Ai比值Ax/Ai为横坐标, 以标准外标混合物浓度(ppm)为纵坐标, 得到标准曲线如表3, 4种脂质都呈现良好的线性关系, 因此Synechocystissp.PCC 6803所含4种甘油酯MGDG、DGDG、PG和SQDG均可采用对比内标相对值的方法进行半定量分析。
选取生长对数期的Synechocystissp.PCC 6803藻细胞进行脂质组分定量分析, 结果表明4种甘油酯MGDG、DGDG、PG和SQDG的浓度分别为(93.4±4.1)、(41.6±2.7)、(9.7±0.4)和(63.9±5.8) nmol/g。其中MGDG 18∶2/16∶0和MGDG 18∶3/16∶0是MGDG含量最多的两种, 分别占总含量的46.4%和37.1%。DGDG 18∶2/16∶0和DGDG 18∶4/16∶0是DGDG含量最多的两种, 分别占总含量的45.0%和15.9%。PG 18∶2/16∶0和PG 18∶3/16∶0是PG含量最多的两种, 分别占总含量的31.2%和38.8%。SQDG 18∶2/16∶0和SQDG 18∶3/16∶0是SQDG含量最多的两种, 分别占总含量的31.0%和24.9%。C18∶2/16∶0酰基组成的甘油酯在4种甘油酯中都有30%以上的占比, 可见在Synechocystissp.PCC 6803中脂肪酸链多以18∶2/16∶0形式存在。
2.4 在不同光强条件下Synechocystis sp.PCC 6803脂质组分变化情况
将常规培养的Synechocystissp.PCC 6803藻细胞转入100 μmol/(m2·s)光照强度下培养(图3), 外界光照强度的变化使各脂质组分发生了不同程度的改变, 其中MGDG没有显著性的变化, DGDG和PG的总含量随着光照时间的增加而逐渐累加,SQDG的总含量呈现截然不同的减少趋势。而转入更高光强300 μmol/(m2·s)条件下培养的藻细胞中各脂质组分和100 μmol/(m2·s)光强相比, 保持了原来的总体变化趋势基础上都有所加强, 如DGDG在12h增长量由10.50%(P<0.05)增加至26.95%(P<0.001), SQDG在12h减少量由21.96%(P<0.01)增加至33.18%(P<0.001)。而MGDG和PG是在第2小时短时间内有更为显著地积累, 增长量分别达34.64%(P<0.01)和68.49%(P<0.05)。随着光照强度的增加,Synechocystissp.PCC 6803藻细胞总体而言积累了更多的半乳糖脂MGDG、DGDG和磷脂PG, 其中MGDG和PG是先增加后略减少, DGDG随时间不断积累, 相较而言SQDG始终在减少。
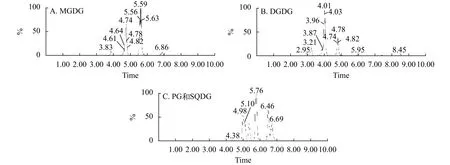
图2 MRM检测模式下Synechocystis sp.PCC 6803 油脂的色谱图Fig.2 Chromatography of the Synechocystis sp.PCC 6803 lipids detected by MRM
从分子水平上看(图4和图5), 高饱和种类脂肪酸构成的MGDG如MGDG 16∶0/18∶1、MGDG 16∶0/17∶0、MGDG 16∶0/18∶0 和MGDG 16∶0/16∶0等第2小时显著增长, 而高不饱和脂肪酸构成的MGDG如MGDG 16∶0/18∶4在第12 小时大量积累。各种类DGDG在2h和12h的时间点上普遍呈现逐渐增加的增长趋势。PG和MGDG非常类似, 各种类PG的变化趋势受脂肪酸链饱和程度的差异影响,呈现以高饱和度脂肪酸组成的PG如PG 16∶0/18∶1、PG 16∶0/16∶0和PG 16∶0/16∶1先增加, 高不饱和度脂肪酸组成的PG如PG 16∶0/16∶3和PG 16∶0/18∶3后增加的趋势。SQDG中除SQDG 16∶0/18∶0在第2小时有显著增加外, 其他种类都呈现减少的趋势。在两种光强培养模式对比下, 以上各分子种类的甘油酯变化趋势都随着光照强度的增加而更为显著, 是Synechocystissp.PCC 6803藻细胞针对外界光照的变化而做出的适应性转变。
3 讨论
3.1 超高效液相色谱耦合串联质谱法定性分析脂质组学
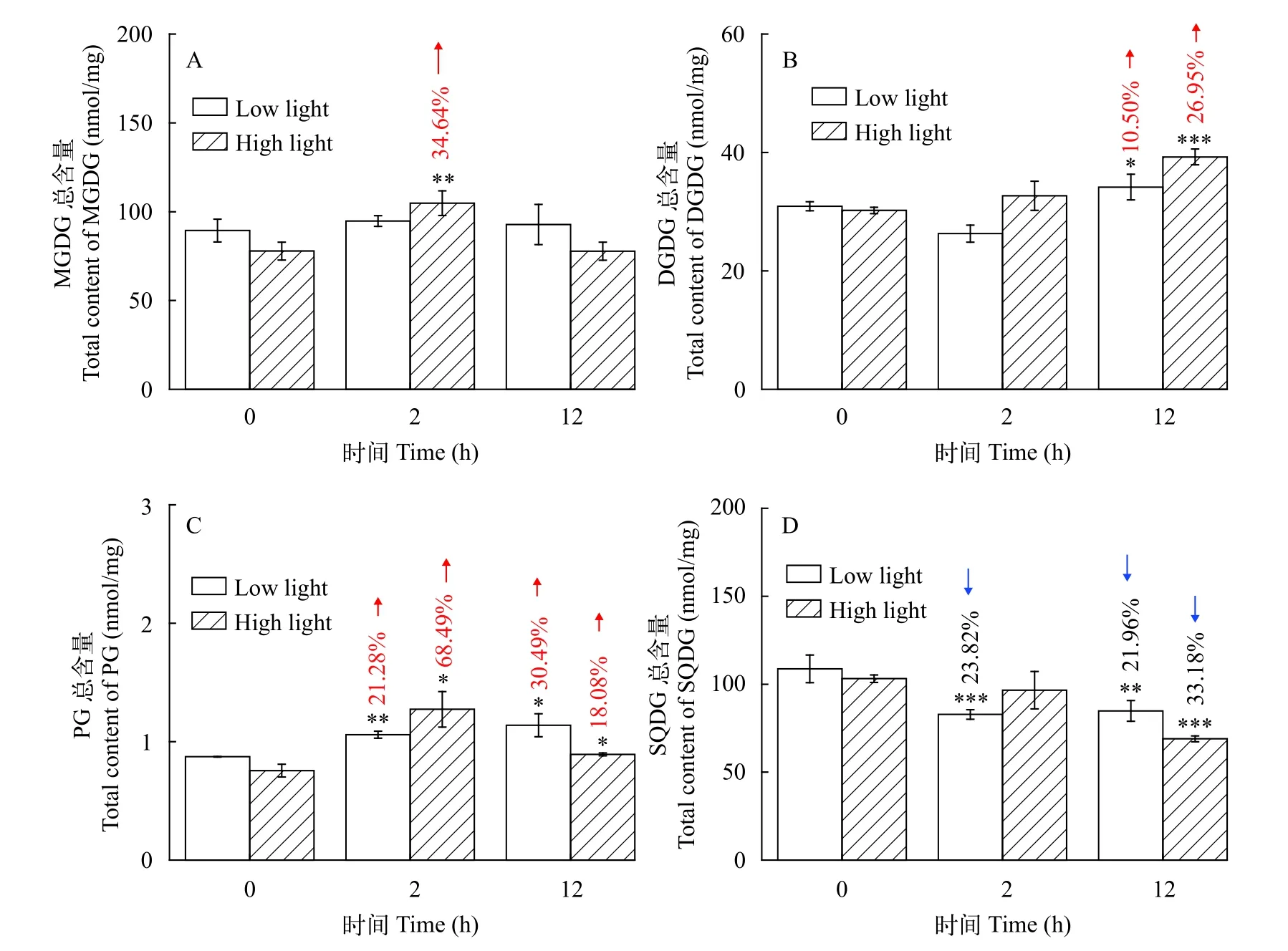
图3 Synechocystis sp.PCC 6803 在低光及高光条件下(A、B、C和D)各甘油酯总含量的变化(*P<0.05, **P<0.01, ***P<0.001)Fig.3 Total contents of the various glycerolipids of Synechocystis sp.PCC 6803 grown under low light and high light condition (A, B, C,D) (*P<0.05, **P<0.01, ***P<0.001)
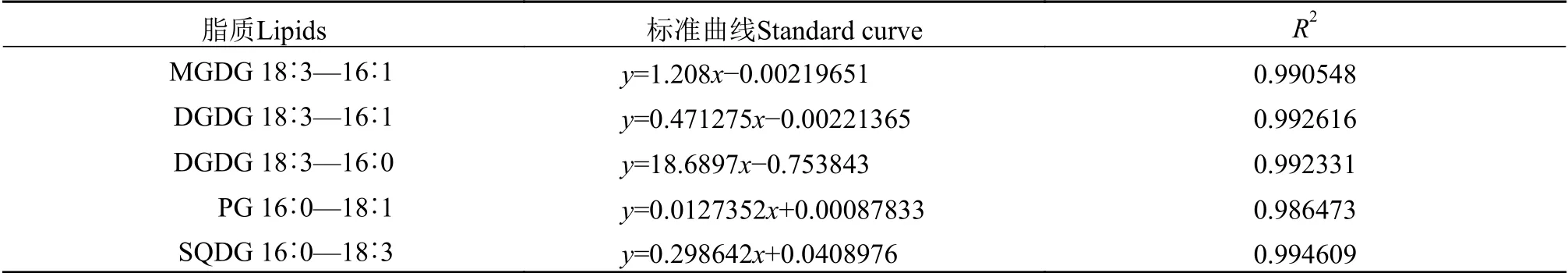
表3 脂质标准样品的标准曲线Tab.3 The standard curve of the lipid standards
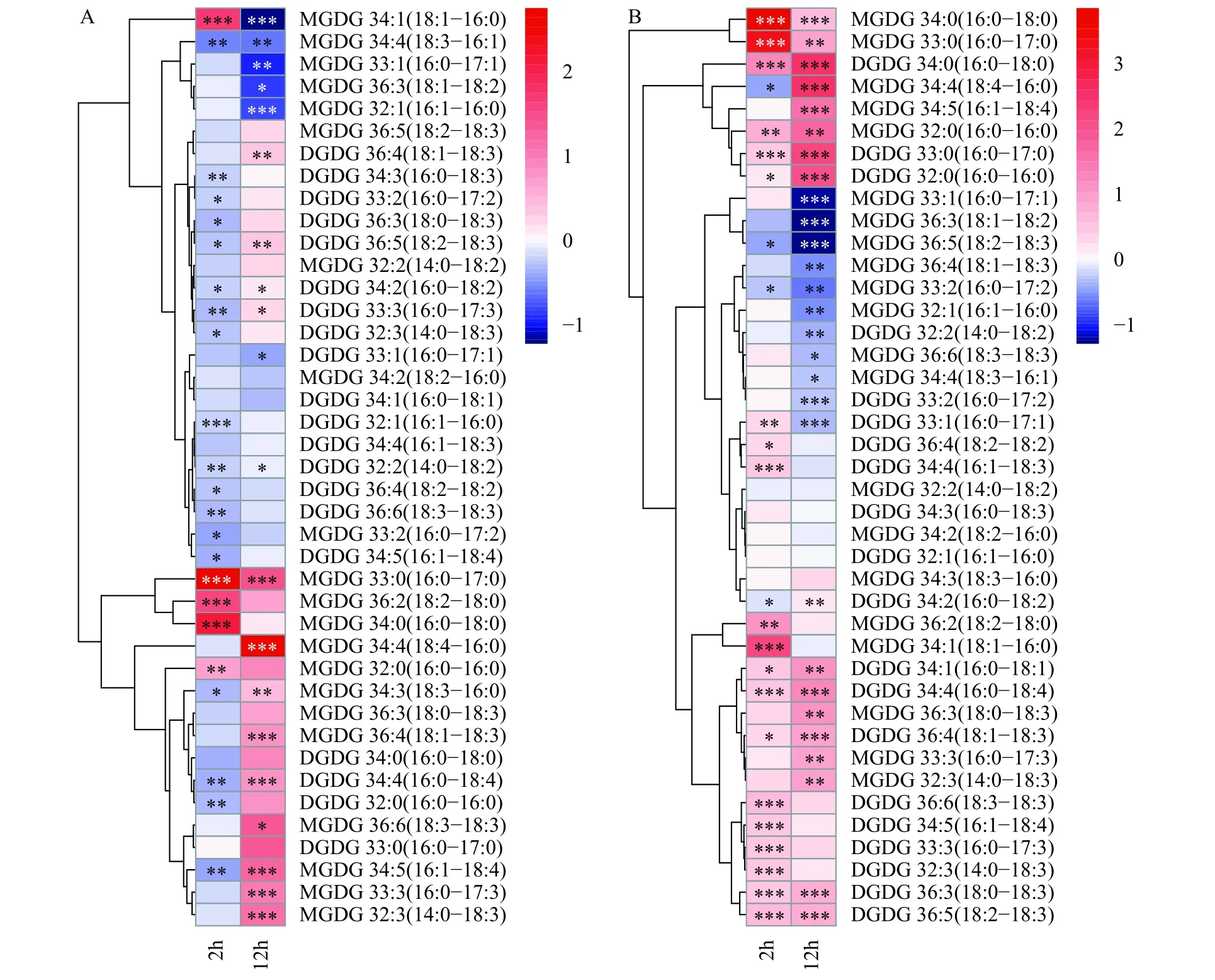
图4 Synechocystis sp.PCC 6803 在低光强(A)和高光强(B)条件下各种MGDG和DGDG分子的含量倍数变化Fig.4 Fold-changes of MGDG and DGDG contents in the Synechocystis sp.PCC 6803 cells grown under low light (A) and high light (B)conditions
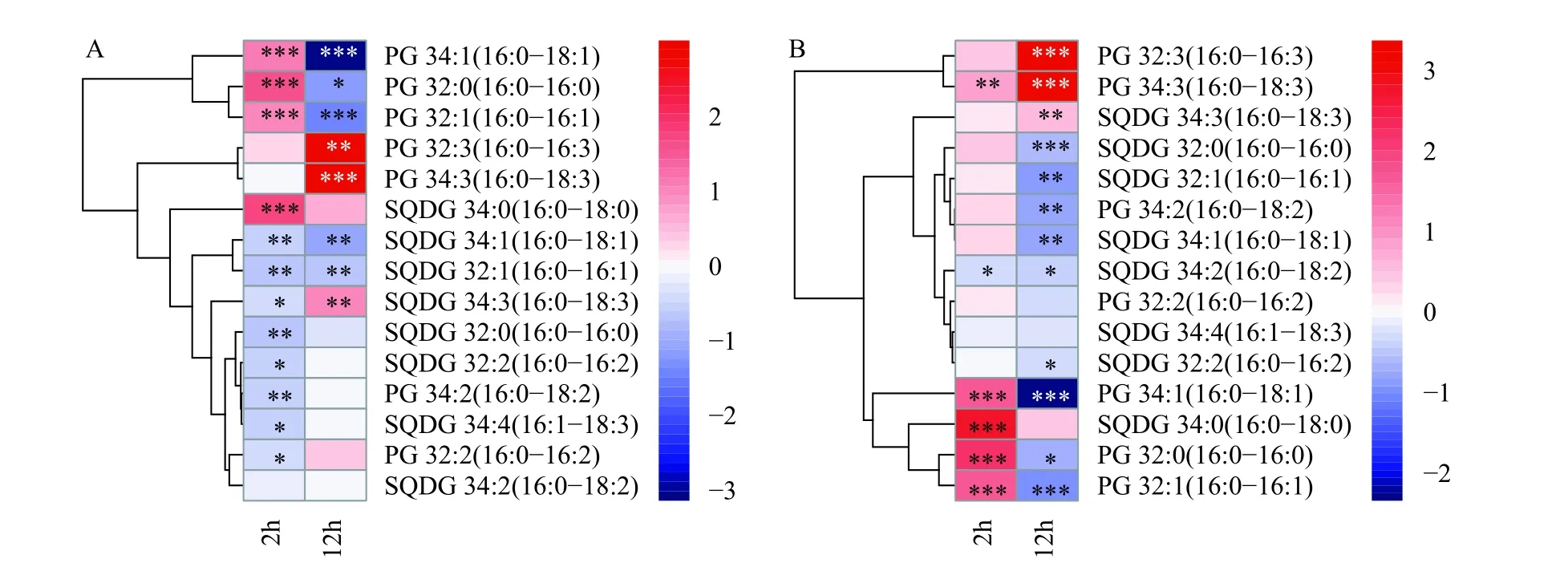
图5 Synechocystis sp.PCC 6803 在低光强(A)和高光强(B)条件下各种PG和SQDG分子含量的倍数变化情况Fig.5 Fold-changes of PG and SQDG contents of the PG and SQDG molecules of the Synechocystis sp.PCC 6803 cells under low light(A) and high light (B) condition
本文建立了超高效液相色谱耦合串联质谱法,对Synechocystis sp.PCC 6803进行了脂质组学分析。结果表明, 该方法能有效地分析鉴定极性甘油酯MGDG、DGDG、PG和SQDG, 包括油脂组成类型及其所含酰基种类。该方法具有样品需求量小且前处理少, 检测精度、准度和稳定度高等特点,能在13—15min内快速分析鉴定全细胞脂质组分等优点。糖脂MGDG、DGDG和SQDG中的优势种主要为十八碳三烯酸(C18∶3)和十六碳烯酸(C16∶0)或十六碳烯酸(C16∶1)等偶数脂肪酸链[23]。经GCMS鉴定, 在包括Synechocystissp.PCC 6803在内的多种蓝藻中有C17∶1和C17∶0等奇数脂肪酸链的存在, 但不能判断所在的甘油酯种类[24]。文献报道HPLCESI/MS首次应用于Synechococcussp.PCC7002脂质组学分析中, 并在SQDG中发现了含有17个碳原子的脂肪酸链C17[25]。但相较而言, 运用本文中所建立的方法能够在分子水平上有效分离并监测到更多甘油酯种类。本研究在MGDG和DGDG中发现了经酯化的脂肪酸链C17∶0、C17∶1、C17∶2 和C17∶3, 说明蓝藻所含甘油酯中存在奇数脂肪酸链并不是特例。在念珠藻中通过同位素标记法证实了藻类可以合成奇数的脂肪酸链, 甲硫氨酸甲基特异性添加到十八碳烯酸的双键中, 在双键上插入一个亚甲基基团后进行脱羧和开环, 得到等量的7-和8-甲基十七烷的混合物[26]。
3.2 Synechocystis sp.PCC 6803各脂质组分全定量分析
本研究所建立的定量法的线性关系良好, 准确地定量了脂质总含量和各不同酰基组成的甘油酯含量。早期的研究表明光合作用生物细胞的脂质成分都主要由3种甘油糖脂和1种磷脂组成。采用TLC分离定量方法得到蓝藻中各组分约占46.2%MGDG、17.9% DGDG、25% SQDG和10.3% PG[27],运用本文中建立的脂质组学分析方法测得结果为44.8% MGDG、19.9% DGDG、30.6% SQDG和4.7% PG, 与文献中报道的各甘油酯占比接近, 验证了该定量法对Synechocystissp.PCC 6803有效可行。该方法能有效应用于深入研究光合作用相关甘油酯各组分的动态变化情况。传统的经TLC分离和GC-MS鉴定仅能揭示C16∶0约占总脂肪酸含量的83.0%—86.4%, 是最丰富的脂肪酸种类[28]。在本研究中, 凭借超高效液相色谱耦合串联质谱法进行定量分析, 进一步发现了18∶2/16∶0在Synechocystissp.PCC 6803的4种光合甘油酯中所占比例最高, 是丰度最高的分子。
3.3 高光适应过程中Synechocystis sp.PCC 6803各脂质组分变化情况
在从低光强到高光强适应过程中,Synechocystissp.PCC 6803所含各甘油酯除SQDG外都呈现增长的趋势。在衣藻细胞的脂质组学分析中, 4种甘油酯受光照的刺激下都起始于一个相对较高的浓度然后逐渐减少直到10h后几乎保持不变, 其中MGDG和SQDG在光的开始阶段0.25h内急剧增加,而PG和DGDG持续增加至2h[29]。因此, 无论是真核生物还是原核生物, 都需要在光照增强时增加所有膜脂的合成水平, 以扩大膜面积促进细胞增殖或诱导光合作用。在更高的光强下持续一段时间之后MGDG、PG和SQDG的总含量的减少, 推测可能和高光强条件下光系统Ⅱ(PSⅡ)和光系统Ⅰ(PSⅠ)的下调有关[30,31]。4种甘油酯对光强变化(从低光到高光)表现出不同的变化趋势, 这可能是由于它们在光合膜中的分布不均匀和功能作用不同造成的[29,32]。
已有的研究表明, 甘油酯中除头部基团外[33],其特定的酰基组成同样可以影响膜的流动性和光合作用元件的扩散[34]。深入了解各甘油酯在分子水平上的流动方向, 有助于更好地理解光合作用生物如何适应复杂的环境变化。不同酰基组成的各甘油酯含量比总脂含量更加多样化和多变。C18∶1和C16∶0是最主要的从头合成的脂肪酸并被整合进极性甘油酯,Dictyopteris membranacea中发现PG是从头合成脂肪酸的主要受体[35], 而后逐步去饱和化为C18∶3和C16∶3[36]。因此, 在第2小时开始显著增加的PG 18∶1/16∶0很可能是通过酯化从头合成脂肪酸所合成。同样, 高饱和度酰基组成的MGDG也可能涉及固定从头合成的脂肪酸。而在高光适应2—12h过程中, 脂质普遍由高饱和度酰基组成向高不饱和度酰基组成转变的趋势, 可能是细胞为适应高光的胁迫条件而提高脂肪酸的不饱和度, 增加细胞流动性Zakar等[37]对Synechocystissp.PCC 6803的研究中也有类似推论, 脂质的不饱和度和叶黄素都参与提供适当结构的膜环境, 以保护藻细胞免受光和温度的胁迫。另外MGDG组成的改变可能通过酰基链诱导改变甘油酯的形状, 从而介导MGDG在整合于双层膜内和游离于膜外等不同的组合形态之间转换, 维持光合作用蛋白元件的有序排列以发挥其功能[38,39]。
本研究为探索微藻的脂质分子结构与其生理功能之间的关系提供了一种有效手段, 高光适应过程中脂质含量和代谢动态变化的背后生物学机制还有待进一步研究。

