超高效液相色谱-串联质谱法定量分析尿液中色氨酸及其代谢产物
李 慧, 崔兰冲, 章国磊, 张萌萌, 焦丽丽, 吴 巍*
(1. 长春中医药大学, 吉林省人参科学研究院, 吉林 长春 130117; 2. 长春中医药大学药学院, 吉林 长春 130117)
色氨酸(Trp)又称α-氨基β-吲哚丙酸[1],是人体必需的氨基酸之一[2]。人体每天需要的Trp来自内源蛋白质的分解和食物的消化吸收,这些Trp除用于蛋白质生物合成外,主要在肝、肾、脑等组织器官发生代谢[3,4]。Trp会在吲哚胺-2,3-双加氧酶、单胺氧化酶、犬尿甲酰胺酶等的作用下通过Trp-5-羟色胺(5-HT)和Trp-犬尿氨酸(Kyn)两条主要途径降解并排出体外[5,6]。受机体饮食、活动量以及机体状态的影响,每天摄入的Trp以及参与代谢的酶会发生变化,这些细小的变化如果逐渐积累放大,就会造成机体代谢状态的差异,最终导致疾病的发生。研究表明,肿瘤、感染性疾病、神经性疾病等均伴随发生Trp的代谢紊乱[7,8],了解Trp及其代谢产物在正常个体日常状态下的排泄规律对Trp相关疾病的普查、健康状态的监测,以及疾病的早期诊断都具有重要意义。
Trp及其代谢产物在体内含量低,检测难度较大。近年来,利用Trp及其代谢产物的紫外、荧光、电化学性质,可以采用的检测方法有高效液相色谱法(HPLC)[9]、高效毛细管电泳法(HPCE)[10]和高效液相色谱-质谱法[11](HPLC-MS)等。其中HPLC-MS由于其高度特异性及准确性成为当前的研究热点[12]。然而,现有文献关于Trp及其代谢产物的研究报道多集中在疾病个体和正常个体的区分,如Cheng等[13]发现肾功能不全患者血浆Trp和其代谢产物的含量较高;Heilman等[14]发现血液中Trp及其代谢产物含量可以用于评估帕金森患者病情;吴智明等[15]发现大肠癌患者尿液Kyn与Trp比值较对照组显著提高。这些报道研究多采用多时间点收集的尿液进行检测和比较,并不能反映某一时间点机体代谢产物的含量情况。Trp的吸收和排泄是正常机体每天都需要进行的生理过程,受食物摄入和活动量变化的影响较大[16]。了解健康志愿者随机尿样中Trp及其代谢产物的水平是Trp等相关代谢产物用于疾病诊断的基础。本实验基于超高效液相色谱-串联质谱法(UPLC-MS/MS),采用丹磺酰氯(DNS-Cl)柱前衍生化技术对目标化合物进行衍生,建立了Trp及其代谢产物的定量分析方法,并应用该方法研究了健康志愿者随机尿样中Trp及其代谢产物的含量,探索其在尿液中的排泄规律,为临床疾病的诊断提供理论支持。
1 实验部分
1.1 仪器、试剂与材料
Ultimate 3000型超高效液相色谱系统、TSQ Endura三重四极杆质谱仪(Thermo Fisher Scientific公司,美国); AG 22331低温高速离心机(Eppendorf公司,德国); MTN-2800D氮吹浓缩装置(天津奥特赛斯仪器有限公司,中国); SQP电子分析天平(北京赛多利斯科学仪器有限公司,中国); RCT-3200超纯化水机(莱博帕特科技发展有限公司,中国)。
3-OH-犬尿氨酸(3-OH-Kyn,纯度98%)(美国Sigma公司)、Trp(纯度>98.0%)、5-HT(纯度>98.0%); 3-OH-邻氨基苯甲酸(3-OH-AA,纯度98%,上海麦克林生化科技有限公司);黄尿酸(XA,纯度>96.0%,梯希爱上海化成工业发展有限公司);犬尿喹啉酸(KA,纯度>98.0%,上海源叶生物科技有限公司); Kyn(纯度>98.0%,阿拉丁试剂(上海)有限公司); 5-羟吲哚乙酸(5-HIAA,纯度>98.0%,美国Alfa Aesar公司);肌酐(Cr,纯度>98.0%,上海源叶生物科技有限公司);内标咖啡酸(CA,纯度99.9%,日本TCI公司); DNS-Cl纯度99%,北京百灵威科技有限公司);甲醇、甲酸、乙腈(色谱纯,美国Tedia公司)。
尿液样本的采集对象为吉林省长春市的7名健康男性,年龄为20~22岁,所有参与志愿者在采样前均详细阅读并签署了知情同意书。
1.2 实验方法
1.2.1色谱及质谱条件
色谱柱:Thermo C18色谱柱(50 mm×3 mm, 2.7 μm);柱温:35 ℃;样品室温度:4 ℃;流动相:A为0.1%甲酸水溶液,B为甲醇;流速:0.2 mL/min。梯度洗脱程序:0~3.0 min, 30%B; 3.0~9.0 min, 30%B~95%B; 9.0~12.0 min, 95%B; 12.0~12.5 min, 95%B~30%B; 12.5~17.0 min, 30%B。进样量:2 μL。
采用电喷雾电离方式进行离子化,正离子、多反应监测(MRM)模式扫描。扫描范围:m/z100~1 000;喷雾电压:4 000 V;鞘气压力:6.125 MPa;辅助气压力:0.875 MPa;传输毛细管温度:350 ℃;雾化器温度:300 ℃;针泵进样。数据采用Thermo Xcalibar软件进行分析。待测物的碰撞能量(CE)、RF透镜电压(RF lens)和其他质谱参数见表1。
1.2.2样品的收集与处理
于每天11∶00~13∶00在洁净容器中收集中段尿液10 mL,取1 mL,加入100 μL 1%甲酸水溶液,混匀后,以5 000 r/min离心10 min,取上清200 μL,于-80 ℃避光冷冻,备用,分析时,尿样于4 ℃下解冻。
向尿液样品中加入50 μL 100 μg/mL的CA和含8 mg/L DNS-Cl的乙腈溶液200 μL,混匀,加入400 μL 0.1 mol/L Na2CO3-NaHCO3缓冲溶液,涡旋,于60 ℃金属浴加热20 min。再次向反应体系中加入16 μL 0.5 mol/L三乙胺溶液。反应30 min后加入15%甲酸水溶液16 μL,终止反应,过0.22 μm微孔滤膜,备用。衍生反应的结构通式见图1。
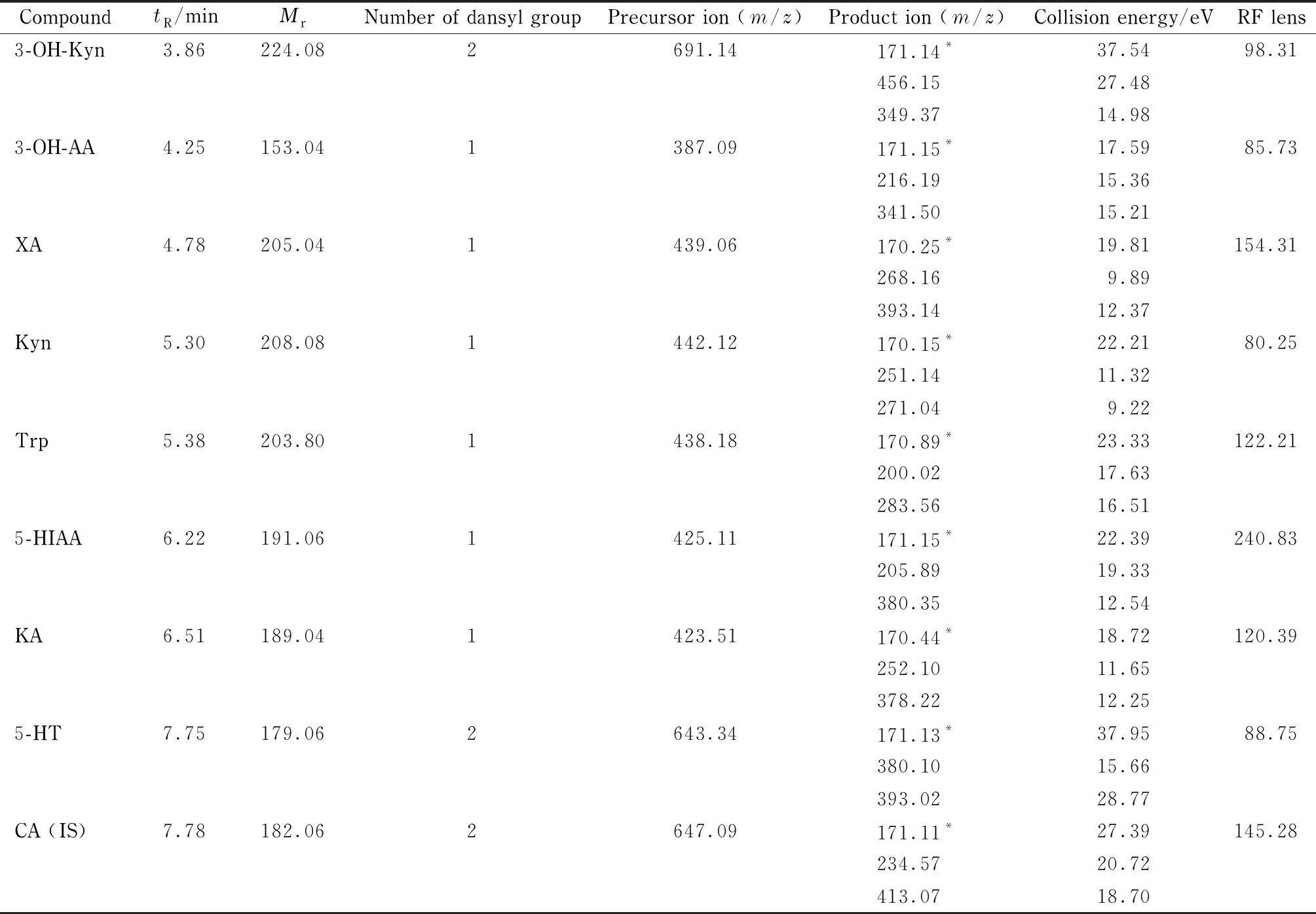
表 1 目标化合物的质谱参数
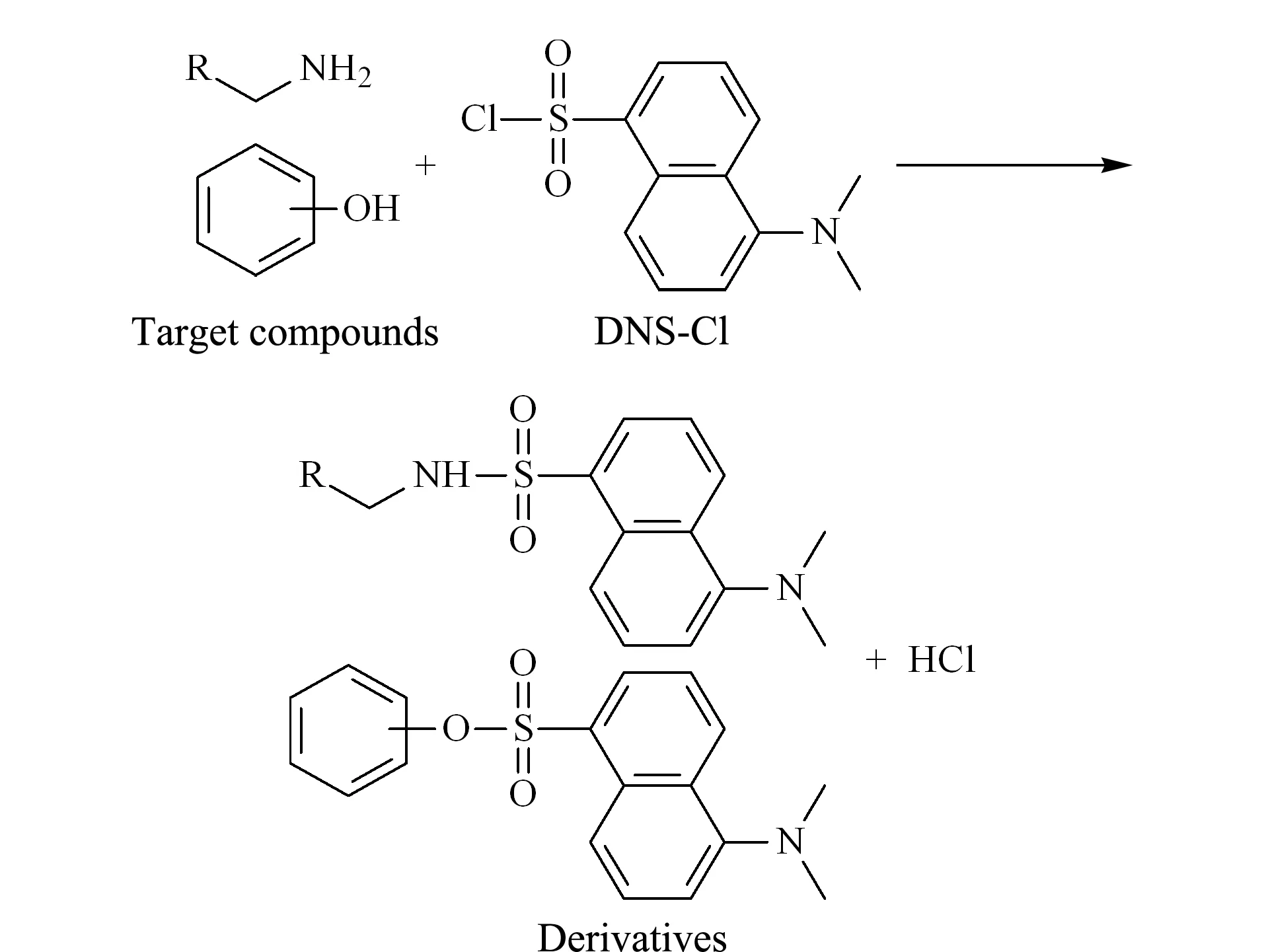
图 1 丹磺酰氯的衍生反应
配制含有3.0 mmol/L MgCl2·6H2O、3.8 mmol/L CaCl2·2H2O、14.5 mmol/L Na2SO4、72.1 mmol/L NaCl、2.2 mmol/L C6H5Na3O7·2H2O、18.7 mmol/L KH2PO4、0.15 mmol/L Na2C2O4、19.3 mmol/L KCl、17.2 mmol/L NH4Cl、41.6 mmol/L 尿素和9.3 mmol/L Cr的人工尿样(pH=7.4)模拟空白基质。在空白基质中加入不同浓度的标准溶液作为质控(QC)样本用于监控分析序列的重复性和稳定性,处理方法同上。
2 结果与讨论
2.1 色谱及质谱条件的优化
本实验所测定的化合物含有氮原子,相对分子质量较小,在正离子扫描模式下,[M+H]+强度很弱,难以检测,且易发生源内裂解,检测难度较大。同时,由于极性原因,目标化合物与尿液中强极性化合物一同流出,基质效应较大。本实验以丹磺酰氯为衍生化试剂,采用柱前衍生的方法对尿液中Trp及其代谢产物进行衍生。
丹磺酰氯是一种强荧光剂,基团上的磺酰基能够与伯胺、仲胺以及酚羟基发生取代反应,提高化合物的相对分子质量,同时丹磺酰氯衍生后还可以改善待测物的极性,延长保留时间,提高检测灵敏度。待测物的二级质谱图见图2。
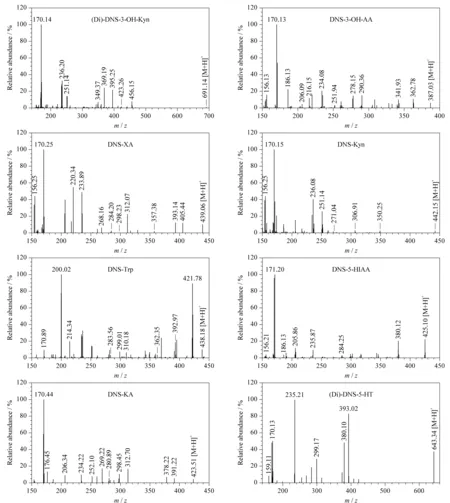
图 2衍生产物的二级质谱图
2.2 方法学考察
待测化合物属于内源性物质,本研究依据《中国药典》(2015版)中“生物样品定量分析方法验证指导原则”,采用人工尿样作为空白基质,向其中添加标准品的方法进行方法学验证,考察了方法的专属性、线性范围、精密度、稳定性和回收率。
2.2.1专属性
精密量取人工尿液样本,加入不同浓度的混合标准溶液,建立空白基质匹配标准曲线。按1.2.2节处理空白人工尿液和实际尿液,并将混合标准溶液加入人工尿液中,分别得到空白人工尿液、实际尿液和加标尿样的提取离子流色谱图(见图3)。

图 3 衍生产物的提取离子流色谱图
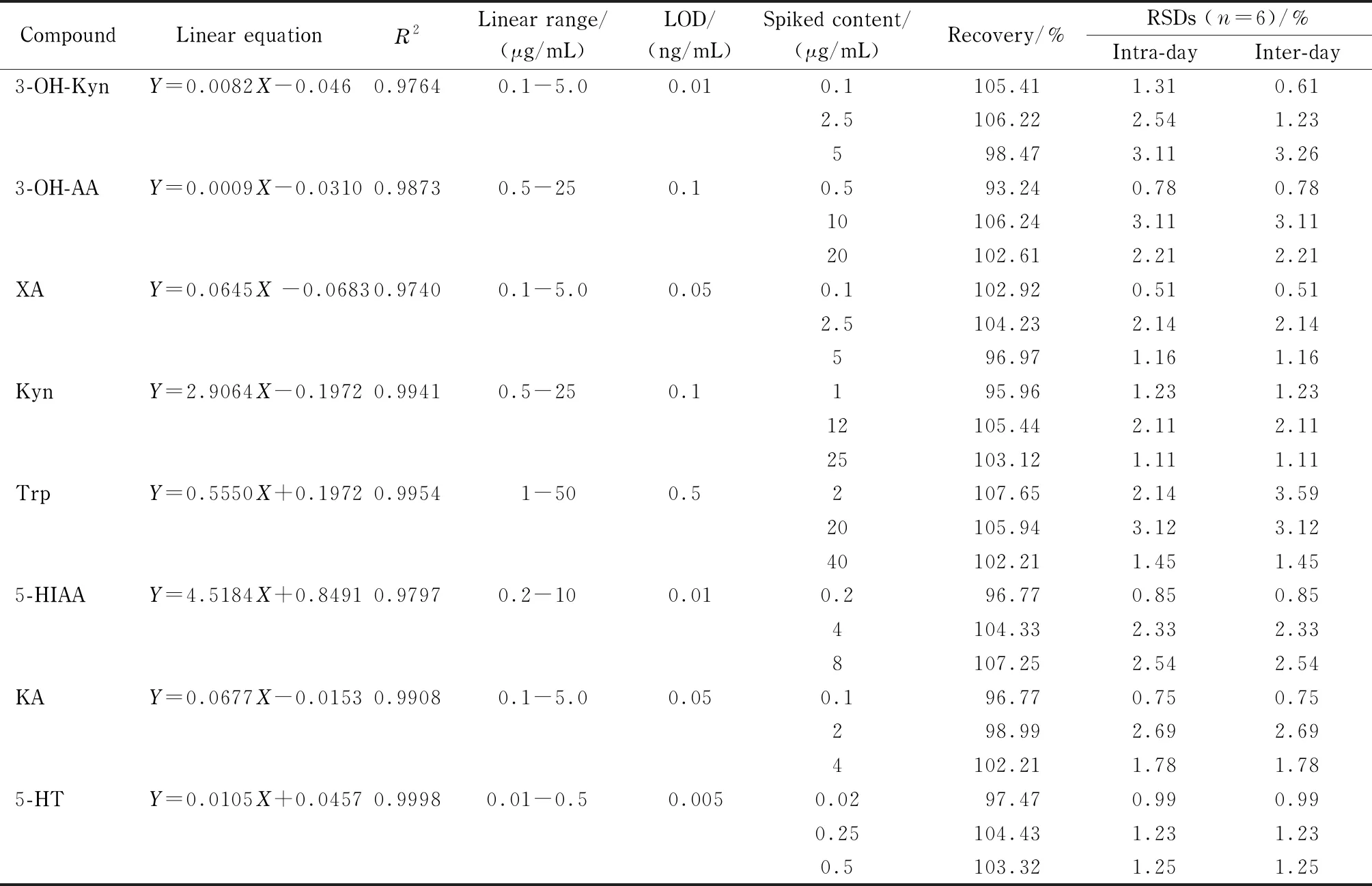
表 2 目标化合物的线性方程、相关系数、线性范围、检出限、回收率和精密度
通过提取离子流色谱图分析可知,人工尿液中只有Cr峰,而无其他目标化合物(见图3a),图3b中待分析物的保留时间与图3c中标准品一致。说明本方法的专属性良好。
2.2.2线性范围与检出限
在优化后的条件下对系列混合标准溶液进行分析,并以浓度为横坐标、目标化合物与内标(CA)峰面积比值为纵坐标,绘制标准曲线。结果表明,8种目标化合物各自范围内有良好的线性关系,相关系数(R2)≥0.974 0。检出限(LOD)以3倍的信噪比计算,8种目标化合物的LOD为0.005~0.5 ng/mL(见表2)。
2.2.3回收率和精密度
在空白基质(人工尿样)中分别添加高、中、低3种不同水平的混合标准溶液,进行方法回收率的验证,各目标化合物加标水平见表2。结果表明,目标化合物的回收率为93.24%~107.65%。每种水平各6份,连续测定3 d,计算日内和日间精密度,结果分别为0.51%~3.12%和0.51%~3.59%。
2.2.4稳定性
取人工尿液样本,加入线性范围中高点和低点两个水平的混合标准溶液,每个水平制备3个平行样本,分别考察样品在室温放置6 h、反复冻融3次、-80 ℃冻存10 d及经处理后室温放置24 h后的稳定性。
结果表明,在上述考察条件下,目标化合物含量的标准偏差均小于15%,表明样品在上述条件下均保持稳定。
2.3 尿液测定结果
将尿液进行处理和分析,得到尿液中目标化合物的含量。7名健康志愿者的尿样连续测定10 d,结果见图4。
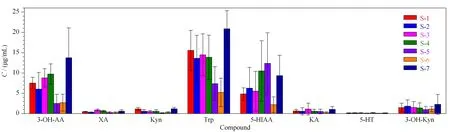
图 4 7名志愿者尿样中目标化合物的含量(平均值±SD,n=10)
尿液中的Trp主要来源于食物中外源性的氨基酸和机体内源性蛋白质的分解[17],由于志愿者未受运动和饮食限制,尿样的色氨酸含量可能会受到饮食和运动影响。
经测定,志愿者的尿中Trp的含量波动范围为1.71~25.34 μg/mL,经代谢后排泄的Trp是原型量的124%~268%。在Trp的两条代谢途径中,经Kyn途径生成Kyn、KA、3-OH-Kyn、3-OH-AA和XA,尿液中的含量分别是0.99~3.72 (3-OH-Kyn)、2.51~21.11 (3-OH-AA)、0.25~1.12 (XA)、0.15~1.53 (Kyn)和0.24~2.58 (KA) μg/mL;经5-HT途径生成的5-HT和5-HIAA,含量分别为0~0.31 μg/mL(5-HT)和2.2~17.94 μg/mL(5-HIAA)。Kyn途径代谢产物含量是5-HT代谢途径相关产物的104%~176%,说明Trp经Kyn降解生成3-OH-AA和3-OH-Kyn的是Trp的主要代谢产物。尿中的Trp-Kyn代谢产物的测定结果与已有报道[18]结果一致。经统计学分析,受试者6(S-6)和受试者7(S-7)间差异较明显(P<0.05),其余受试者均不存在显著性差异。
有文献报道[19-21]将肌酐作为内参,通过其他化合物浓度与肌酐含量的比值来进行计算。本方法也以肌酐含量为基准,比较了目标化合物含量在不同尿样中的差异,并没有发现不同个体尿样中目标化合物含量有显著性差异。
3 结论
本文基于UPLC-MS/MS技术建立了一种测定Trp及其代谢产物的定量方法。该方法采用DNS-Cl对目标化合物进行衍生,方法灵敏度高,重复性好,可以实现尿液中目标化合物的准确定量。