免疫检查点抑制剂所致内分泌不良反应处理流程研究进展
罗景梅,杨中策,潘俐,张丽华
昆明医科大学第一附属医院全科医学科,昆明 650032
抗癌免疫治疗是指通过促进淋巴细胞活化,破坏肿瘤诱导的免疫耐受,以充分恢复对肿瘤的免疫反应,从而破坏癌细胞,抵消癌细胞产生的免疫抑制信号[1-2]。免疫检查点抑制剂(immune checkpoint inhibitors,ICIs)是近年来出现的一种新型抗癌免疫治疗药物,是一种专门针对T细胞上抑制性受体的单克隆自身抗体,包括细胞毒性T淋巴细胞抗原4 (CTLA-4)、程序性死亡受体1(PD-1)及程序性死亡受体配体1(PD-L1)。目前,美国食品与药品管理局(FDA)已批准6种ICIs用于治疗不同的恶性肿瘤[3](表1)。总体而言,这些药物在大多数患者中耐受性良好,且较常规化疗的毒性更小。然而,在临床应用中也发现了与这些药物免疫激活有关的独特毒性谱,即免疫相关不良反应(immune-related adverse effects,irAEs)。所有irAEs在病因学上均为自身免疫性疾病,主要影响皮肤、胃肠道、内分泌及肝脏等组织[4]。美国国立癌症研究所提供了一个irAEs评分系统,根据国际不良事件通用术语标准(CTCAE),毒性等级从轻中度(1~2级)到重度(3~4级),直至死亡(5级)[5]。尽管大多数irAEs不严重,且可通过治疗逆转,但如不能及时识别或处理不当,可危及患者生命。本文通过介绍免疫治疗中ICIs导致的内分泌性irAEs,进一步阐述这类不良反应的处理流程,旨在为临床医师处理内分泌性irAEs提供思路。

表1 FDA批准的免疫检查点抑制剂及其适应证Tab.1 Immune checkpoint inhibitors and their indications that are approved by the FDA
1 ICIs所致内分泌性irAEs的类型
目前,ICIs所致内分泌性irAEs报道较多的是垂体炎及甲状腺功能异常[6],而肾上腺皮质功能减退及自身免疫性糖尿病较少见[7]。内分泌功能障碍多在第1次给药后5~36周发生,但迟发毒性反应也有报道[6,8]。有研究显示,与抗PD-1/PD-L1相比,抗CTLA-4治疗6周发生irAEs的时间更早[9]。联合使用抗CTLA-4及抗PD-1/PD-L1,出现内分泌性irAEs的时间通常早于同一患者使用单药所出现的时间[7,9]。
1.1垂体炎 垂体炎是抗CTLA-4治疗中常见的内分泌性irAEs。不同研究报道的ICIs治疗后垂体炎的发生率不同,伊匹单抗为0.0%~17.4%,替西木单抗为0.4%~5.0%,且具有明显的剂量依赖关系;抗PD-1或抗PD-L1治疗所致的内分泌性irAEs发生率<1%[6-7,9];通常发生在起始治疗后的6~12周(中位时间11周)[7]。抗CTLA-4及抗PD-1治疗所诱导的垂体炎发生机制不同。抗CTLA-4诱导的垂体炎与Ⅱ型及Ⅳ型超敏反应相关,而抗PD-1诱导的垂体炎与IgG4相关垂体炎的发病机制相似[10]。ICIs最常累及垂体前叶(腺垂体炎),临床主要表现为头痛、乏力、恶心、虚弱、厌食、低血压、女性闭经、男性勃起功能障碍及性欲减退。然而,并非所有的内分泌轴都会受影响,ICIs相关性垂体炎的临床表现与经典的淋巴细胞性自身免疫性垂体炎(LAH)明显不同。首先,在ICIs诱导下,促肾上腺皮质激素(ACTH)及促甲状腺激素(TSH)的分泌通常会受到抑制,性腺轴也会受到影响,而生长激素缺乏罕见,催乳素水平可能升高也可能降低[11]。其次,ICIs相关性垂体炎中垂体肿大引起的头痛不如LAH严重,而且由于垂体未增大至压迫视交叉,所以视力障碍罕见[12]。尿崩症在ICIs相关性垂体炎中极为罕见,其出现在一定程度上提示肿瘤垂体转移而非垂体炎[11]。如果出现脱水、低血压或休克,应怀疑肾上腺危象。
1.2甲状腺功能异常 甲状腺功能异常为ICIs最常见的内分泌性irAEs,其发生率在抗PD-1治疗中高达40%,在抗CTLA-4治疗中为1%~7%。其发生时间常在首次治疗后的6周[7,9,13],但具体发病机制尚不明确。有研究发现,ICIs诱导产生的甲状腺自身抗体可能在其中发挥了重要作用[14]。Delivanis等[15]的研究显示,采用I C I s 治疗的患者外周血中CD14+CD16+单核细胞及CD56+CD16+自然杀伤细胞增多,单核细胞表面人类白细胞抗原-DR(HLA-DR)表达明显增高,说明甲状腺功能异常可能与单核细胞激活、自身免疫增强有关。此外,还有研究发现,调节性T细胞数量或功能降低,单克隆抗体与甲状腺细胞直接结合,以及患者CTLA-4及PD-L1的基因多态性表达也参与了ICIs相关性甲状腺功能异常的发生发展[13]。
ICIs相关性甲状腺功能异常在女性中更为常见,从临床甲状腺功能减退(甲减)到甲状腺功能亢进(包括Graves眼病),偶尔可发生甲状腺危象[14,16-17]。 其中,原发性甲减最多见[9,13]。当患者主诉疲乏加重、体重增加、怕冷、便秘或抑郁时,应考虑到本病。甲状腺毒症较少见,多数由一过性破坏性甲状腺炎引起,少数由Graves病(GD)引起[9,13-14],但是前者甲状腺激素过多的典型症状及体征通常不如GD明显。由于两种情况的治疗方式不同,因此,应检测TSH受体抗体(TRAb)或通过甲状腺显像中的放射性碘摄取模式(GD中呈弥漫性分布及碘摄取增加,而甲状腺炎中碘摄取减少或缺乏)辅助鉴别[14]。
1.3肾上腺皮质功能减退 肾上腺炎是一种较少见的由ICIs诱发的内分泌性irAEs,通常可导致原发性肾上腺皮质功能减退症(PAI)[18]。ICIs单药治疗时PAI的发生率<1%,而联合治疗时其发生率可升至4%~8%[19]。中位发生时间在用药后10(1.5~36.0) 周[20]。有研究发现,PAI的发生可能与抗21-羟化酶、抗肾上腺皮质抗体及CTLA-4基因多态性有关[21-22]。 PAI的临床表现源于糖皮质激素及盐皮质激素缺乏,包括恶心、虚弱、疲劳、体位性低血压、心动过速、厌食、腹痛及体重减轻等。
低钠血症是肾上腺盐皮质激素缺乏的常见结果,通常与低血容量、高钾血症及代谢性酸中毒有关,不同于继发性肾上腺皮质功能减退症的正常血容量性低钠血症,其表现为轻度代谢性碱中毒及正常血钾。因此,电解质监测是早期发现原发性及继发性肾上腺皮质功能减退症的重要手段。然而,低钠血症在肿瘤患者中比较常见,因此,还应考虑不同病因如恶性肿瘤、药物及急性疾病所致异位抗利尿激素(ADH)分泌引起的抗利尿激素不适当分泌综合征[23]。这也导致在肿瘤患者中此种内分泌性irAEs不容易被早期发现,从而增加了发生肾上腺危象的风险。
1.4自身免疫性糖尿病 ICIs相关性自身免疫性糖尿病(1型糖尿病)主要见于抗PD-1/抗PD-L1治疗后,发生率为0.1%~0.9%[24],而在抗CTLA-4治疗中罕有报道[25]。抗PD-1/抗PD-L1治疗后出现1型糖尿病的中位时间为7.5(1~52)周[20]。文献报道,某些HLA基因型如HLA-DQ2及HLA-DQ8与1型糖尿病易感性增加有关,而HLA-DR4在ICIs治疗后发生糖尿病的患者中最多见(76%)[26]。近期研究结果发现,抑制PD-1/PD-L1信号可引起CD4+Th1细胞增殖,使CD8+T细胞在胰腺组织中聚集,从而破坏胰岛细胞,导致自身免疫性糖尿病的发生[27]。胰岛β细胞的自身免疫性破坏可导致胰岛素缺乏,严重的高血糖及酮症如不治疗可演变为酮症酸中毒,短期内即可出现多尿、多饮、多食、体重减轻、恶心、呕吐、腹痛、昏迷等,最严重者可能出现暴发性1型糖尿病,表现为血清C肽极低,糖化血红蛋白无明显升高,须行永久性的胰岛素替代治疗[6,8]。本课题组2018年共诊治2例帕博利珠单抗诱发1型糖尿病的老年肿瘤患者,其中1例为暴发性1型糖尿病,予胰岛素替代治疗,至今日常生活能力基本不受影响。国内也有抗PD-1治疗致1型糖尿病的病例报 道[28],只是与国外相比病例数偏少。所以当没有糖尿病家族史及个人史的ICIs治疗患者发生高血糖时,应检测胰岛素是否缺乏,以防止酮症酸中毒的进一步发展,同时应检测血清C肽、谷氨酸脱羧酶抗体(GADA)、胰岛细胞抗体(ICA)及胰岛素抗体[29-31]。 另外,治疗剂量的糖皮质激素用于免疫介导的并发症可诱发糖尿病,并可能导致或加重高血糖[6],应引起重视。
2 ICIs所致内分泌性irAEs的检查及临床处理流程
内分泌性irAEs的临床表现及治疗与产生不良反应的ICIs类型无关,因此可采用标准化的诊断标准及治疗方案。然而,在免疫治疗前及治疗期间,应进行何种激素检测及何时进行检测目前仍未达成共识。笔者参考国外文献[32]总结了内分泌性irAEs的检查及临床处理流程(图1)。在ICIs治疗前应对甲状腺功能(TSH、FT3、FT4)及自身抗体(TPO-Ab)进行基线评估,并在每次给药前再次评估。当使用抗CTLA-4时,在治疗结束后的6个月内,因可能发生迟发性内分泌功能减退,应每4~6周重复检测一次甲状腺功能。此外,一些常规项目,如空腹血糖及电解质,须在基线检查时进行,并在治疗期间定期随访。在基线检查时评估垂体功能,包括清晨皮质醇、ACTH、催乳素(PRL)、促性腺激素及性激素(男性及绝经前闭经女性),但除非出现症状,没有必要对所有垂体功能进行定期评估。尤其应注意一些临床特征的出现,如反复低血糖、低钠血症、疲劳、低血压及休克,这可能提示原发性或继发性肾上腺皮质功能减退症。对疑似垂体炎,特别是有占位效应症状者,应行垂体MRI及内分泌血液检查。如果怀疑PAI,应检测醛固酮、肾素、皮质醇及ACTH。考虑到即使在停药后也可能出现迟发irAEs,因此,在完成周期治疗后至少在6~8个月内应监测相关生化及临床指标。国内对内分泌性irAEs的检查及处理[26-27,33]与国外文献报道[32,34-36]基本一致。但在ICIs诱发垂体炎的处理上,法国内分泌协会关于免疫治疗不良反应的指导意见[34]不建议常规监测ACTH,仅在清晨皮质醇<50 nmol/L时才检测ACTH。国内专家建议如果出现多尿、口渴、多饮,还应检测血钠、血渗透压、尿渗透压及尿比重[33]。
3 ICIs所致内分泌性irAEs的临床治疗
大多数内分泌性irAEs意味着腺体功能的永久性损害。因此,内分泌性irAEs的治疗以缺乏激素的替代及免疫抑制治疗为基础。多数情况下,不必停止免疫治疗。
3.1垂体炎 在垂体炎中,一旦出现ACTH缺乏,应首先给予氢化可的松或醋酸可的松替代治疗,皮质醇缺乏的症状缓解后可联合或应用其他激素治疗,如出现甲状腺功能减退症时使用左旋甲状腺素(LT4),低促性腺激素性性腺功能减退症时使用性激素,尿崩症时使用去氨加压素[11,37-39]。然而,目前临床医师用来治疗大多数irAEs的甲泼尼龙虽可缓解垂体炎的压迫症状,但并不适用于继发于垂体炎或肾上腺炎的急性皮质醇缺乏的治疗。急性皮质醇缺乏后的维持性类固醇治疗必须使用氢化可的松或醋酸可的松[38](表2)。
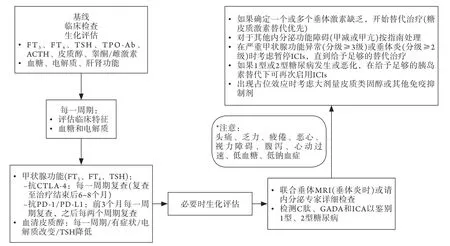
图1 ICIs所致内分泌性irAEs的检查及临床处理流程Fig.1 Flowchart of detection and clinical management of endocrine irAEs caused by ICIs
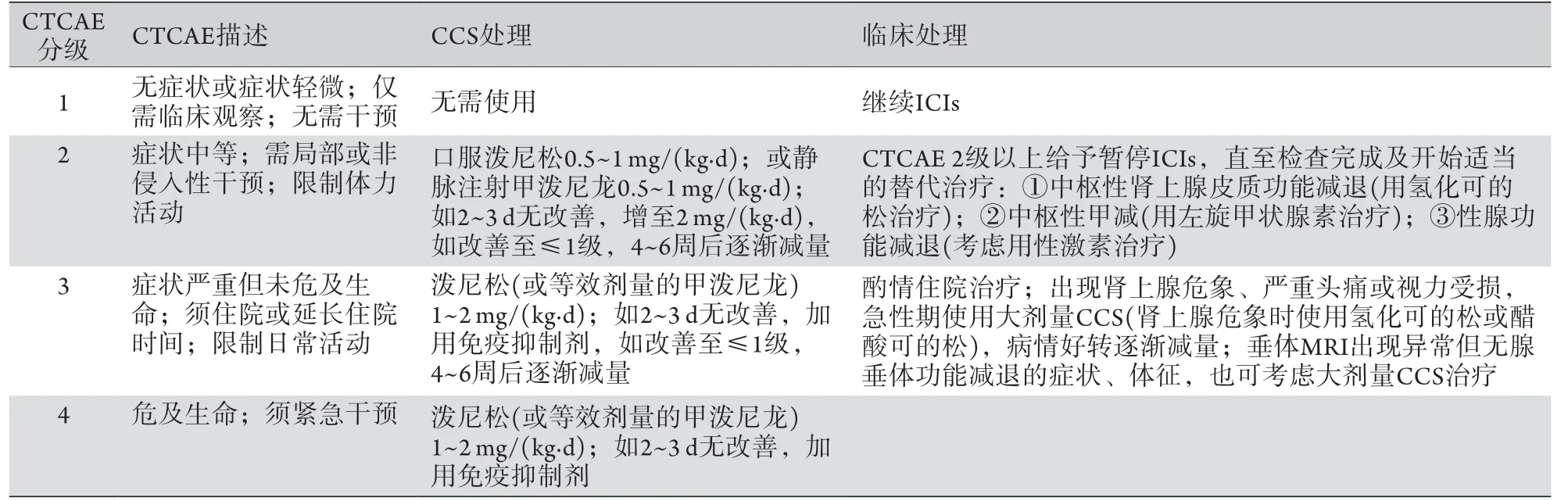
表2 垂体炎的描述及临床处理建议Tab.2 Description and proposed clinical treatment of hypophysitis
3.2甲状腺功能异常 常规处理。甲状腺功能减退症诊断明确时需使用LT4进行替代治疗。对于无危险因素的患者,可使用完全替代剂量(1.0~1.5 μg/kg); 对于老年或虚弱的患者,应以低剂量(25~50 μg/d) 开始替代治疗,并逐渐增加剂量(4 ~6 周增加12.5 μg/d),直至甲状腺功能正常。甲状腺激素替代治疗仅在排除皮质醇缺乏时使用,否则可引发肾上腺危象。甲状腺毒症的治疗取决于潜在的病因:Graves病可使用抗甲状腺药物(甲巯咪唑、卡比马唑或丙硫氧嘧啶)并逐渐减量,使用β受体阻滞剂以控制心率及症状。相反,无痛性甲状腺炎的甲状腺毒症期是一个自限性阶段,大约持续3~8周,首先应对症治疗,对有症状的患者应使用β受体阻滞剂以控制心率,在少数情况下可使用非甾体类抗炎药或口服泼尼松[35-36](表3)。
3.3肾上腺皮质功能减退 有症状的原发性肾上腺皮质功能减退症患者使用氢化可的松(15~20 mg/d) 替代治疗,必要时使用盐皮质激素(氟氢化可的松)。对于继发性皮质醇缺乏症,通常无需采用盐皮质激素替代治疗[38]。由于临床表现无特异性,而延迟治疗可使患者面临死亡风险,因此,每一位肿瘤患者在ICIs治疗过程中若出现严重不适,临床医师均应考虑到急性肾上腺功能衰竭,并迅速给予治疗[38](表4)。
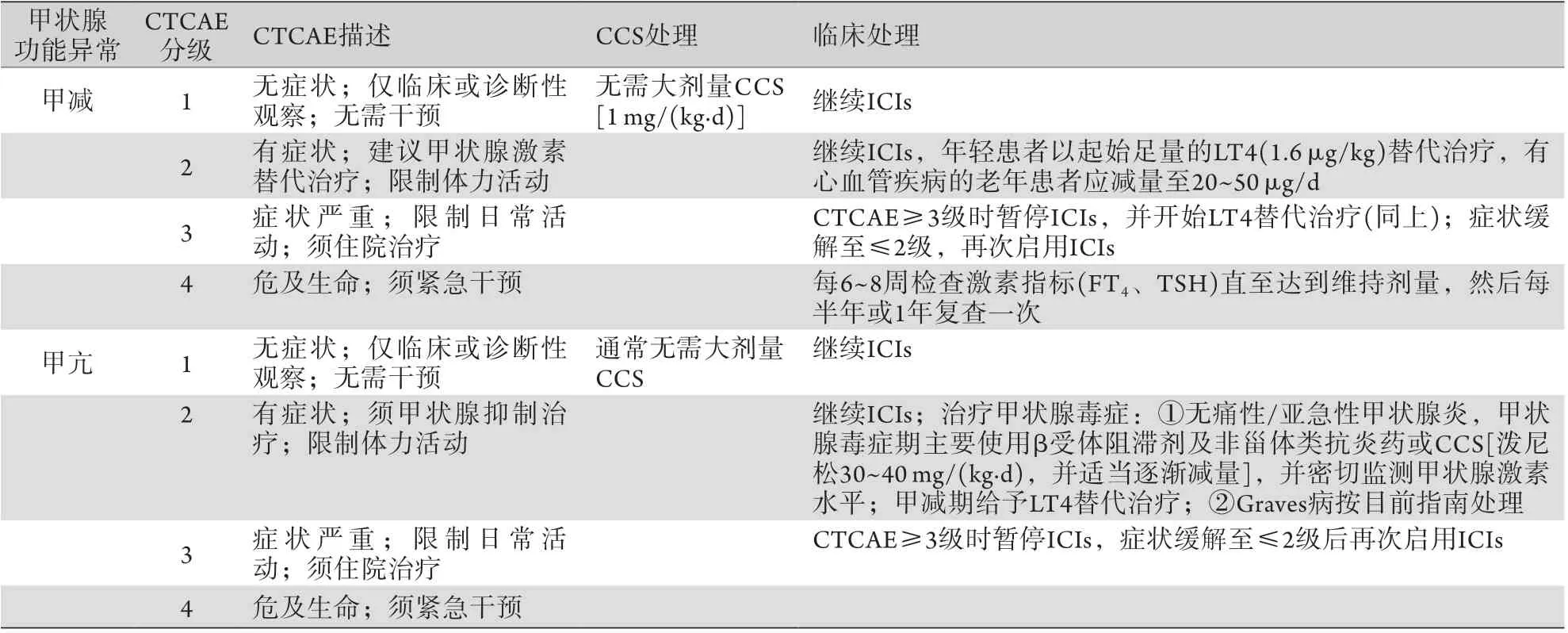
表3 甲状腺功能异常的描述及临床处理建议Tab.3 Description and proposed clinical management of thyroid disorders
3.4自身免疫性糖尿病 1型糖尿病的治疗包括基础+餐时模式下的胰岛素使用、胰岛素使用教育,以及高血糖及低血糖的处理方法。由于这些患者的预期寿命较短,必须调整1型糖尿病的治疗目标 (表4)。
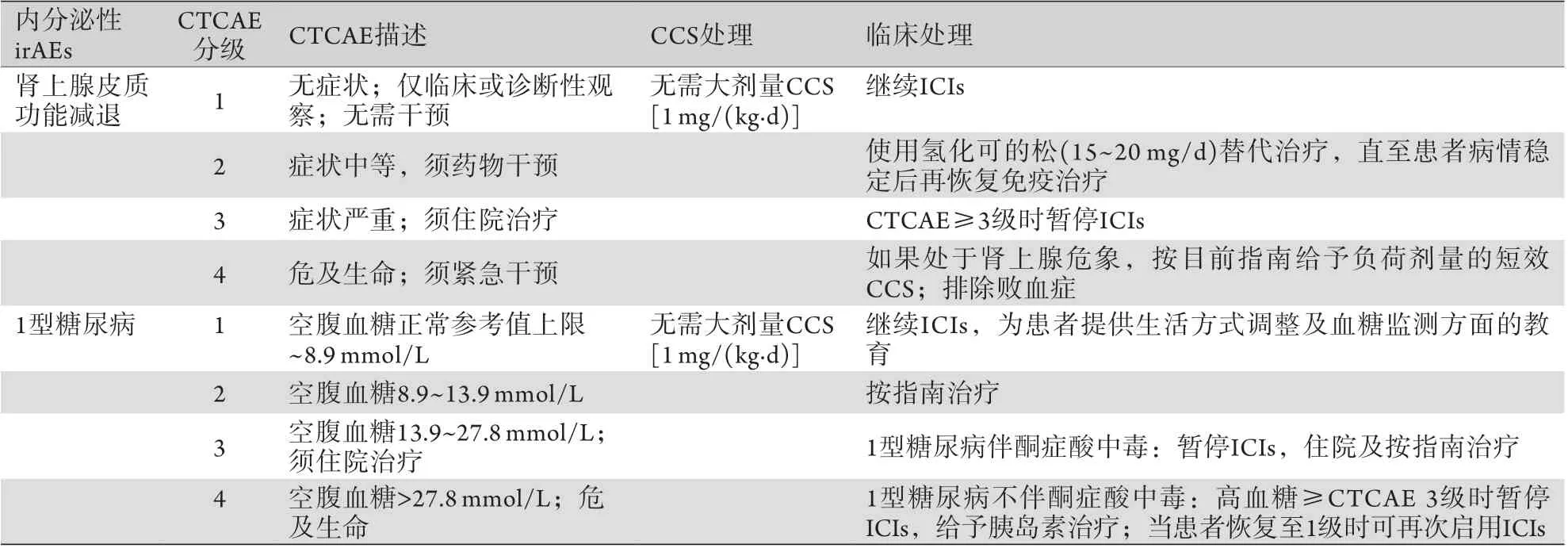
表4 肾上腺皮质功能减退及1型糖尿病的描述及临床处理建议Tab.4 Description and proposed clinical management of endocrine irAEs induced by ICIs (adrenal disorders and diabetes)
内分泌性irAEs通常无需住院治疗,但当irAEs等级≥3级(即酮症酸中毒或肾上腺危象)时,则必须住院治疗,以便进行更充分的处理[11]。对于病情较轻的患者,可在每次就诊时进行随访,间隔时间根据临床评估而定。出现内分泌性irAEs通常无需停用ICIs,只有在较严重的情况下才考虑停药。当出现激素缺乏时应开始替代治疗。
4 总结与展望
与内分泌腺体有关的irAEs较为常见,但由于ICIs价格昂贵,进入国内市场的时间不长,因此,内分泌性irAEs并未被临床医师所熟知。由于其临床表现与肿瘤本身导致的不适容易混淆,早期不易识别,尤其在甲亢危象、糖尿病酮症酸中毒、肾上腺危象等急危重症前期不易察觉,易造成延误治疗。随着肿瘤免疫治疗越来越普遍,内分泌性irAEs将更加常见,因此,内分泌及肿瘤专科医师对内分泌性irAEs临床表现的熟悉、处理流程的掌握显得格外重要。内分泌性irAEs的治疗大多数以缺乏激素的替代治疗为基础,并根据irAEs分级酌情加用免疫抑制剂(皮质类固醇或其他药物)。内分泌性irAEs引起的后果可能极其严重,因此,早期识别及治疗至关重要,建议仔细评估临床特征,定期监测内分泌及生化相关指标,并按流程进行 处理。

