白刺器官间非结构性碳水化合与C∶N∶P计量比的关联性
孙小妹, 何明珠, 杨睿哲, 李金霞, 陈年来,*
1 甘肃农业大学资源与环境学院, 兰州 730070 2 中国科学院西北生态环境资源研究院 沙坡头沙漠研究试验站, 兰州 730000 3 西北农林科技大学资源与环境学院, 杨凌 712100
碳水化合物(carbohydrate, CHO) 是植物的光合产物,为植物提供生长繁殖以及维持生命的能量。近年来越来越多的证据表明碳水化合物也是一种信号分子,它可与激素、氮素等信号联络,参与调节植物体一系列代谢活动,并形成复杂的信号网络对植物的逆境响应、生长发育进行调控[1]。CHO通常分为结构性碳水化合物 (structural carbohydrates, SCs)与非结构性碳水化合物 (non-structural carbohydrates, NSCs)[2]。SCs主要包括木质素和纤维素,是植物形态建成的主要物质;而NSCs是植物体内表征碳收支状况的能源指标,主要由具有维持细胞渗透压和抵御逆境作用的可溶性糖(Soluble sugar, SS)[3]和具有贮存作用的淀粉(starch, ST)组成[4]。淀粉白天暂时储存于叶片,长期存储在根系和茎干中,用于满足未来植物生长的需求[5]。该两者会因环境因子的改变而发生转化作用,例如,长期水分亏缺会使淀粉转化为可溶性糖,增强细胞渗透调节作用,以抵御干旱伤害,故而NSCs构成变化是植物在干旱生境下生存的一个重要特征[6- 7]。
养分吸收是荒漠植物适应水分胁迫和营养元素限制环境的另一种重要生存机制[8]。其中N和P是植物生长所需的基本元素,N主要由可溶性蛋白N和类囊体蛋白N组成。可溶性蛋白N主要是Rubisco,而类囊体蛋白N是叶绿素形成的基础;大约75%的无机氮储存在叶绿体中,直接用于光合作用[9]。植物对土壤磷的可利用性反应强烈,因为磷不仅用于满足核糖体合成蛋白质,而且对植物光合产物的运输是不可或缺的[10]。因此,植物中C∶N∶P计量比的变化直接受到光合速率的影响[11]。研究表明在遮荫状况下,乔木物种间NSCs与C、N和P的交互效应会影响植物的生存和生长策略[4]。因此,研究植物NSCs与C∶N∶P化学计量比特征的变化及其之间的关系,对于探究植物应对气候变化加剧的生命策略具有重要意义。
叶片、茎和根之间的营养分配模式反映了植物获取、运输和储存营养的能力[12]。Chapin[13]指出,茎和根不仅是结构成分,而且是植物生物合成中吸收、运输、积累和储存营养物质的关键器官。例如,在木本植物中,贮藏蛋白占总可提取蛋白的25%—30%,分布于植物的结构(纤维素)组织、树皮和根中[14]。这些储存的营养物质在干旱条件下会对叶片的生长起重要的支持作用,因为干旱条件不利于营养物质的吸收和CO2的同化。因此,为了充分了解荒漠植物适应干旱生境的生长策略,研究叶片和贮藏器官(茎和根)的营养物质和非结构性碳水化合物的积累及分配至关重要。
目前,全球气候变化和人类活动加剧问题日益严峻,气温升高、降水变化、极端气候事件增多等因素正在改变着全球陆地生态系统的结构、功能与服务[15]。荒漠植物群落由于其生态脆弱性和敏感性,对全球环境变化的响应尤为剧烈和显著。白刺(Nitrariatangutorum),双子叶多年生蒺藜科灌木,耐旱、喜盐碱、耐瘠薄,广泛分布于中国干旱地区,是荒漠、半荒漠草地植被的优势种。本研究拟通过对阿拉善地区白刺器官间C∶N∶P计量比特征和NSCs积累及分配的分析,加深对我国荒漠生态系统优势种白刺的生存和生长策略的理解,以便更好地服务于退化生态系统的恢复及荒漠化治理。
1 材料和方法
1.1 研究区概况
阿拉善高原地处内蒙古最西部( 37°24′—42°47′N,97°10′—106°53′E),占地面积约为25万km2,气候干旱,大部分地区是荒漠。年降水量变幅为40—200 mm,日照时间为2900—3400 h,年均温5.8—8.8℃。主要以荒漠化草原和典型荒漠为主,植被盖度仅为15%—30%[16]。在阿拉善高原沿国道选取典型的白刺群落,Plot1靠近省道317的敦德哈日,Plot2途经省道218靠近巴彦陶海,Plot3沿省道218靠近沙日呼鲁斯。Plot1与Plot2间直线距离64 km,Plot2与Plot3间直线距离48 km。
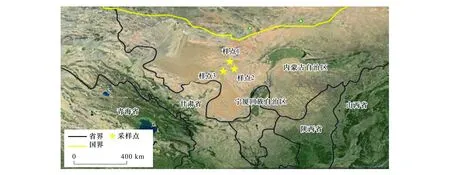
图1 样点分布图Fig.1 The location of the plot sites
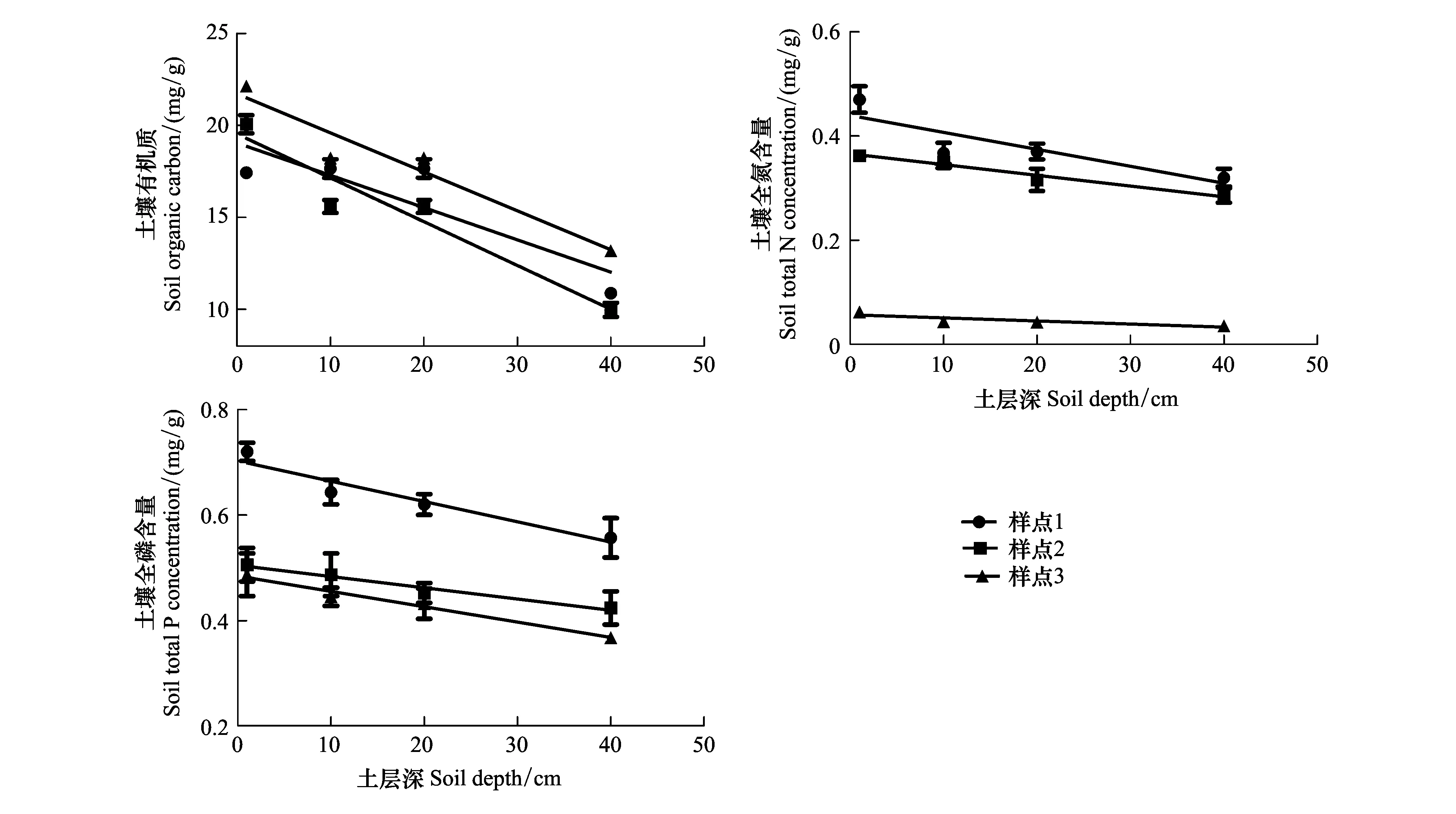
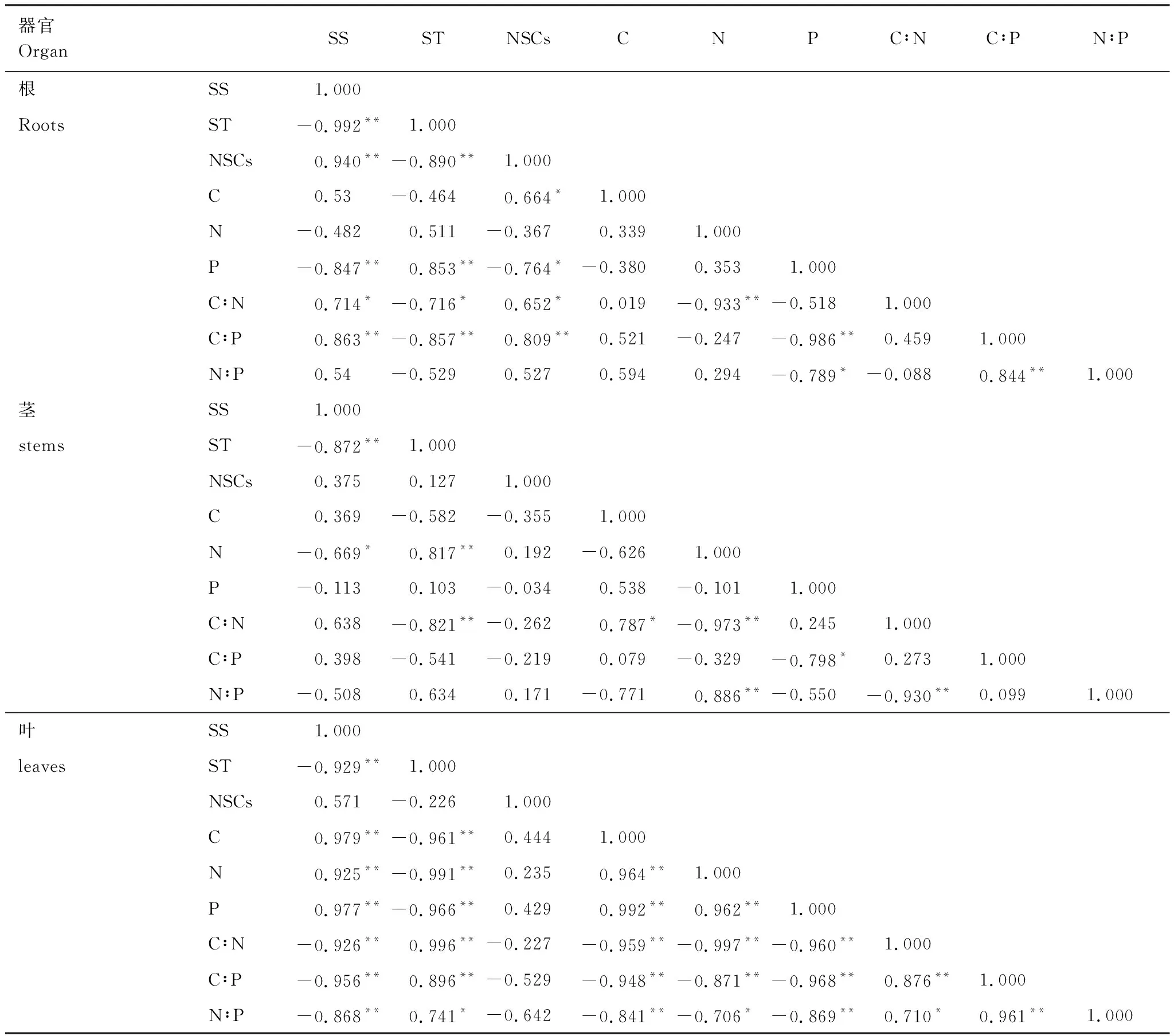
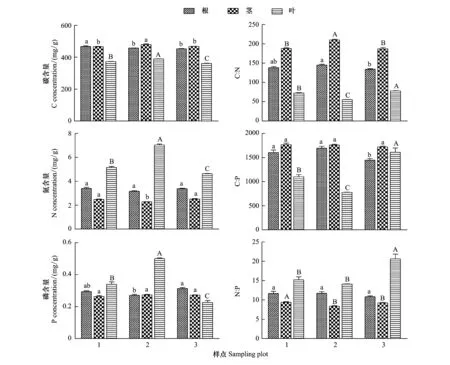
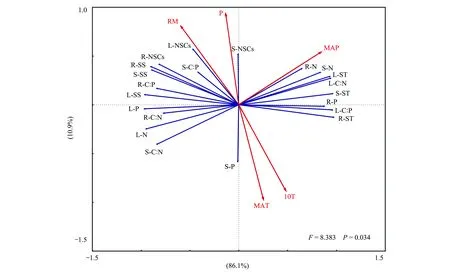
表1为取样点相应环境因子的年均气象数据。考虑到采样期3个样点的土壤含水量可能存在受降雨的影响,利用年均空气相对湿度作为样点间干旱程度的依据。从Plot1、Plot2到Plot3海拔逐渐降低,年均温(mean annual temperature,MAT)逐渐增加,年均降雨量(mean annual precipitation,MAP)为118 mm、111 mm和110 mm,>10℃的积温逐渐增加,空气相对湿度(relative moisture,RM)逐渐降低,即干旱程度逐渐加剧,干旱程度为Plot1 表1 研究区概况 于2014年8月植物生长季内调查沿途出现的典型白刺植被群落,样点均远离公路,以减少交通道路的影响。依据气象资料选取3个不同干旱程度样点(Plot1、Plot2、Plot3),每个样点选择5个白刺优势群落,植被调查灌木样方面积为10 m×10 m,利用随机取样法采集植物样品。 每个小区内选取生长良好的白刺灌木3—5株,利用根钻(直径10 cm)收集0—40 cm处2—5 mm的根系,根据茎干上芽鳞痕、质地、色泽等选择2年生茎干,叶片为所选择茎干中部的成熟叶片。然后按照根、茎、叶标记装袋。同时在每个小区按照五点法采集土壤样品,分为表层0—1 cm、1—10 cm、10—20 cm、20—40 cm。土壤样品自然风干后过100目筛子,用于测定土壤有机质、全N和全P。土壤有机质的测定采用重铬酸钾容量法(外加热法),全氮的测定采用半微量凯氏法,全磷的测定采用HClO4-H2SO4消煮,钼锑抗显色法。野外采集的植物样品先用自来水冲洗至少1次,去掉灰尘等杂物,然后用去离子水冲洗3次。于105℃下杀青10 min,60℃下烘干至恒重。植物样品经研磨后用80 μm的筛子过筛,植物全C的测定利用CN联合分析仪;植物全N和全P的测定采用HClO4-H2SO4消煮法,经定容、沉淀和稀释后用SmartChem 200化学分析仪(West Co Scientific Instrument, Brookfielg, USA)[17]。可溶性糖的测定采用经典的蒽酮比色法,淀粉含量的测定采用高氯酸法,NSC含量=可溶性糖含量+淀粉含量[4]。 从表层到地下40 cm,土壤有机质含量和土壤全N含量在样点Plot1(R2=0.732,P=0.0004;R2=0.599,P=0.0031)、Plot2(R2=0.905,P<0.0001;R2=0.663,P=0.0013)、Plot3(R2=0.920,P<0.0001;R2=0.596,P=0.0033)中均呈显著的下降趋势(图2)。随土层深度增加,土壤全P含量在样点Plot1(R2=0.669,P=0.0012)和Plot3(R2=0.557,P=0.0053)中呈下降趋势,在Plot2中差异不显著(R2=0.319,P=0.0557)(图2)。 同一土层深度,Plot3样点的有机质含量极显著高于Plot1和Plot2(P<0.01);除表层1cm处,Plot2样点的有机质含量显著低于Plot1(P<0.05)(图2)。同一土层深度的土壤全N和全P变化规律一致:Plot1>Plot2>Plot3(图2)。 图2 三个样点土壤有机质、全N和全P含量随土层深度的变化 (平均值±标准误差, n=5)Fig.2 Soil organic matter, total nitrogen and phosphorus concentrations varied with soil depth at three sampling sites (Mean±SE, n=5) 随干旱程度加剧,白刺NSCs变化规律并不一致。Plot2样点白刺根、茎、叶中可溶性糖含量和可溶性糖淀粉比分别极显著大于Plot1(13.8%、11.7%、19.7%和52.0%、64.1%、65.1%)和Plot3样点(63.2%、51%、40.2%和90.9%、88.2%、78.9%)(P<0.01)(图3)。Plot3样点白刺根、茎、叶中淀粉含量分别极显著高于Plot1和 Plot2(P<0.01)(图3)。Plot3样点白刺根系中NSCs的含量显著低于其他两个样点(P<0.01),茎干和叶片中NSCs的含量在3个样点间差异不显著(P>0.05)(图3)。 在Plot1和Plot2样点,根系可溶性糖含量和可溶性糖:淀粉高于茎和叶片,Plot3样点中叶片可溶性糖含量和可溶性糖:淀粉显著高于根系(37%和50.8%)与茎干(32.2%和37.4%)(P<0.01)(图3)。Plot1和Plot2样点叶片的淀粉含量高于茎干(30.2%和9.5%)与根系(19.8%和25.8%)(P<0.01),Plot3样点中淀粉含量的变化与Plot1中呈相反趋势(图3)。在3个样点中,NSCs含量均表现为在叶片与根系中差异不显著,但均显著高于茎干(P<0.05)(图3)。 如图4所示,随干旱程度加剧,Plot2和Plot3样点的白刺根系碳含量显著低于Plot1样点(P<0.05),而Plot1样点的根系N、P含量与Plot2和Plot3样点中无显著差异(P>0.05);茎干C、N、P含量在3个样点中的变化规律不一致,Plot2样点的叶片C、N、P含量分别比Plot1高4.2%、26.8%、32.0%,Plot1比Plot3样点分别高3.0%、10.2%、33.5%(P<0.01)(图4)。Plot1样点的根系C∶N和N∶P与Plot2和Plot3样点间差异不显著(P>0.05);茎干中C∶N、C∶P和N∶P在3个样点间变化规律不一致;Plot3样点叶片C∶N、C∶P和N∶P显著大于Plot1(7.4%、31.5%、25.9%)和Plot2(29.2%、51.3%、31.2%)(P<0.01)(图4)。 在Plot1、Plot2与Plot3样点间,叶片C含量显著低于根系和茎干(90.7%和159.9%、161.8%和279.9%、71.5%和139.1%)(P<0.01)(图4);叶片N含量和N∶P在3个样点中显著高于根系和茎干(P<0.01)(图4);在Plot1和Plot2样点中,P含量具有与N含量相同的规律,在Plot3样点中,根系P含量显著大于茎干(13.1%)和叶片(27.9%)(P<0.05)(图4);茎干中C∶N和C∶P在3个样点中均显著高于根系和叶片(P<0.05)(图4)。 分析器官间NSCs及构成与C∶N∶P计量比间的相关性发现,根、茎、叶中可溶性糖含量与淀粉含量呈显著负相关(表2)。根中P含量与可溶性糖含量和NSCs含量负相关与淀粉含量正相关,C∶N、C∶P分别与可溶性糖含量正相关与淀粉含量负相关。茎中N含量与可溶性糖含量负相关与淀粉含量正相关,C∶N与淀粉含量负相关。叶中N、P含量分别与可溶性糖含量正相关与淀粉含量负相关,C∶N、C∶P、N∶P分别与可溶性糖含量负相关与淀粉含量正相关。 图3 三个样点白刺非结构性碳水化合物积累及分配 (平均值±标准误差, n=5)Fig.3 The accumulation and distribution of non-structural carbohydrates in N. tangutorum at three sampling sites (Mean±SE, n=5)不同大、小写字母分别表示处理间差异显著性水平为P<0.01 和 P<0.05;SS: 可溶性糖Soluble sugar;SF: 淀粉Starch; NSCs: 非结构性碳Non-structural carbohydrates 表2 NSCs构成与C∶N∶P计量比间相关系数 图4 三个样点白刺器官间C∶N∶P化学计量比特征 (平均值±标准误差, n=5)Fig.4 C∶N∶P stoichiometry in N. tangutorum at three sampling sites (mean ± standard error, n=5) 分析环境因子对器官间NSCs与C∶N∶P计量比的影响表明,土壤全P含量与茎干NSCs含量正相关。RM与叶片NSCs含量正相关。MAP与根系N、茎干N、叶片C∶N和可溶性糖含量正相关与茎干C∶N、根系C∶N、叶片N含量显著负相关。MAT和10T与根、茎、叶中NSCs含量负相关(图5)。 图5 基于RDA的环境因子对白刺器官间计量比特征和非结构性碳水化合物的影响效应Fig.5 Effects of environmental factors on C∶ N∶ P stoichiometry and non-structural carbohydrate of N. tangutorum among organs based on redundancy analysis器官 R: 根; S: 茎干; L: 叶片. 非结构性碳水化合物 SS:可用性糖; ST: 淀粉; SS∶ST: 可溶性糖∶淀粉; NSCs: 非结构性碳.计量比特征 C: 植物碳含量; N:植物氮含量; P: 植物磷含量; C:N: 碳氮比; C:P: 碳磷比; N:P: 氮磷比. 环境因子 MAT: 年均温; MAP: 年均降水量; 10T: 大于10℃的积温; RM: 空气相对湿度; P: 土壤P含量 根系NSCs与叶片和茎中NSCs含量,与根、茎、叶中可溶性糖,与根、茎C∶P正相关;根系NSCs与根淀粉和P含量,与叶中C∶P负相关。茎NSCs与茎中P含量负相关。根中淀粉含量与叶片C∶P和根中P含量正相关;根中淀粉与叶片P含量和根中C∶P,与根、茎、叶中可溶性糖含量负相关。根中可溶性糖含量与茎、叶可溶性糖含量,与根、茎、叶中NSCs含量,与根、茎中C∶P正相关;根中可溶性糖含量与根淀粉和P含量,与叶中C∶P负相关。茎、叶中的淀粉含量与根中N、P含量,与茎中N含量,与叶中C∶N正相关;茎、叶中的淀粉含量与叶片中的N、P含量,与根、茎中的C∶N负相关。 在干旱胁迫下,植物体内储存的NSCs可作为光合产物供应不足时的碳源缓冲物质,暂时供应植物应对干旱胁迫时生长和代谢所需的能量,或者用于渡过水分胁迫后生长的能量补给[4]。因此,NSCs的储存被认为是植物应对干旱生境抵御和恢复能力的重要表征特征[18- 19]。研究发现,随干旱程度加剧,白刺根茎叶中NSCs的绝对含量减少,可溶性糖含量先增加后降低,淀粉含量先降低后增加,可溶性糖:淀粉先增加后降低(图2)。一定程度的水分亏缺会使淀粉转化为可溶性糖,增强细胞渗透调节作用,以抵御加重的干旱胁迫,故而造成可溶性糖浓度、可溶性糖:淀粉值增大和NSCs值下降[20- 22]。O′Brien等[23]也认为植物NSCs 浓度高时在干旱中存活的时间长,是由于相对多的NSCs可用于植物水势和水力学导度的维持以抵御持续干旱的胁迫[24]。然而在Plot3样点水分亏缺加剧时,白刺降低了器官内可溶性糖的含量,淀粉的存储显著增加(图2)。关于该结果可能有两方面的原因:第一,由于水分亏缺加剧,阻碍了光合产物向次生代谢过程中功能结构性物质的转化或合成,从而使淀粉积累[25];第二,由于过度的水分亏缺使气穴栓塞阻碍,渗透调节作用被阻断,可溶性糖继而转化为淀粉存储[23, 26]。以上研究结果说明,白刺通过淀粉向可溶性糖的转化来应对适当范围内水分胁迫的伤害;随水分亏缺加剧,白刺会存储多的淀粉于体内,以待水分改善后补给组织器官修复所需的能量。 Xiao[27]等指出NSCs在不同器官间的分配格局是植物对环境适应能力的综合体现。然而,现有关于植物NSCs的研究大部分是基于室内的控制试验,或者仅基于叶片水平的研究居多[4, 20, 24]。叶片虽然是植物光合作用的关键器官,但是叶片水平的NSCs并不能完全代表整株层面[28]。比较根、茎、叶中NSCs含量及构成发现,3个样点间规律不一致。在Plot1样点,根系中的可溶性糖高于茎干和叶片,相应根系中的淀粉含量低于茎干和叶片(图1)。王延平等[29]在杨树的研究中发现,杨树通过将根系中的淀粉转化为可溶性糖,从而维持生理代谢活动促进吸水。这与Von[5]发现的规律一致:淀粉白天暂时储存于叶片中,长期存储在根系和茎干中,可溶性糖和淀粉两者会因环境因子的改变而发生转化。在Plot3样点,叶片可溶性糖含量高于茎干和根系,而根系淀粉含量最高,说明干旱生境下白刺的根系是淀粉的存储器官。这也印证了前面的结果,白刺通过将根系中存储的淀粉转化为可溶性糖来维持代谢促进吸水,从而应对水分亏缺的生境。 水分亏缺影响植物营养元素的吸收和运输过程,严重时造成矿质营养元素的失衡[30]。最近的一项meta-分析表明干旱对植物体内平均N(降低3.73%)、P(降低9.18%)含量的影响总体为负;干旱影响植物N、P含量的机制分三个过程:N、P营养元素的限制阶段、养分限制转为水分限制的过渡阶段、以水分限制为主的长期阶段[31]。研究发现从Plot1到Plot3样点,随干旱程度加剧,白刺叶片中C、N、P含量随干旱加剧先增加后下降(图3)。可能由于在Plot1样点水分还不是限制性因子,白刺主要受N和P的共同限制(N∶P=15.21,14 到目前为止,已有大量的研究来描述一定地理区域内植物的生态化学计量特征,尤其是关于草本植物器官间C∶N∶P计量比特征的变化[36- 37]。由于取样困难和人工成本较高,关于自然群落中荒漠灌木的化学计量特征研究较少,而已有研究多集中于分析叶片的营养状况,而对灌木茎和根的取样分析研究较少[31-32]。白刺根、茎中的全C含量显著高于叶片中的C含量(图3)。在干旱条件下,所有植物器官的干物质积累都会不同程度地减少。一般来说,在干旱条件下,叶片比茎或根更容易受到胁迫[38],这也是干旱胁迫下根冠比增大的原因之一:减少对地上的投资和增大根系系统用于水分的吸收[39]。 叶片相较于茎干和根系,具有高的N、P含量和低的C∶N、C∶P(图3),表明白刺不同的器官以不同的方式分配可利用的营养,其中茎干和根系可能扮演“营养库”的角色,在白刺的生长过程中供给所需的营养物质。在营养元素亏缺的状况下,植物分配多的N、P于光合结构,用于维持正常的C同化和植物生长[40]。除了形态解剖特征外,例如:叶片较小、气孔较大、细胞壁增厚等,渗透调节是抵抗干旱胁迫的有效途径。我们的研究结果已经证明了白刺器官间存在可溶性糖与淀粉的相互转换,通过调节渗透势来抵抗干旱(图2)。 白刺根、茎、叶NSCs含量及构成与C∶N∶P计量比特征间存在关联性。结果表明,叶片N、P浓度和C∶N、C∶P是引起白刺NSCs贮藏的关键因素。我们的结果与其他植物的结果一致[4]。叶片光合能力和NSCs合成不仅受到叶片N浓度的影响,而且与叶片P浓度密切相关[41]。叶片N浓度越高,光合速率越快;叶片P是植物代谢、能量和蛋白质合成的关键元素[36]。表现为叶片N、P含量与茎、叶可溶性糖含量正相关和淀粉含量负相关(图5);根中P含量与根中淀粉含量正相关和可溶性糖含量负相关(表2)。器官间P含量在Plot1中由叶片>根系变为在Plot3中根系>叶片,且Plot3中白刺叶片N∶P>16(图4)。生态化学计量学中叶片N∶P比可作为判断植物生长受N限制或P限制的依据,N∶P<14和>16分别表示植被生长受氮限制和磷限制[42],即干旱加剧使白刺生长受到P限制。考虑到植物P不仅用于满足核糖体合成蛋白质,而且对植物光合产物的运输是不可或缺的[10]。因此,判断白刺器官间P含量的变化对NSCs构成和贮藏的波动起着至关重要的作用,并影响可溶性糖和淀粉的相互转化。即干旱加剧过程中P含量可作为判断白刺碳代谢和生长状态的一个强有力指标。 综上所述, 随干旱加剧,土壤全N、全P含量从表层到地下40 cm均呈下降趋势。白刺根茎叶中NSCs的绝对含量随干旱加剧而降低,相应根中可溶性糖含量先增加后降低,根中淀粉含量先降低后增加;表明白刺通过淀粉向可溶性糖的转化来应对适当范围内水分胁迫的伤害;干旱加剧使白刺将多的淀粉存储于根系,以待水分改善后补给组织器官修复所需的能量。白刺叶片中C、N、P含量随干旱加剧先增加后下降,在Plot3样点分配到叶片的N、P含量下降,C∶N和C∶P上升,叶片N∶P>16;说明白刺器官间以不同的方式分配可利用的营养,其中茎干和根系在白刺的生长过程中可能扮演“营养库”的角色,且随干旱加剧,白刺的生长受到水分和P的双重限制,通过提高对N、P利用效率的策略来适应干旱生境。白刺根、茎、叶NSCs含量及构成与C∶N∶P计量比特征间存在关联性,我们推测白刺器官间P含量的变化对NSCs构成和贮藏的波动起着至关重要的作用,并影响可溶性糖和淀粉的相互转化。干旱加剧过程中P含量可作为判断白刺碳代谢和生长状态的一个强有力指标。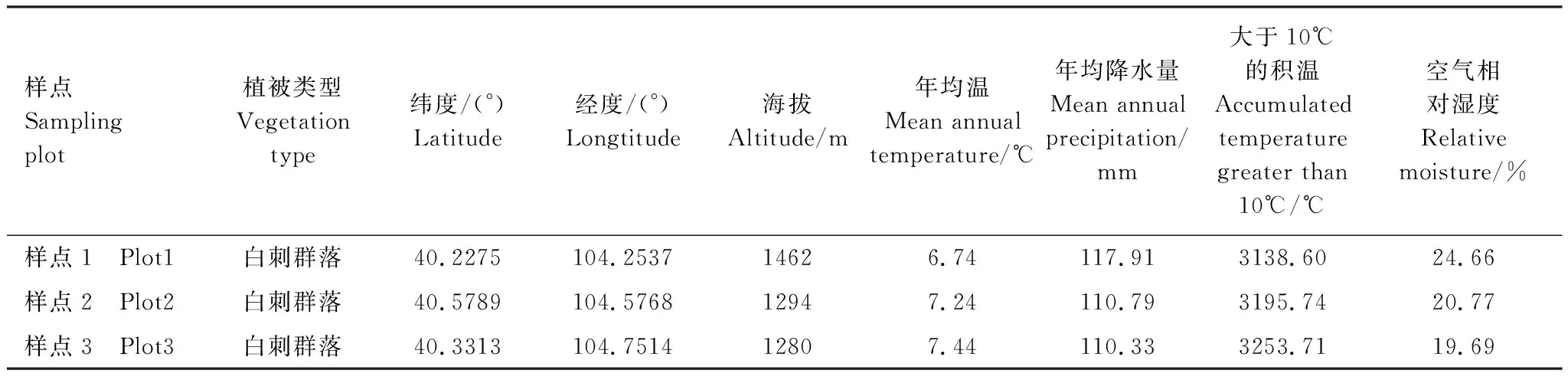
1.2 试验设计
1.3 样品采集与室内测定
1.4 数据分析
2 结果与分析
2.1 样点间土壤养分含量
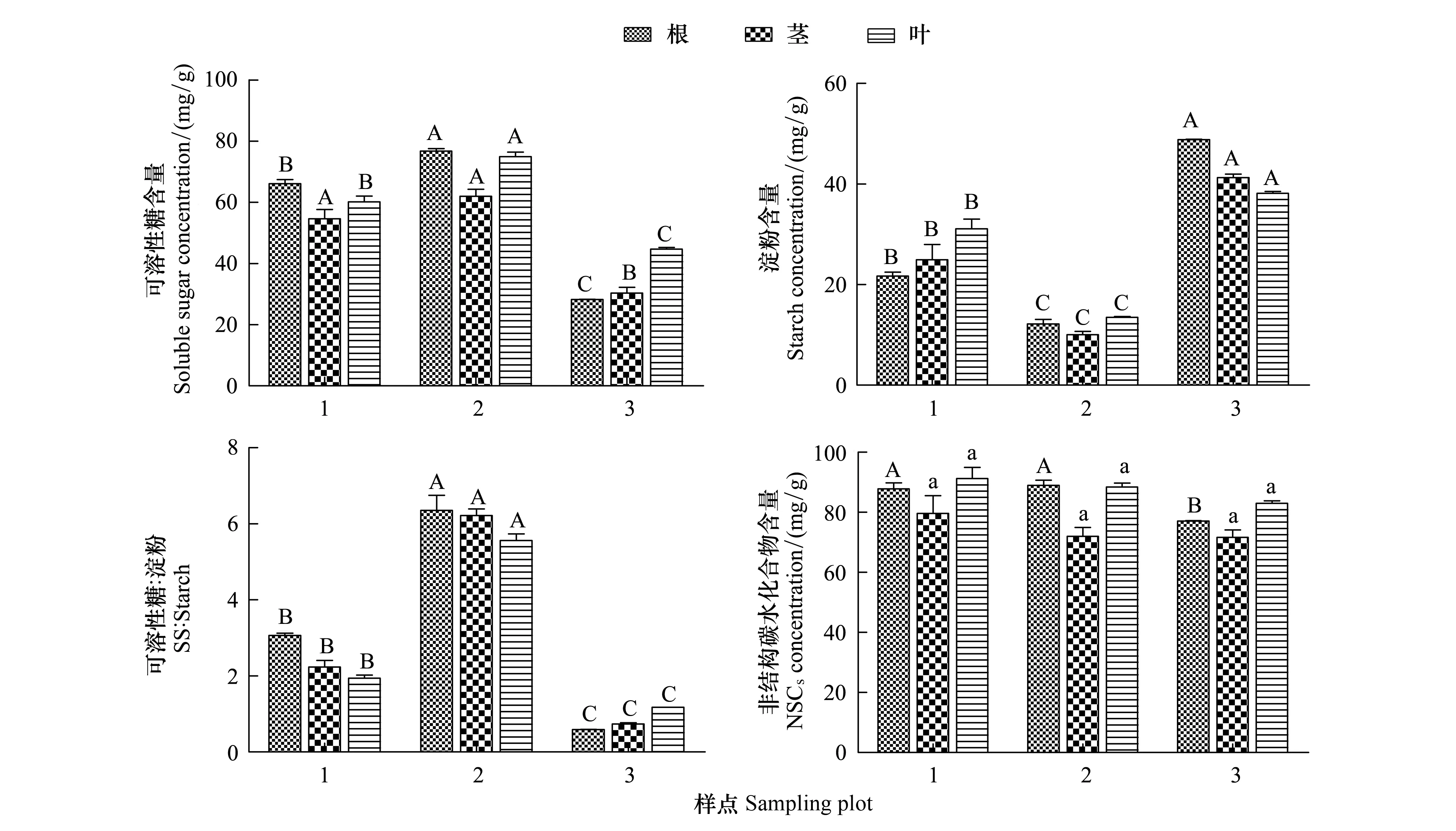
2.2 样点间白刺非结构性碳水化合物积累及分配
2.3 白刺器官间非结构性碳水化合物、计量比特征和环境因子间的关系
3 讨论与结论
3.1 白刺非结构性碳水化合物的积累与分配
3.2 白刺C∶N∶P计量比特征的变化
3.3 白刺器官间NSCs与C∶N∶P计量比特征间的关系

