辣椒红色素和辣椒碱体内抗氧化活性及降血脂功能
范三红,王娇娇,李佳妮,白宝清
(山西大学生命科学学院,特色植物资源研究与利用山西省重点实验室,山西 太原 030006)
据报道,长期高脂膳食使得高血脂症(即血脂代谢异常)发病率呈逐渐上升趋势[1]。高血脂症常常伴有糖尿病、动脉粥样硬化和肝脏、肾脏等组织沉积过多过氧化脂质等并发症[2-4],严重影响人体健康。临床上常用他汀类药物治疗高血脂症[5],同时,从天然可食资源中探索能调节人体血脂代谢水平的成分也已成为研究热点。辣椒属茄科草本植物,营养丰富,在我国分布较广且资源丰富[6]。辣椒红色素是存在于辣椒中的一类天然色素,包括辣椒红素、辣椒玉红素、玉米黄质素和β-胡萝卜素等,被广泛应用于食品添加剂和彩妆领域[7]。辣椒红色素属于类胡萝卜素复烯同类,是VA的前体,研究发现其具有抗氧化活性[8-9]。辣椒碱类物质是辣椒中的辛辣成分,包括辣椒碱、二氢辣椒碱、降二氢辣椒碱等一系列物质,具有抑菌抗炎、减肥、调节血糖、血脂等药理作用[10]。
当前大多数研究都是针对辣椒碱的降血脂活性,较少有针对辣椒红色素抗氧化活性的报道,聂乾忠等[11]发现辣椒素类物质对高脂血症大鼠有降血脂和胆固醇的作用。Manjunatha等[12]研究表明姜黄素和辣椒碱的协同作用可以减轻高脂喂养大鼠的血脂代谢紊乱,并能减缓由高脂血症引起的氧化应激损失。陈朝军等[13]研究花椒麻素和辣椒素对实验性高血脂症大鼠血脂水平的协同作用,结果显示,不同质量比的花椒麻素和辣椒素有降血脂和延缓体质量增加的作用。牟文燕等[14]研究不同水平辣椒红色素对血鹦鹉生长、体形、体色和抗氧化能力的影响,发现1%辣椒红色素组血鹦鹉的过氧化氢酶(catalase,CAT)活力显著高于对照组(P<0.05)。
本实验通过饲喂高脂饲料建立高血脂小鼠模型,探讨辣椒红色素的体内抗氧化活性和辣椒碱的降血脂作用,以期为辣椒资源的深层探索提供一定的理论依据。
1 材料与方法
1.1 动物、材料与试剂
SPF级昆明小鼠64 只,体质量(23±2)g,由山西省第三人民医院提供,生产许可证号:SCXK(京)2019-0010。
基础饲料山西省第三人民医院;高脂饲料南京盛民科研动物公司;辣椒粉末(编号s4)山西省农业科学院蔬菜研究所。
乙腈、二氯甲烷、石油醚(沸点60~90 ℃)、K2HPO4(均为分析纯),甲醇、乙腈、二氯甲烷(均为色谱纯),辣椒红素(纯度98%)、玉米黄质素(纯度97%)、β-胡萝卜素(纯度97%)、辣椒碱(纯度99%)、二氢辣椒碱(纯度98%)、降二氢辣椒碱(纯度98%)北京百灵威科技有限公司;血清总胆固醇(total cholesterol,TC)、甘油三酯(triglyceride,TG)、高密度脂蛋白胆固醇(high-density lipoprotein cholesterol,HDL-C)、低密度脂蛋白胆固醇(low-density lipoprotein cholesterol,LDL-C)、超氧化物歧化酶(superoxide dismutase,SOD)、CAT、丙二醛(malondialdehyde,MDA)、谷胱甘肽过氧化物酶(glutathione peroxidase,GSH-Px)测定试剂盒南京建成生物工程研究所。
1.2 仪器与设备
WJX-800A型高速多功能粉碎机上海缘沃工贸有限公司;AL204电子分析天平梅特勒-托利多仪器(上海)有限公司;SB-5200DT型超声波清洗器宁波新芝生物科技股份有限公司;1260 Infinity II高效液相色谱(high performance liquid chromatography,HPLC)仪美国安捷伦公司;Synergy H1多功能酶标仪美国伯腾仪器有限公司。
1.3 方法
1.3.1 辣椒红色素和辣椒碱的制备
干辣椒经粉碎机粉碎处理,过45 目筛,得到干辣椒粉末。采用三相盐析体系萃取分离辣椒红色素和辣椒碱,具体步骤如下:向20 mL的具塞试管中加入0.5 g辣椒粉末、4 g磷酸氢二钾、4 g乙腈、3.2 g石油醚和8.8 g蒸馏水,充分混匀,45 ℃下超声辅助萃取10 min。静置待三相分离后,辣椒红色素聚集在上相,辣椒碱类物质富集于中相,收集上相和中相萃取液,即为辣椒红色素和辣椒碱提取液,浓缩后冷冻干燥,备用。
1.3.2 辣椒红色素和辣椒碱各组分含量测定
将上相和中相萃取液过0.4 5 μ m 有机滤膜,进行HPLC分析。辣椒红色素HPLC条件:辣椒红色素分析色谱柱ZORBAX RX-SIL(4.6 mm×250 mm,5 μm);流动相:甲醇-乙腈-二氯甲烷体积比5∶10∶85,流速为1 mL/min;柱温为30 ℃;检测波长475 nm。辣椒碱HPLC条件:色谱柱ZORBAX Eclipse Plus C18(4.6 mm×250 mm,5 μm);流动相:体积分数70%甲醇溶液,流速为1 mL/min;柱温为30 ℃;检测波长280 nm。以峰面积外标法定量。标准品溶液与样品溶液进样量均为10 μL。
1.3.3 动物分组及给药处理
小鼠的给药剂量由实验室前期药效学动物实验得出的灌胃剂量确定。SPF级昆明种雄性小鼠64 只,饲养于无毒塑料鼠盒中,每盒8 只,饲喂基础词料、蒸馏水,室内温度22~25 ℃、相对湿度40%~60%,适应性喂养1 周后,称体质量,剔除体质量异常的小鼠后。随机分为8 组,每组8 只。每天给辣椒红色素低、中、高剂量组灌胃辣椒红色素,辣椒碱低、中、高剂量组灌胃辣椒碱,空白对照组和高脂模型组灌胃生理盐水,连续饲养4 周,实验期间小鼠自由饮水和进食。具体分组及给药方法见表1。

表 1 动物分组及饲料、灌胃条件(n=8)Table 1 Animal grouping and feeding and gavage conditions (n= 8)
1.3.4 指标测定
1.3.4.1 血清和组织样品制备
实验第28天末次给药后,断食不断水12 h,称量体质量后摘眼球取全血,低温冷冻离心机4 000 r/min离心15 min,分离血清,于-20 ℃冷冻保存备用。小鼠取血后,颈椎脱臼处死并摘取肝脏,经冷生理盐水冲洗后用滤纸吸干后称质量,用铝箔纸包好装入样品袋,-80 ℃保存待用。测定时取一定量的组织,按1∶9(m/V)的比例加入预冷的质量分数0.9%生理盐水,在冰上用玻璃匀浆器迅速研磨成10%的组织匀浆,冷冻离心机4 000 r/min离心10 min后取上清液,-20 ℃保存待测。
1.3.4.2 小鼠体质量及肝脏指数测定
每周固定时间,饲喂前称量每只小鼠体质量并记录。最后解剖小鼠后称量各肝脏质量,肝脏指数按照下式计算。

式中:m为末次称取的小鼠体质量/g;m1为小鼠肝脏质量/g。
1.3.4.3 小鼠体内抗氧化指标测定
取备用的小鼠肝组织匀浆,小鼠肝脏组织中MDA含量和GSH-Px、SOD、CAT活力的测定按试剂盒说明书进行。
1.3.4.4 小鼠体内血脂水平测定
取适量存放于EP管中处理后的小鼠血清,血清中TG、TC、HDL-C、LDL-C浓度按试剂盒说明书进行测定。
1.4 数据分析与处理
2 结果与分析
2.1 辣椒红色素和辣椒碱各组分分析结果

表 2 辣椒红色素和辣椒碱各组分含量Table 2 Composition of capsanthin and capsaicin prepared in this study
由表2可知,经HPLC测定辣椒(编号s4)中辣椒红色素总含量和辣椒碱总含量分别为0.686 mg/g和3.230 mg/g,辣椒碱含量远多于辣椒红色素。HPLC分析鉴定出辣椒红色素的3 种组分,分别为β-胡萝卜素、辣椒红素和玉米黄质素,辣椒碱同样鉴定出3 种组分,分别为降二氢辣椒碱、辣椒碱和二氢辣椒碱。其中辣椒红色素中辣椒红素为主要的色素组分,含量为0.632 mg/g,辣椒碱为总辣椒碱的主要组分,含量为1.852 mg/g,二氢辣椒碱含量也较多,为1.014 mg/g。
2.2 辣椒红色素和辣椒碱对小鼠平均摄食量的影响

表 3 不同阶段小鼠平均摄食量Table 3 Average food intake of mice during gavage
辣椒红色素和辣椒碱对受试小鼠摄食量的影响如表3所示,在整个实验周期中,小鼠摄食量稍有波动,整体趋于平稳。在同一阶段,小鼠平均摄食量在4~5 g,组间摄食量均无显著性差异,由此可以排除实验过程中由于摄食量增加或减少而引起的包括体质量、血脂水平和抗氧化活性等变化。
2.3 辣椒红色素和辣椒碱对小鼠体质量及肝脏指数的影响

表 4 辣椒红色素和辣椒碱对小鼠体质量、肝脏指数的影响Table 4 Effects of capsaicin and capsaicin on body mass and liver index in mice
在整个实验过程中,各组实验小鼠生长良好,体质量均随时间延长逐渐增长。由表4可知,实验前各组小鼠质量之间无显著差异(P>0.05)。实验结束后,模型组小鼠的体质量极显著高于空白对照组(P<0.01),说明高脂模型的建立对小鼠体质量有极显著的影响。实验组小鼠体质量显著低于高脂模型组小鼠(P<0.05)。灌胃2 周开始,小鼠体质量增长速率减慢。灌胃4 周后,辣椒红色素低、中剂量组小鼠体质量显著低于高脂模型组小鼠(P<0.05),辣椒红色素高剂量组小鼠体质量与高脂模型组相比,差异极显著(P<0.01)。灌胃4 周后,辣椒碱各剂量组小鼠体质量均极显著低于高脂模型组(P<0.01),且随着辣椒碱剂量的增大,对小鼠体质量的降低作用越明显;辣椒红色素各剂量组体质量也有所下降,说明辣椒红色素和辣椒碱可以一定程度上减缓小鼠体质量的增长。同时可以看出,同剂量组下辣椒碱对小鼠体质量的影响更显著。与空白对照组比较,模型组的肝脏指数极显著升高(P<0.01);而与高脂模型组比较,辣椒碱中、高剂量组肝脏系数分别为显著(P<0.05)和极显著降低(P<0.01)。
2.4 辣椒红色素、辣椒碱对小鼠肝脏抗氧化水平的影响


图 1 辣椒红色素和辣椒碱对小鼠肝脏抗氧化活性的影响Fig. 1 Effects of capsanthin and capsaicin on antioxidant system parameters in the liver of mice
高血脂症动物往往组织中的脂质过氧化物含量较高,GSH-Px是一种重要的还原脂质过氧化物的酶类,能催化过氧化氢分解,可防止细胞膜与其他生物组织免受过氧化损伤[15]。由图1A可知,高脂模型组GSH-Px活力与空白对照组相比显著降低(P<0.05)。辣椒红色素和辣椒碱各剂量组与高脂模型组相比均有升高。辣椒红色素低、中剂量组与模型组相比显著升高(P<0.05),辣椒红色素高剂量组GSH-Px活力与高脂模型组差异极显著(P<0.01),其活力与空白对照组相差仅4.21%,同时各实验组小鼠肝脏GSH-Px活力与辣椒红色素灌胃剂量呈正相关;辣椒碱各剂量组中仅高剂量组的GSH-Px活力极显著高于模型组(P<0.01),其活力高于模型组52.12%。这表明辣椒红色素和辣椒碱提取组分能一定程度帮助氧化损伤机体的GSH-Px活力恢复至正常水平,提高机体的抗氧化能力[16]。
SOD是生物体内重要的抗氧化酶,可以保护细胞免受自由基攻击[17]。如图1B所示,高脂模型组小鼠SOD活力下降,与空白对照组相比差异极显著(P<0.01),表明长期饲喂高脂饲料能够使小鼠肝组织的抗氧化能力降低[18]。辣椒红色素低、中剂量组小鼠SOD活力相差不大,辣椒红色素高剂量组小鼠SOD活力较高脂模型组上升了31.87%(P<0.01);辣椒碱中、高剂量组SOD活力与模型组相比分别升高了9.59%和15.61%(P<0.05),这说明一定剂量的辣椒红色素和辣椒碱组分均可以提高小鼠体内SOD的活性,但同剂量组下,辣椒红色素组效果更好。
CAT在动物肝脏组织中活力较高,在机体内具有抗氧化作用[19]。从图1C可以看出,高脂模型组小鼠CAT活力显著下降(P<0.05),辣椒碱高剂量组较模型组的CAT活力增加了21.86%;辣椒红色素低、中剂量组差异显著,其CAT活力分别增加了3.10%、12.11%(P<0.05),辣椒红色素高剂量组CAT活力则极显著增加了32.72%(P<0.01),表明辣椒红色素各剂量组小鼠肝脏组织中SOD活力呈明显的剂量-效应关系,这与文献[20]的结论一致。
MDA是膜脂过氧化的主要产物之一,其含量代表肝脏的损伤程度,与细胞氧化损伤的程度呈正相关[21]。从图1D可以得出,与空白对照组相比较,模型组小鼠肝脏组织中MDA含量极显著升高(P<0.01)。与模型组相比较,辣椒碱中、高剂量组MDA含量分别降低28.98%、35.80%(P<0.05);辣椒红色素低、中、高剂量组MDA含量分别降低26.70%、34.94%、41.19%,说明辣椒红色素和辣椒碱各组分能不同程度降低小鼠体内MDA含量,减轻机体内脂质过氧化的程度,从而保护细胞结构和功能的完整性[23]。并且同为高剂量组,辣椒红色素降低MDA含量比辣椒碱组分高5.39%,随辣椒红色素和辣椒碱剂量的增大,其对机体的保护作用增强。
2.5 辣椒红色素、辣椒碱对小鼠血脂水平的影响
高血脂症是血脂代谢异常所致,其主要表现为血清中TC、TG和LDL-C水平过高或HDL-C水平过低[24]。血清中TC、TG水平的异常增加与心血管疾病的发生呈正相关。其中HDL-C可作为逆向转运TC的载体,其水平增加可加快血液中TC的分解[23]。
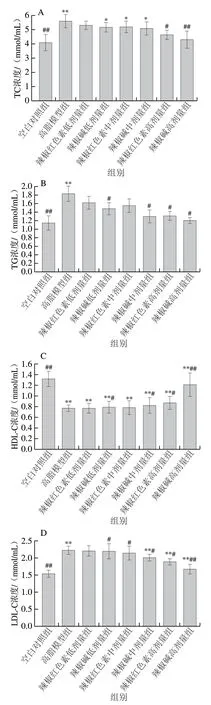
图 2 辣椒红色素和辣椒碱对小鼠血脂水平的影响Fig. 2 Effects of capsanthin and capsaicin on blood lipid levels in mice
如图2所示,模型组小鼠与空白对照组小鼠比较,TC、TG、LDL-C浓度极显著升高(P<0.01),HDL-C浓度极显著降低(P<0.01),表明高脂模型组小鼠出现明显的血脂代谢紊乱[25]。
由图2A可知,与高脂模型组相比,辣椒红色素高剂量组和辣椒碱高剂量组小鼠血清中TC浓度分别降低了17.17%(P<0.05)和23.26%(P<0.01)。从图2B可以看出,辣椒碱各剂量组小鼠与高脂模型组小鼠的TG浓度相比差异显著(P<0.05),与空白对照组对比无显著差异(P>0.05),且小鼠血清中TG浓度与辣椒碱剂量呈负相关,即辣椒碱剂量越高,小鼠血清中TG浓度越低,而对于辣椒红色素各剂量组TG浓度均有所下降,但仅高剂量组小鼠与模型组比差异显著(P<0.05)。
如图2C所示,辣椒红色素高剂量组小鼠HDL-C浓度较模型组升高了12.99%,辣椒碱低、中剂量组小鼠与高脂模型组小鼠HDL-C浓度相比显著升高(P<0.05),辣椒碱高剂量组小鼠HDL-C浓度较模型组极显著升高
57.14%(P<0.01)。
从图2D可以得出,辣椒碱各剂量组小鼠血清中LDL-C浓度与高脂模型组相比均降低,其中辣椒碱低、中剂量组与模型组相比差异显著(P<0.05),辣椒碱高剂量组差异极显著(P<0.01),且随着辣椒碱剂量的升高,小鼠血清中LDL-C浓度降低;辣椒红色素中、高剂量组LDL-C浓度与模型组相比显著下降(P<0.05),辣椒红色素高剂量组和辣椒碱高剂量组小鼠较模型组相比,其LDL-C浓度分别降低了15.32%和24.77%。综合来看,辣椒红色素和辣椒碱各剂量组均有一定降低血脂功效,并具有统计学意义,但辣椒碱富集组分在调节小鼠血脂水平上作用更明显,这与文献[26]的结论一致。
3 讨 论
以天然植物资源辣椒为原料,以三相萃取分离同步得到的辣椒红色素和辣椒碱提取物为研究对象,通过饲喂高脂饲料建立高血脂症小鼠模型,经不同剂量的辣椒红色素和辣椒碱灌胃干预后,对肝脏组织和血清中相关指标进行测定。
GSH-Px、SOD、CAT这3 种酶是体内重要的抗氧化酶,其活性高低可间接反映机体清除氧自由基的能力,MDA是体内脂质过氧化产物之一,其含量与机体内脂质过氧化程度成正比[27-28]。结果显示,经辣椒红色素和辣椒碱富集组分灌胃干预的实验组小鼠肝组织中的GSH-Px、SOD和CAT活力均高于高脂模型组小鼠,同时各剂量组小鼠肝脏中的MDA含量降低,可初步表明辣椒红色素和辣椒碱提取物具有一定的体内抗氧化活性,降低脂质过氧化程度。但对比来看,辣椒红色素组分的抗氧化作用更明显,这可能是由于辣椒红色素组分均为类胡萝卜素(VA前体),结构中含有共轭双键,其中辣椒红素单组分还含有共轭酮基和环戊烷环,使得辣椒红色素富集组分的抗氧化功效更加显著[29]。通过测定辣椒红色素和辣椒碱各剂量组小鼠血清的血脂水平,结果表明,经辣椒红色素和辣椒碱富集组分灌胃的实验组小鼠血清中的TC、TG和LDL-C浓度明显低于高脂模型组,HDL-C浓度与模型组相比显著升高[30-31],表明辣椒红色素和辣椒碱富集组分具有调节高血脂症小鼠血脂代谢异常的功效,其中辣椒碱类物质效果更佳,这是因为辣椒碱可以激活瞬时电位香草酸1受体,而瞬时电位香草酸1在调节脂质代谢以及保护心血管系统等方面具有一定作用[32]。这为开发天然降脂、抗氧化产品,扩大辣椒资源的利用提供了新思路和理论参考。

