海洋天然产物中α-葡萄糖苷酶抑制剂研究进展
朱月霞,邵仲柏,吴小小,吴琦,金叶,刘顺,李姣姣,吉敬,史大华,沈金阳,刘玮炜
(1.江苏海洋大学药学院,江苏 连云港 222005;2.江苏省海洋生物资源与环境重点实验室,江苏 连云港 222005;3.江苏省海洋生物产业技术协同创新中心,江苏 连云港 222005;4.连云港市食品药品检验检测中心,江苏 连云港 222000;5.扬州市中医院药剂科,江苏 扬州 225001;6.南京医科大学康达学院,江苏 连云港 222000)
糖尿病是以高血糖为特征的一种慢性疾病。1999年WHO提出的糖尿病病因学分型体系将糖尿病分为4大类:1型糖尿病、2型糖尿病、特殊类型糖尿病和妊娠期糖尿病。其中2型糖尿病为临床最常见,病因和发病机制尚不明确,其显著的病理生理学特征为胰岛素调控葡萄糖代谢能力下降和胰岛β细胞功能缺陷所导致的胰岛素分泌减少[1]。2型糖尿病可通过注射胰岛素或口服药物进行治疗,α-葡萄糖苷酶抑制剂(α-Glucosidase inhibitors,AGIs)是一类重要的口服降糖药。AGIs通过抑制肠黏膜上的α-葡萄糖苷酶,使淀粉分解为葡萄糖的速度减慢,从而减少和延缓小肠对葡萄糖的吸收,改善糖尿病人血糖异常[2]。AGIs作为治疗糖尿病的新途径,可使血糖逐渐维持在一定水平,并可减少并发症的发生[3]。
目前上市的AGIs数量较少,主要包括阿卡波糖、伏格列波糖和米格列醇,他们均有一定的副作用,主要不良反应包括胃肠道紊乱、肝功能受损、皮肤过敏和心律失常等[4-7]。因此,开发新型安全的AGIs具有一定的临床需求性。
海洋生态系统的高压、高盐、缺氧、低光照等特殊性使得海洋生物具有巨大的生物多样性和独特的化学多样性。截至目前,基于海洋天然产物及其衍生物开发并成功上市的药物有17种[8]。海洋生物资源作为一个巨大的宝库,是寻找和开发更低副作用、更安全、含量更丰富的新型AGIs的重要方向。本文将从海洋动物、藻类和微生物三个来源总结海洋产物中具有抑制α-葡萄糖苷酶活性的化合物的研究报道,为新型α-葡萄糖苷酶抑制剂类药物的研究与开发提供参考。
1 海洋动物来源
Nguyen等[9-10]从海参Stichopusjaponicus(韩国)的正己烷组分中分离纯化出不饱和脂肪酸类化合物甘油二棕榈油酸酯(1,3-Dipalmitolein,1)、顺式-9-十八碳烯酸(Cis-9-Octadecenoic acid,2)、7Z-十八碳二烯酸(7Z-Octadecenoic acid,3)和7Z,10Z-十八碳二烯酸(7Z,10Z-Octadecadienoic acid,4)。化合物1~2可抑制来源于酿酒酵母Saccharomycescerevisiae的α-葡萄糖苷酶,IC50分别为4.45、14.87 μmol/L,远远高于IC50为3 872.3 μmol/L的阿卡波糖。化合物3~4可同时抑制来源于酿酒酵母Saccharomycescerevisiae的α-葡萄糖苷酶和来源于嗜热脂肪芽孢杆菌Bacillusstearothermophilus的α-葡萄糖苷酶,化合物3对2种α-葡萄糖苷酶的IC50分别为0.51 μg/mL和0.67 μg/mL,化合物3对2种α-葡萄糖苷酶的IC50分别为0.49 μg/mL和0.60 μg/mL,而质量浓度为100 μg/mL阿卡波糖无明显活性。以上4个化合物对酿酒酵母α-葡萄糖苷酶均表现出混合竞争性抑制,抑制常数Ki分别为0.48、1.24、0.44、0.39 μg/mL。从海参Pearsonothuriagraeffei(中国)中提取得到海参皂苷(Sea cucumber saponins,SCS,5),SCS主要是由羊毛甾醇型苷元与C-3位连接的糖基组成的三萜苷。在体外抑制α-葡萄糖苷酶的活性研究中[11],与阿卡波糖(IC50=1.06 mg/mL)相比,对α-葡萄糖苷酶有明显抑制作用,IC50为0.04 mg/mL,其对酵母α-葡萄糖苷酶的抑制作用为非竞争性抑制,Ki为0.04 mg/mL。
Nakao等[12]从海绵Penaressp.(日本)中提取得到含有脯氨酸的大环内酯类硫酸戊内酯A1(Penarolide sulfates A1,6)、硫酸戊内酯A2(Penarolide sulfates A2,7)和脯氨酸被哌啶酸替换的链状化合物硫代戊二酸甲酯A(Penasulfate A,8),3种化合物对α-葡萄糖苷酶均表现出较强的抑制活性,IC50分别为1.2、1.5、0.14 μg/mL。Takada等[13]从海绵Penaresschulzei(日本)提取得到3种生物碱并命名为Schulzeines A~C(9~11),对α-葡萄糖苷酶抑制活性非常强,IC50为48~170 nmol/L。Okamoto等[14]从海绵Ianthellasp.(澳大利亚)中提取得到四溴苯并呋喃衍生物Iantheran A(12)能对多种酶有抑制活性,其中抑制α-葡萄糖苷酶的IC50为0.37 μmol/L。Sakai等[15]从海绵Lendenfeldiachondrodes(密克罗尼西亚)中提取得到脱氧野尻霉素衍生物1-脱氧野尻霉素6-磷酸(1-Deoxynojirimycin-6-phosphate,13)和N-甲基-1-脱氧野尻霉素6-磷酸(N-Methyl-1-deoxynojirimycin-6-phosphate,14),抑制常数Ki分别为0.83、6 600 μmol/L。多羟基吡咯烷衍生物1,4-二脱氧-1,4-亚氨基-D-阿拉伯糖醇(1,4-Dideoxy-1,4-imino-D-arabinitol,15)是从海绵Haliclonasp.93-111(澳大利亚)中提取得到的化合物[16],抑制α-葡萄糖苷酶的IC50为0.16 μg/mL。多炔类化合物Callyspongynic acid(16)、Corticatic acid A(17)和Petrosynol(18)是从海绵Callyspongiatruncata(日本)中提取得到的化合物[17],均具有较强的α-葡萄糖苷酶抑制活性,IC50分别为0.25、0.16、4.08 μg/mL。
Ravinder等[18]从海鞘Synoicummacroglossum(印度)中提取得到一种新的生物碱Tiruchanduramine(19),IC50为78.2 μg/mL,是一种有效的α-葡萄糖苷酶抑制剂。

图1 海参来源的AGIs化学结构式

图2 海绵、海鞘来源的AGIs化学结构式
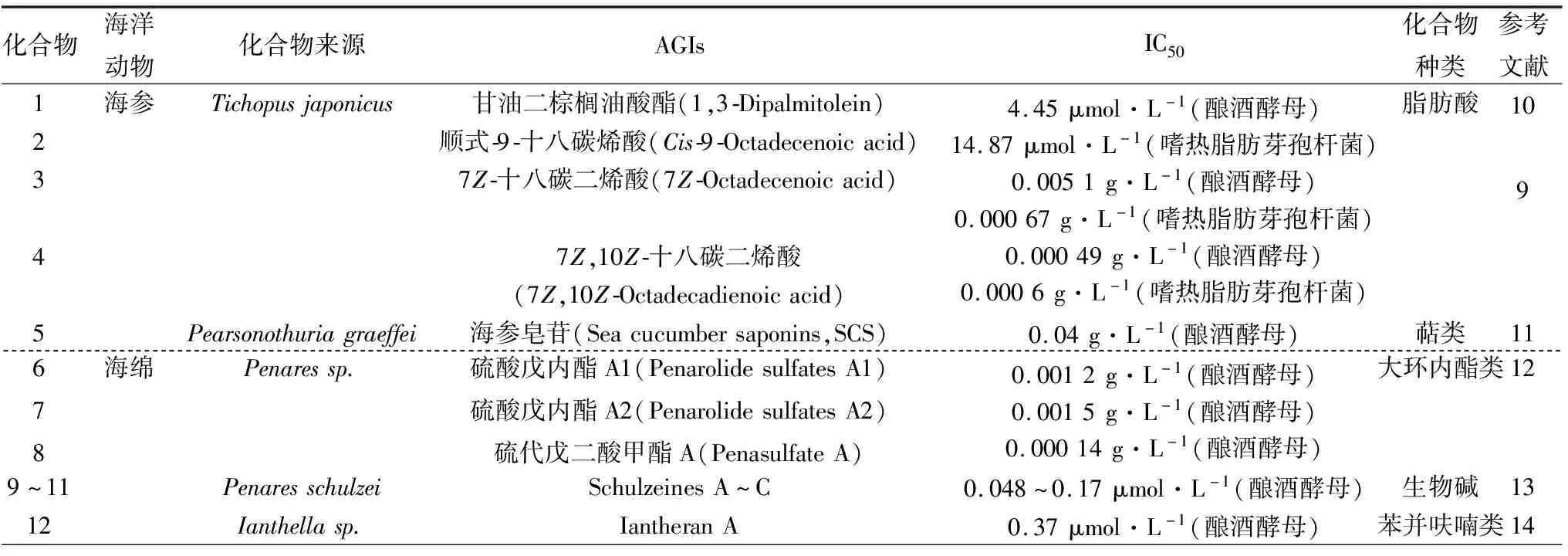
表1 海洋动物来源的AGIs
2 海洋藻类来源
Methanolic extract ofE.stolonifera(MEE,20)是褐藻Eckloniastolonifera的甲醇提取物,提取物中含有较高的多酚类物质,具有较强的α-葡萄糖苷酶抑制活性(IC50=0.022 mg/mL)和清除自由基活性,推测其活性成分可能是褐藻多酚(Phlorotannins)[19]。Heo等[20]从褐藻Ishigeokamurae(韩国)中分离得到酚类化合物二邻羟基香豆酚(Diphlorethohydroxycarmalol,DPHC,21),对α-葡萄糖苷酶的抑制作用(IC50=0.16 mmol/L)强于阿卡波糖(IC50=1.05 mmol/L),且抑制作用呈剂量依赖性。Lee等[21]以褐藻Eckloniacava(韩国)为原料分离得到酚类化合物二鹅掌菜酚(Dieckol,22),对α-葡萄糖苷酶具有剂量依赖性的抑制作用,IC50为0.24 mmol/L。此外,Dieckol可显著减少糖尿病小鼠的曲线下面积(AUC),并延迟膳食碳水化合物的吸收。Yasuko等[22]从褐藻Sargassumpatens(日本)中得到了一种新的间苯三酚衍生物2-(4-(3,5-二羟基苯氧基)-3,5-二羟基苯氧基)苯-1,3,5-三醇[2-(4-(3,5-Dihydroxyphenoxy)-3,5-dihydroxyphenoxy)benzene-1,3,5-triol,DDBT,23],能抑制来源于鼠胰腺的α-葡萄糖苷酶,底物为麦芽糖和蔗糖时的IC50分别为114、25.4 μg/mL。DDBT是一种竞争性的α-淀粉酶抑制剂,其Ki值为1.8 μg/mL。有研究者利用配体对接程序对19种陆生植物黄酮类化合物与酶活性位点之间的相互作用进行了计算模拟,同时测定了黄酮类化合物对α-淀粉酶的抑制活性[23]。结果发现抑制活性取决于黄酮类化合物的羟基能否与α-淀粉酶活性位点上Asp197和Glu233的羧基之间形成氢键,所以推测DDBT能对酶产生活性的原因是DDBT的羟基基团与酶活性部位的侧链结合,从而导致酶活性的抑制,更加证实DDBT拥有类黄酮构象。Ali等[24]从褐藻Padinaboergesenii(阿曼)中分离出一种新的脂肪酸Padinolic acid(24),该化合物对α-葡萄糖苷酶和脲酶分别表现出低到中度的抑制作用,并具有中等的抗脂质过氧化活性。Apostolidis等[25]在80 ℃褐藻Ascophyllumnodosum的水提物中得到了最高含量的总酚,对α-葡萄糖苷酶的抑制作用与酚类物质的含量呈正相关。此外Gabbia等[26]发现该提取物能降低非酒精性脂肪性肝炎(NASH)模型小鼠餐后血糖峰值和血糖AUC。Kim等[27]发现从褐藻Ascophyllumnodosum(加拿大)中提取的褐藻糖胶(Fucoidan,25)对α-葡萄糖苷酶呈剂量依赖的抑制作用,IC50为0.013~0.047 mg/mL并且抑制活性取决于提取糖胶的藻类、收获藻类的时间以及目标酶。4-羟基苯乙醇[4-(2-Hydroxyethyl)phenol,26]和4-二羟基苯乙醇[4-(1,2-Dihydroxyethyl)phenol,27]2种酚类化合物是从褐藻Macrocystisangustifolia(南非)分离得到,具有α-葡萄糖苷酶抑制活性,IC50分别为278.23、335.76 μg/mL[28]。Moon等[29]从可食用褐藻Eckloniastolonifera和Eiseniabicyclis(韩国)的混合物中分离得到的3种多酚是间苯三酚(Phloroglucinol,28)、二氧萘甲醚(Dioxinodehydroeckol,29)和鹅掌菜酚(Eckol,30),对α-葡萄糖苷酶的IC50分别为141.2、34.6、22.8 μg/L,化合物29和30表现为竞争性抑制,Ki分别为2.86、1.43 mmol/L。

注:化合物20化学结构式文献未报道
Kim等[30]在红藻Grateloupiaelliptica(朝鲜)中提取2,4,6-三溴苯酚(2,4,6-Tribromophenol,31)和2,4-二溴苯酚(2,4-Dibromophenol,32)2种溴酚,可同时抑制来源于酿酒酵母和嗜热脂肪芽孢杆菌的α-葡萄糖苷酶,化合物31对这2种α-葡萄糖苷酶的IC50分别为60.3 μmol/L和110.4 μmol/L,化合物32对这2种α-葡萄糖苷酶的IC50分别为130.3 μmol/L和230.3 μmol/L。化合物31~32对酿酒酵母α-葡萄糖苷酶表现出混合竞争性抑制,Ki分别为15.2、92.1 μmol/L。在红藻Symphyocladialatiuscula(日本)中分离纯化出一种溴苯酚化合物双(2,3,6-三溴-4,5-二羟基苄基)醚[Bis(2,3,6-Tribromo-4,5-dihydroxybenzyl)ether,33],该溴酚对酿酒酵母α-葡萄糖苷酶有竞争性抑制作用,IC50值为0.030 μmol/L,其Ki值为0.014 μmol/L[31]。Kurihara等[32]从红藻Odonthaliacorymbifera(日本)中分离出2个新的溴代芳醚化合物4-溴-2,3-二羟基-6-羟甲基苯基2,5-二溴-6-羟基-3-羟甲基苯基醚(4-Bromo-2,3-dihydroxy-6-hydroxymethylphenyl-2,5-dibromo-6-hydroxy-3-hydroxymethylphenyl ether,34)、双(2,3-二溴-4,5-二羟基苄基)醚[Bis(2,3-dibromo-4,5-dihydroxybenzyl)ether,35]和1个已知的溴酚类化合物2,3-二溴-4,5-二羟基苄醇(2,3-Dibromo-4,5-dihydroxybenzyl alcohol,36),对α-葡萄糖苷酶表现出不可逆转的抑制作用,IC50分别为25、0.098、89 μmol/L,化合物34和36表现为混合竞争性抑制,Ki为11.0、72.0 μmol/L,化合物35的Ki值为0.053 μmol/L。

图4 红藻来源的AGIs化学结构式
Jia等[33]从绿藻Chlorellaellipsoidea(韩国)中分离纯化出3种类胡萝卜素,其中all-E-Lutein(37)和9Z-玉米黄质(9Z-Zeaxanthin,38)具有较强的α-葡萄糖苷酶抑制活性,IC50为70、53.5 μmol/L,化合物37~38的抑制作用不受抑制剂浓度的影响,所以为非竞争性的抑制作用。采用热水浸提法从绿藻浒苔Enteromorphalinza(中国)中提取粗多糖,其中ELP-3(39)对α-葡萄糖苷酶的抑制作用(IC50=0.36 mg/mL)明显强于阿卡波糖(IC50=0.46 mg/mL),而ELP-4(40)的抑制作用(IC50=0.58 mg/mL)与阿卡波糖相似,对α-葡萄糖苷酶均表现出浓度依赖性的抑制作用[34]。Ali等[35]对绿藻Codiumdwarkense(阿曼)进行提取分离,得到1个新的三萜酸Dwarkenoic acid(41)和6个已知的甾醇Androst-5-en-3β-ol(42)、Stigmasta-5,25-dien-3β,7α-diol(43)、Ergosta-5,25-dien-3β-ol(44)、7-Hydroxystigmasta-4,25-dien-3-one-7-O-β-D-fucopy-ranoside(45)、8-7-Hydroxystigmasta-4,25-dien-3-one(46)和Stigmasta-5,25-dien-3β-ol(47)。化合物41在所有浓度下对α-葡萄糖苷酶均表现出明显的抑制作用,化合物42、43、45和47表现出剂量依赖性反应,而化合物44~46表现为中度抑制,化合物41~47的IC50分别为3.47、5.32、3.9、9.09、16.89、20.12、3.31 μg/mL。张哲等[36]从钝顶螺旋藻中分离得到一种α-葡萄糖苷酶抑制剂,进一步通过紫外及红外检测表明,该样品可能为带有共轭体系的多羟基酯类化合物。

注:化合物39~40化学结构式文献未有报道。
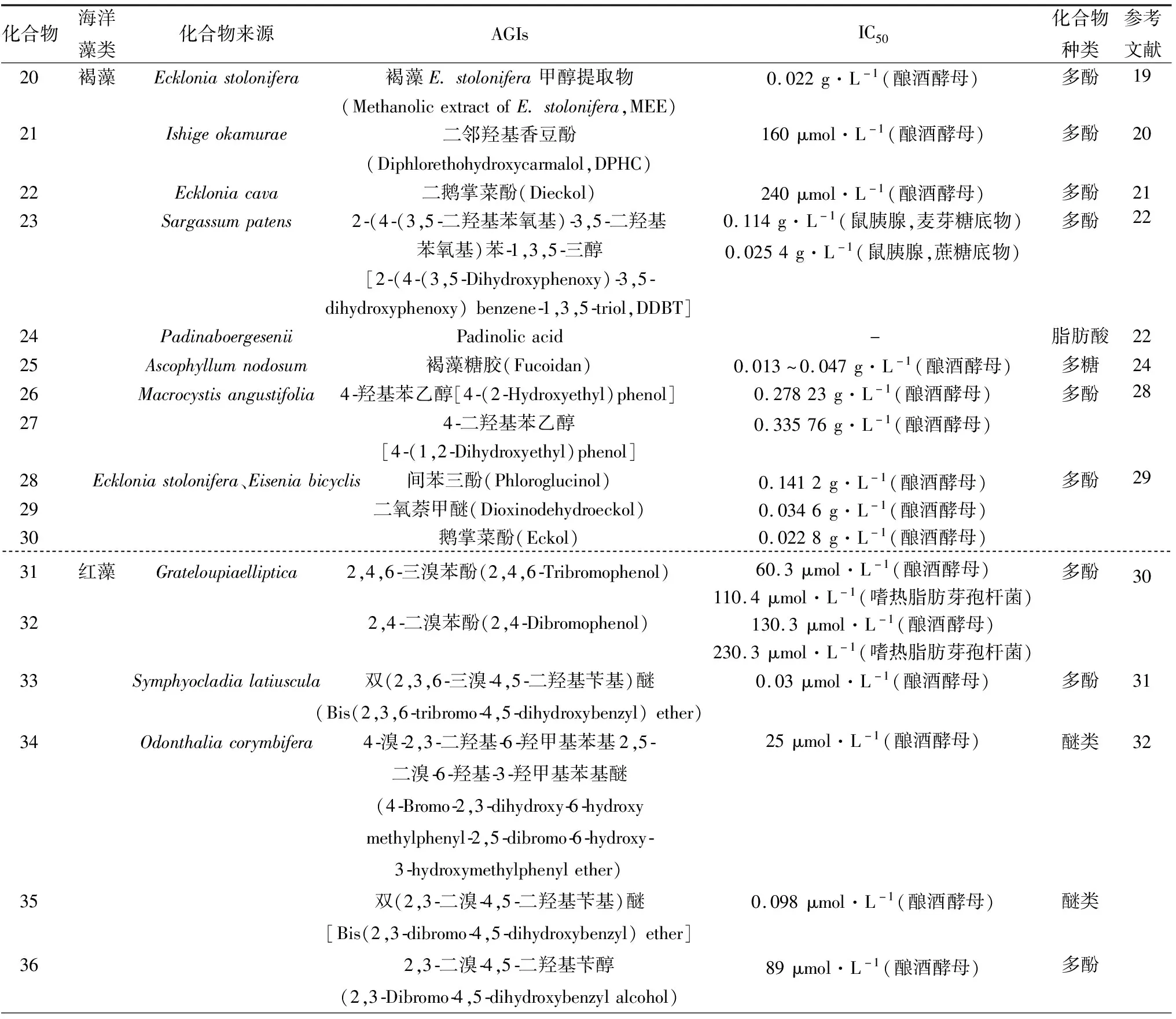
表2 海洋藻类来源的AGIs
3 海洋微生物来源
Ingavat等[37]从来自海绵Xestospongiatestudinaria(泰国)的棘孢曲霉AspergillusaculeatusCRI32304中分离得到一种酪氨酸代谢物Aspergillusol A(48),对来源于酒酿酵母和嗜热脂肪芽孢杆菌的α-葡萄糖苷酶有抑制作用,IC50为465、1 060 μmol/L。来自秋茄Kandeliacandel(中国)的红林树内生真菌Penicilliumchermesinum(ZH4-E2)中分离得到8种化合物,其中包括1个新的Azaphilones类衍生物Chermesinones A(49)以及3个三联苯类化合物6'-O-去甲基三联苯林(6'-O-Desmethylterphenyllin,50)、3-羟基-6'-O-去甲基三联苯林(3-Hydroxy-6'-O-desmethylterphenyllin,51)和3,3''-二羟基-6'-O-去甲基三联苯林(3,3''-Dihydroxy-6'-O-desmethylterphenyllin,52),能够抑制α-葡萄糖苷酶,IC50分别为24.5、0.9、4.9、2.5 μmol/L[38]。珊瑚Sarcophytonsp.(中国)来源的EurotiumrubrumSH-823中可分离到2个新的含硫苯并呋喃衍生物,即Eurothiocin A(53)和Eurothiocin B(54),是α-葡萄糖苷酶的竞争性抑制剂,抑制作用强于阿卡波糖,IC50分别为17.1、42.6 μmol/L[39]。对来自老鼠簕Acanthusilicifolius(中国)的红树林真菌B60进行提取,得到硝基苯糖苷化合物硝基苯基葡萄糖苷(Nitrophenyl glucoside,55),采用紫外分光光度法发现其对α-葡萄糖苷酶有轻微抑制作用,IC50为160.3 μmol/L[40]。对来自老鼠簕Acanthusilicifolius(中国)的红树林真菌Xylariasp.BL321进行提取,得到的倍半萜化合物07H239-A(56),具有较好的抑制α-葡萄糖苷酶活性,抑制作用随浓度的增加而增加,IC50为6.54 μmol/L[41-42]。Wailupemycins H(57)和Wailupemycins I(58)是由浒苔Enteromorphaprolifera(中国)的单胞菌Streptomycessp.OUCMDZ-3434提取得到的竞争性α-葡萄糖苷酶抑制剂,IC50分别为19.7、8.3 μmol/L,Ki分别为16.8、6.0 μmol/L[43]。Diorcinol J(59)是由真菌AspergillusversicolorOUCMDZ-2738提取得到,比阿卡波糖具有更好的α-葡萄糖苷酶(IC50=255.3 μmol/L)抑制活性,IC50分别为117.3 μmol/L[44]。
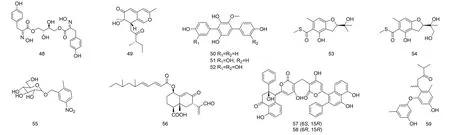
图6 海洋微生物来源的AGIs化学结构式

表3 海洋微生物来源的AGIs
4 讨论
经文献查阅总结,目前共报道了59个来源于海洋产物的α-葡萄糖苷酶抑制剂,其中动物来源的有19个、植物来源的有28个、微生物来源的有12个。化合物的种类涉及生物碱、多酚、多糖、脂肪酸和萜类。其中生物碱占最多数,且化合物9~11是目前报道的α-葡萄糖苷酶抑制活性最强的一类化合物;多酚类也占一定比重,多集中在海洋藻类。未来从海洋天然产物中筛选AGIs的研究,可多关注生物碱和多酚类的化合物。此外化合物5~12中引入硫酸盐基团,化合物16~18、37~38中引入双键和三键,化合物31~36中引入了卤素,增强了α-葡萄糖苷酶抑制活性。这些结构特征为AGIs的分子研究提供了一定方向。
海洋中药与传统中药最大的区别就是其海洋属性。海洋中药来源的区域不仅具有特殊性,而且海洋生物在长期的进化过程中产生了一些结构独特而药理毒理作用显著的活性物质,同时其性味、功效以及物质基础、药理活性与传统中药比较具有鲜明特色。中医认为,糖尿病属于“消渴病”范畴,属阴虚燥热型,因而治疗多从补阴着手,清热养阴。与传统中药相比,海洋中药性味多寒、咸、甘为主,主要归肝、肾经;《素问·脏气法时论》提出“辛散、酸收、甘缓、苦坚、咸软,毒药攻邪”[45],咸能软坚散结,寒能清热,甘能补虚,调和五脏[46]。在海洋中药的研究中,发现许多海藻提取物具有一定的α-葡萄糖苷酶抑制活性,如松节藻、叉开网翼藻等脂溶性提取物以及条斑紫菜、铁钉菜的藻多酚等,抑制率达到60%以上[47];牡蛎的蛋白酶解液对α-葡萄糖苷酶具有抑制作用,抑制率最大为89.22%[48];北沙参的多糖组分中存在α-葡萄糖苷酶抑制剂,随着多糖浓度的增加抑制能力也不断增强[49]。
目前AGIs已被亚太地区推荐为治疗糖尿病的一线药物,研究还发现AGIs具有调节肠道菌群及胃肠激素的作用机制,这都将使AGIs类药物的临床应用更为广阔。海洋天然产物来源的AGIs与陆生的相比,在立体化学方面常互为对映体,是对AGIs种类的补充,如在海藻的代谢产物中,萜类化合物与陆生的有关化合物互为对映体;柳珊瑚与陆生哺乳动物中的一类脂肪酸(前列腺素)唯一的差别是C-15构型的不同,前者为S构型,后者为R构型[50]。在IC50方面,陆生天然产物的AGIs通常是阳性对照药阿卡波糖的2~18倍[51],而海洋天然产物可达2~26倍,可见海洋来源的AGIs抑制能力更强。此外,在抑制类型方面,陆生天然产物的AGIs多为竞争性和非竞争性抑制,而海洋产物AGIs还存在混合竞争性抑制,酶抑制类型更加丰富。
海洋资源作为一座天然药库,随着人们对海洋丰富资源的探索,来源于海洋的新型AGIs的开发成为可能。尽管目前从海洋天然产物中筛选得到了众多新型的AGIs,但这些AGIs要么含量极低,难以大规模获得;要么存在安全性问题;要么人工合成路线复杂,合成成本较高。上述问题使得这些AGIs的开发利用进展缓慢。相信未来随着研究的不断深入,来源于海洋产物中的更加新颖、高效和安全的AGIs将会被陆续发现和应用。

