健脾养胃方联合新辅助化疗对胃癌患者临床疗效的影响及机制研究
谢晓东,强永虎,刘沈林,陈彦臻,吴旻,张星星
(1.南京中医药大学附属医院,江苏 南京 210029;2.南京中医药大学第一临床医学院,江苏 南京 210023)
胃癌在我国恶性肿瘤中发病率和病死率均居第2位[1]。尽管现代治疗手段不断发展,但我国胃癌5年生存率仅为35.9%[2]。肿瘤微环境是指在肿瘤生长过程中,由肿瘤细胞、间质细胞、微血管及浸润性免疫细胞共同构成的局部稳态环境。肿瘤细胞产生大量炎症因子、乳酸等,在肿瘤周围形成特殊的炎症微环境,招募并重塑微环境内的免疫细胞,使其不但丧失免疫监控、免疫清除的能力,而且释放多种免疫抑制介质,促进肿瘤发展[3],并直接减弱放化疗、靶向治疗的疗效,甚至引起治疗失败[4]。在肿瘤微环境中,调节性T细胞(Treg)是最重要的抑制性免疫细胞,通过细胞接触和大量分泌白细胞介素-2(IL-2)、白细胞介素-10(IL-10)、转化生长因子-β(TGF-β)等细胞因子而抑制免疫应答[5]。T细胞免疫球蛋白黏蛋白分子3(Tim3)是近年备受关注的T细胞免疫检查点分子,在肿瘤中该分子的过度激活可诱导T细胞耗竭和Treg表型的增加[6],且Tim3+Treg细胞比普通的Treg细胞具有更强的免疫抑制功能[7]。目前证实,Tim3的过表达与肺癌、胃癌等恶性肿瘤的不良预后密切相关[8]。
大量文献报道,中医药有减轻肿瘤微环境免疫抑制状态的作用[9]。益气健脾化瘀法是全国名中医刘沈林教授治疗胃癌的经验法则,临床可显著改善胃癌患者的生存质量、延缓中晚期胃癌的复发转移[10]。健脾养胃方即为该治法指导下的临床常用处方,荷胃癌小鼠实验也证实,该方与5-氟尿嘧啶(5-Fu)联用,有增加小鼠抑瘤率、延长小鼠生存时间的作用,但具体作用机制尚不明确[11]。新辅助化疗是在实施局部治疗方法(如手术或放疗)前所做的全身化疗,通过新辅助化疗使肿瘤缩小、降期,使原本难以手术的肿瘤有手术切除机会,并减少进入循环的肿瘤细胞,对预防术后复发有积极作用,但因其有一定的免疫损伤作用及耐药性,限制了部分临床患者的使用及疗效。本研究观察健脾养胃方与新辅助化疗联合使用对胃癌脾胃气虚证临床疗效的影响,并检测Treg细胞、Tim3分子的表达,探讨其可能的作用机制。
1 临床资料
1.1 一般资料
纳入2017年9月至2020年9月期间江苏省中医院胃癌住院患者56例。临床试验通过江苏省中医院伦理委员会批准(伦理批号:2017NL-097-02)。根据随机数字表法将患者分为治疗组27例和对照组29例。2组患者性别、年龄、病程、TNM分期[12]均无统计学差异(P>0.05)。见表1。

表1 2组患者一般临床资料比较
1.2 诊断标准
1.2.1 西医诊断标准 胃癌诊断标准参照中华人民共和国卫生部医政司编写的《胃癌治疗规范》[13],依据手术病理组织学明确诊断。TNM分期参照美国癌症联合会(AJCC)公布的胃癌国际分期标准[12]。
1.2.2 中医诊断标准 参考《中药新药临床研究指导原则》[14]和新世纪全国高等中医药院校规划教材《中医诊断学》[15]相关证候标准结合制定而成。
脾胃气虚证,主症:食少纳呆,食后或午后腹痛,气短懒言,体倦乏力,大便异常(溏、烂、先硬后溏、时溏时硬);次症:形体消瘦,腹胀,口淡不渴,恶心呕吐,脘闷肠鸣,肛门坠胀,面色萎黄,排便无力,舌质淡,舌体胖或有齿印,苔薄白或白润,脉细弱或沉迟。具备主症2项;或主症1项加次症2项,即可诊断。
1.3 纳入标准
①符合西医诊断与TNM分期标准;②中医证型属于脾胃气虚证;③不能行根治性手术或术后明确复发转移而不能手术治疗的患者;有化疗适应证且愿意接受化疗;④预期生存期3个月以上;⑤理解本研究的情况并签署知情同意书,获得知情同意书过程符合GCP规定。
1.4 排除标准
①不能经口进食(包括消化道梗阻、空肠造瘘)者;②同时进行放疗或使用其他抗癌药物者;③妊娠期、哺乳期妇女;④具有严重的原发性心、肝、肺、肾、血液疾病及糖尿病或影响其生存的严重疾病者;⑤由于智力或行为障碍不能给予充分知情同意者;⑥过敏体质,如对2种及以上药物或食物过敏史者;或已知对研究药物成分过敏者;⑦正在参加其他药物临床试验的患者。
1.5 剔除标准
①依从性差,未按方案规定剂量和疗程用药;②试验过程中出现严重不良反应、不良事件或并发其他疾病者;③其他研究员评估后认为应终止的情况。
2 方法
2.1 治疗方法
对照组:患者均采用奥沙利铂(艾恒,江苏恒瑞医药股份有限公司,50 mg/瓶)和替吉奥(维康达,山东新时代药业有限公司,25 mg/粒)为主的SOX术前新辅助化疗方案。第1天静脉滴注奥沙利铂,剂量130 mg/m2;第1~14天口服替吉奥,剂量40 mg/m2,每日2次,早晚餐后口服。第15天起停药7天,21 d为1个周期。共化疗2个周期。
治疗组:在对照组化疗方案基础上服用健脾养胃方:炙黄芪15 g,党参15 g,炒白术10 g,当归10 g,白芍10 g,陈皮6 g,法半夏10 g,三棱10 g,莪术10 g,石见穿30 g,白花蛇舌草30 g,炙甘草5 g。加减:①气滞加木香10 g,砂仁3 g(后下);②中焦虚寒加桂枝5 g,高良姜5 g;③胃阴不足加北沙参15 g,麦冬12 g;④脾阳不运加炮姜炭3 g,肉豆蔻5 g;⑤肝胃郁热加黄连3 g,吴茱萸1.5 g,煅瓦楞子30 g(先煎)。上述中药由江苏省中医院中药房每周2次按照临床需要量统一制作,按固定工艺煎煮,每袋200 mL真空包装,保存于5 ℃冰箱。服用前用37 ℃温水浸泡温化,上午9:00、下午3:00各1次口服,每次200 mL。21天为1个周期,共口服2个周期。
2组患者均完成术前新辅助化疗2个周期后行手术治疗。
2.2 观察指标与方法
2.2.1 肿瘤术前辅助治疗疗效评估 见表2。

表2 肿瘤术前辅助治疗疗效评估
所有入组患者在化疗完成后均按照上述方案行手术治疗。胃癌标本离体30 min内投入4%中性甲醛溶液,固定24 h送病理科。采用2019版肿瘤术前辅助治疗评估分级(肿瘤退缩分级TRG),判断患者术前辅助化疗的疗效。
2.2.2 中医证候积分评估 参照《中药新药临床研究指导原则》[14]中脾胃气虚证疗效评定标准制定的分级量化表,观察患者的主要症状如胃痛、乏力、纳差、气短、便溏及次要症状如腹胀、恶心呕吐、消瘦,依据患者临床表现分为无、轻、中、重4度,主要症状分别计分0分(无症状)、3分(轻度症状)、6分(中度症状)、9分(重度症状),次要症状分别计分0分(无症状)、2分(轻度症状)、4分(中度症状)、6分(重度症状)。患者治疗前,治疗第21天、42天分别评价1次。
积分比=(治疗前总积分-治疗后总积分)÷治疗前总积分×100%。疗效评定标准:临床痊愈:症状及体征消失,积分比为100%。显效:症状及体征基本消失,70%≤积分比<100%。有效:症状及体征好转,35%≤积分比<70%。无效:未达到上述标准者。
2.2.3 胃癌组织检测
(1)组织来源 胃癌标本离体30 min内取癌组织大小约0.5 cm×0.5 cm×0.5 cm,放入液氮保存;其余标本投入4%中性甲醛溶液固定24 h,送病理科梯度酒精脱水、二甲苯透明后浸蜡包埋,制成组织蜡块。
(2)试剂及仪器 FoxP3单克隆抗体(R&D公司,AF3240-SP);Tim3单克隆抗体(武汉三鹰公司,60355-1);SYBR Green(ABI公司,436759);Trizol(Ambion公司,15596018);逆转录试剂盒(TaKaRa公司,RR047A);PCR引物(Invitrogen公司);组织匀浆器(美国IKA公司);实时定量PCR仪7500fast型(美国ABI公司);高速冷冻离心机(美国Thermo公司);金属恒温浴(美国Thermo公司);超纯水机(美国Millipore公司);各量程移液器(德国eppendorf公司)。
(3)免疫组化检测患者瘤体中Tim3、FoxP3蛋白含量 对患者蜡块组织进行二甲苯脱蜡、乙醇水合、蒸馏水清洗。放入盛有抗原修复液的高压锅内高压修复3 min,待室温冷却后滴加FoxP3、Tim3一抗100 μL/片,37 ℃孵育2 h后,PBS浸洗3次;通用型二抗50 μL/片,37 ℃,孵育30 min后PBS浸洗3次;DAB溶液显色;显微镜下观察染色深浅以及时终止显色反应;苏木素复染,分化返蓝后,用梯度酒精脱水,浓度从低到高分别为70%、85%、95%、100%;二甲苯透明封片;显微镜下观察,拍照保存。
(4)实时定量PCR检测胃癌组织IL-10、IL-2、IL-8、TNF-α的mRNA表达 取出液氮中保存的肿瘤组织,PBS洗3次,加入Trizol试剂1 mL,研磨震荡,静置5 min;加入氯仿0.2 mL,静置5 min;4 ℃,10 000 r/min离心15 min取上清,加入等体积异丙醇混匀,静置10 min;4 ℃,10 000 r/min离心10 min;加入预冷的75%乙醇1 mL,轻轻混匀,4 ℃,7 500 r/min离心5 min,弃上清,室温晾干;紫外分光光度计上测定纯度及浓度。逆转录合成cDNA,逆转录反应条件:42 ℃,2 min,去除残留DNA;50 ℃,15 min,85 ℃,5 s。将cDNA进行PCR反应,实时定量PCR反应条件:94 ℃预变性,1个循环;94 ℃(5 s),55 ℃(15 s),72 ℃(10 s),共40个循环。实验结果采用2-ΔΔCt方法进行分析。引物序列见表3。

表3 目的基因的引物序列
2.3 统计学方法
3 结果
3.1 2组患者术前辅助治疗疗效评估
2组患者胃癌病理组织TRG分级结果显示,治疗组能改善胃癌患者的TRG分级,与对照组相比,差异有统计学意义(P<0.05),见表4。
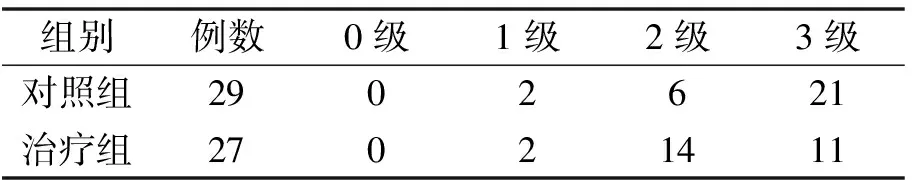
表4 2组患者TRG分级比较
3.2 2组患者治疗前后中医证候改善情况
结果见表5。

表5 2组患者治疗前后中医证候积分比较
3.3 2组治疗前后中医证候总积分对比
与治疗前相比,治疗组第42天后证候总积分明显改善(P<0.05),低于对照组(P<0.05)。见表6~7。

表6 2组患者治疗前后中医证候总积分比较
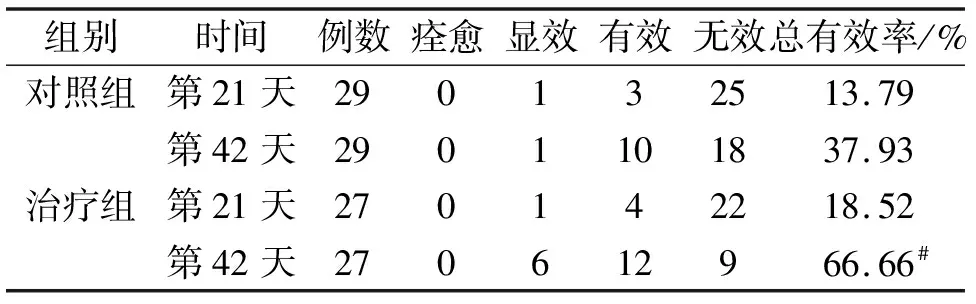
表7 2组患者中医证候总体疗效判定
3.4 2组患者胃癌组织中Tim3、FoxP3蛋白表达情况比较
与对照组相比,治疗组Tim3、FoxP3蛋白表达均有下降(P<0.05),见图1~2,表8。

表8 2组患者瘤体组织中Tim3、FoxP3蛋白表达情况比较

图1 2组胃癌患者病理组织Tim3表达情况(×200)
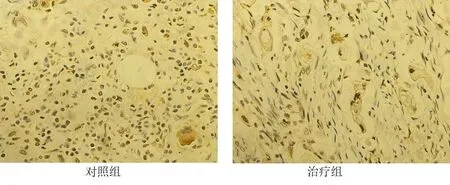
图2 2组胃癌患者病理组织FoxP3表达情况(×200)
3.5 2组患者肿瘤组织中IL-10、IL-2、IL-8、TNF-α mRNA表达情况比较
与对照组相比,治疗组肿瘤组织IL-8、IL-10的mRNA表达下降(P<0.05),IL-2、TNF-α的mRNA表达有升高趋势。见表9。

表9 2组患者肿瘤组织中炎症因子mRNA表达情况比较
4 讨论
在多年的临床实践基础上,全国名中医刘沈林教授认为胃癌的形成,多由正气不足,脾胃功能虚弱,而实邪踞之为患[16-17]。胃癌患者治疗关键在于健脾益胃,扶正祛邪。健脾养胃方是刘沈林教授的经验方,方中炙黄芪、党参、白术、炙甘草补益中气,当归、白芍补血和血,陈皮、半夏理气和胃,三棱、莪术、石见穿、白花蛇舌草化瘀解毒,诸药共奏健脾扶正,祛邪消癥之功。刘沈林教授运用健脾养胃方治疗胃癌患者取得了较好的疗效,但内在机制尚不明确。目前,NCCN、CSCO等一系列指南均明确表明,新辅助化疗不仅可提高手术切除率,而且可减少术后的复发转移,故在进展期胃癌的治疗中被广泛采用。但新辅助化疗在部分患者中存在敏感性不佳、损伤机体免疫功能的情况。如何提高机体对新辅助化疗的敏感性是目前亟待解决的问题。本研究观察了健脾养胃方与新辅助化疗联用对肿瘤术前辅助治疗疗效的影响。结果表明,与单纯新辅助化疗组相比,患者加用健脾养胃方后,TRG分级改善,说明本方有增加患者对术前辅助化疗敏感性的作用,其机制可能与胃癌组织Tim3、FoxP3等免疫抑制性相关蛋白表达降低,抑炎因子IL-8、IL-10水平降低有关。此外,通过中医临床症状评分,本研究发现与对照组相比,治疗组能有效降低患者乏力、纳差、消瘦评分,改善胃癌患者生活质量。
诸多文献表明,化疗敏感性与肿瘤微环境中免疫细胞及炎症因子表达密切相关。Treg细胞是肿瘤微环境中重要的免疫抑制性T细胞之一,可有力抑制抗肿瘤免疫应答,诱导化疗耐药[18]。FoxP3是Treg细胞的标记蛋白,可反映组织中Treg细胞的表达情况。本研究在胃癌患者瘤体中观察到,与单纯化疗组相比,治疗组FoxP3蛋白表达降低,表明本方可抑制Treg细胞在胃癌组织中的数量。Tim3是一种免疫负性调节因子[19],与CTLA-4和PD-1被归类为免疫系统的抑制性受体,可诱导T细胞耗竭,增加Treg细胞的免疫抑制功能[20-22]。提示通过调节Tim3、CTLA-4和PD-1的表达可改善肿瘤微环境中免疫抑制状态。李园等人研究发现健脾扶正方可抑制CD4+CD25+FOXP3+Treg细胞水平,从而增强细胞免疫功能,改善脾虚湿热证大肠癌术后化疗患者的临床症状[23]。刘玉等研究表明中药可通过抑制Tim3表达,负向调节使Th1表达增高,正向调节使Th2表达量下降[24]。杨玉琪等发现扶正抗毒丸或康爱保生丸治疗的HIV感染者T细胞表面PD-1和Tim3的表达与治疗前比有所下降[25]。这些研究均表明了中医药调节免疫抑制性细胞的可能性。本研究同样在胃癌组织中观察到,治疗组T细胞免疫检查点Tim3蛋白表达降低,这可能是健脾养胃方抑制胃癌中Treg细胞数量的重要原因。
文献表明,Treg细胞可通过接触依赖和释放IL-10、IL-8等细胞因子抑制抗肿瘤免疫[26]。IL-8是体内重要趋化因子和炎症介质,在感染、肿瘤等病理情况下,由具有Toll样受体的细胞分泌,在炎症局部、血清和体液中显著增加。IL-8是肿瘤微环境中重要的免疫抑制因子,不仅可以促进肿瘤进展、参与肿瘤血管生成,还具有招募免疫抑制细胞,抑制抗肿瘤免疫应答的能力,更与肿瘤的耐药息息相关[27]。IL-10可由淋巴细胞、巨噬细胞等免疫细胞产生,并进一步抑制活化的T细胞产生细胞因子,抑制细胞免疫应答,诱导机体免疫抑制状态,导致肿瘤免疫逃逸[28]。一些研究也提示肿瘤相关巨噬细胞调控的IL-10释放与肿瘤细胞的多药耐药相关蛋白表达有关[29]。近年来一些文献也提示中医药可通过干预上述靶点,缓解化疗耐药。如洪文文研究发现相比于单纯化疗治疗进展期胃癌患者,香砂六君子汤联合化疗组IL-10水平较低[30]。张云璧等发现丹皮、赤芍等6味中药同时对TNF-α刺激角质形成细胞分泌细胞因子IL-8的作用有抑制效果,拳参、赤芍2味药物作用尤为明显[31]。本研究证实健脾养胃方治疗组胃癌组织中炎症因子IL-10、IL-8的水平明显降低,这可能与本方抑制Treg细胞转化,减少其分泌免疫抑制因子有关。
综上所述,健脾养胃方与新辅助化疗联用可增加胃癌患者化疗敏感性,促进胃癌的退缩,改善患者生活质量。机制可能与该方抑制胃癌微环境中Tim3蛋白表达、减少Treg细胞数量,进而降低炎症因子IL-10、IL-8水平,减少化疗耐药,促进机体抗肿瘤免疫有关。但本研究也存在一定局限性,如研究观察时间较短、纳入样本量偏少、未采用多中心研究等,后期我们将对现有胃癌患者进行长期随访观察,并在临床工作中进一步扩大样本量,为临床用药提供更为明确的依据。

