不同光质补光处理对人参光合作用和产量的影响
魏帛轩,吴艾轩,徐瑞蔓,李 茜,赵洪颜,朴仁哲
(延边大学农学院,吉林 延吉 133000)
人参(PanaxginsengC.A.Mey.)是五加科人参属的喜阴植物[1]。因其对光照环境的严格要求,农田栽参大部分为荫棚种植。光是植物生长发育不可缺少的环境因素[2],是植物进行光合作用的能量来源[3],不同的光照条件对植物生长发育有一定的影响:红光可以促进种子的萌发和根的发育,可以通过诱导光敏色素的转化影响植物的形态发生变化[4];蓝光对于叶绿体发育,叶绿素合成,气孔开放和光形态发生以及调节叶绿素和花色素苷的生物合成有很重要的作用[5];红蓝混合光补光能够提高叶片总叶绿素、叶绿素a、叶绿素b和类胡萝卜素含量,补照红蓝复合光、蓝光、红光和白光均不同程度的提高了叶片叶绿素(SPAD)值[6]。农田栽参以蓝色棚膜覆盖为普遍,也有以黄色棚膜覆盖的栽种方式,但是蓝色棚膜下的人参光合作用指标显著高于黄色棚膜下人参的光合作用,蒸腾速率、水分利用效率和表观叶肉导度变化趋势与净光合速率以蓝膜显著[7-8]。不同颜色的棚膜下,人参叶绿素含量、光合速率、产量和质量及总皂甙含量等综合指标均有差异,以绿色膜在人参上应用效果最佳[9]。在对同是五加科的三七进行不同颜色棚膜试验中,红膜有利于三七的株高生长,青、黄、紫、蓝膜均有利于三七地下部分生物量的积累[10-11],100 μmol·m-2·s-1光强时,不同LED光质下橙光与蓝光处理的根和全株鲜重最大,蓝光处理根冠比最大[12]。
因有关人参补光的研究在国内很少,因此该研究旨在利用不同光质LED灯进行日出前和日落后补光处理,探讨补光对于人参光合作用的影响,为设施栽参提供参照依据。
1 材料与方法
1.1 试验设计
设置6个小区分别为白光(W)、蓝光(L)、黄光(Y)、红光(R)和红蓝混合光(M)5个处理以及不补光的对照组(CK),并重复3次,每个小区面积9 m2,人参行距18 cm,株距8 cm,在人参叶片全部展开后对各处理进行补光,补光时间为日出前2 h和日落后2 h,并根据春季至秋季的日出和日落时间变化,每隔3 d调整1次补光时间,补光设施为山东贵翔光电有限公司的LED植物灯,在枯萎期前停止补光,整个试验处理在人参的开花期、绿果期、红果期3个时期测定各项指标。
1.2 测定指标和方法
1.2.1 光合作用测定
每个处理选取大小一致且叶片之间没有遮挡的植株。在每个重复中选取3株测定。用上海泉泽GFS-3000便携式光合测定仪,测定人参叶片净光合速率(Pn)、气孔导度(Gs)、胞间 CO2浓度(Ci)、蒸腾速率(Tr),结果取3株测定结果的平均值。
4项指标的测定分别在开花期、绿果期、红果期选择晴朗天气上午的 9:00~11:00 进行。
光合作用日变化的测定时期为绿果期,7:00~17:00每间隔2 h测定1次,并在日落后开灯1 h后再进行测定。
1.2.2 叶绿素荧光参数
待测叶片经过充分暗适应后照射检测光,测得初始荧光(Fo);再施加1个饱和脉冲光0.7 s,1个脉冲后关闭,测得最大荧光(Fm);然后打开内源光,测得Fs;这时照射饱和脉冲光测得Fm’;关闭作用光后立即打开远红光,测得Fo’。相关荧光参数计算如下:
最大量子产量:Fv/Fm=(Fm-Fo)/Fm
实际量子产量:Y(II)=(Fm’-F’)/Fm’
光化学淬灭系数:qP=(Fm’-F’)/(Fm’-Fo’)
qL=qP*Fo’/F’
非光化学淬灭参数:qN=1-(Fm’-fo’)/(Fm-Fo)
NPQ=Fm/Fm’-1
相对电子传递速率:ETR = PAR·ETR-Factor·PPS2/PPPS·Y(II)
1.3 分析方法
采用Excel 2010和SPSS 17.0进行单因素方差分析,多重比较选择Duncan检验 (P<0.05),相关性分析采用Pearson法。
2 结果与分析
2.1 不同光质补光对人参光合特性的影响
2.1.1 不同光质补光处理对人参生育期光合特性的影响
由图1可以看出,在人参生长过程中的净光合速率变化为开花期处于较高水平,绿果期净光合速率最高,红果期光合速率下降,是由于绿果期是果实生长的旺盛时期,这时植株需要更多的能量,且这个时期温度高,但空气流动减慢,且降雨量增大,空气潮湿,而红果期生长缓慢甚至停止,光合作用开始下降。各时期内各处理具体表现为开花期各处理中黄光和蓝光显著高于其他处理,其次是红蓝混合光,除白光外各处理均显著高于对照。绿果期红蓝混合光显著高于其他处理,蓝光显著高于对照,同时也高于红光、黄光和白光,但差异不显著。红果期混合光、蓝光和红光高于对照和其他处理,其他几个处理间差异不显著。
植物为适应光环境会加强自身的蒸腾速率及气体交换以确保自身的存在[13]。图2表示各生育期蒸腾速率的变化,大致的变化规律与净光合速率相似,绿果期大于开花期大于红果期,但从开花期到绿果期,变化没有净光合速率变化大,虽然绿果期温度高,但空气流动减慢,且降雨量增大,空气潮湿,都是使人参叶片蒸腾速率呈此趋势变化的原因,此外,蒸腾速率在很大程度上决定于气孔导度[14]。各时期红蓝混合光和蓝光高于对照和其他处理,在开花期除白光外其他处理均高于对照,但蓝光、黄光、红光和红蓝混合光间差异不显著;绿果期混合光和蓝光显著高于其他处理;红果期各处理差异显著,从高到低依次为混合光、蓝光、红光、白光、对照和黄光。
气孔导度的变化可以影响光合作用,并通过调节叶片的蒸腾作用来适应环境[15]。由图3可知,人参叶片在各时期的叶片气孔导度变化与叶片净光合速率和蒸腾速率有着相似的变化趋势,气孔的开放程度直接控制水分和CO2,绿果期的气孔导度明显高于开花期和红果期。在开花期黄光显著高于其他处理,红光与混合光也高于白光、蓝光和对照;绿果期各时期气孔导度明显增加,混合光显著高于其他处理,黄光和蓝光也显著高于红光、白光和对照;红果期各处理间最高的是混合光,然后依次是白光、蓝光和红光。
由图4可知,各生育期内的胞间CO2浓度也表现为绿果期高于另2个时期,但各时期间增加和降低的幅度不大。开花期蓝光显著高于其他处理,其他处理间差异不显著,混合光最低;绿果期除蓝光和对照相差不大,其他处理均显著高于对照,混合光最高,红果期混合光最高,其次是白光和蓝光,黄光和红光处理低于对照。
2.1.2 不同光质补光处理对人参光合特性日变化的影响
由图5~8可知,在1 d光合特性日变化中,净光合速率、蒸腾速率、叶片气孔导度在9:00~11:00皆处于最高峰,但胞间CO2浓度CK和红蓝混合光略有下降;11:00~13:00净光合速率、蒸腾速率、叶片气孔导度和胞间CO2浓度皆下降;13:00~15:00,除CK的蒸腾速率、黄光下的叶片气孔导度和胞间CO2浓度下降外,其他处理的各指标皆略有回升;净光合速率、蒸腾速率、叶片气孔导度在15:00~17:00,各处理均有下降,但胞间CO2浓度除蓝光处理下降外,其他光照处理均有上升;在开灯1 h后,净光合速率除蓝光和红蓝混合光略有上升外,均呈下降趋势,除CK、白光、黄光的蒸腾速率略有上升外,其余处理的蒸腾速率减弱,叶片气孔导度、胞间CO2浓度在各处理中,在开灯1 h后皆呈减弱趋势。
结果说明,9:00~11:00是1 d中净光合速率最大的时间段,其他时间由于温度、光照强度等原因导致净光合速率较低;蒸腾速率早、中、晚较低,上午和下午较高,由于上午下午光合作用较强,中午温度过高气孔关闭导致蒸腾速率较少;气孔导度较高的时间段混合光和蓝光的气孔导度均高于其他处理,在中午之后黄光的气孔导度变化较小,叶片气孔导度受温度和CO2浓度等共同影响,温度过高,为了减少水分蒸发,气孔导度会减小;下午到傍晚胞间CO2浓度高是由于这一时段人参叶片净光合速率相对较低,叶片吸收同化CO2的能力相对较弱,这段时间CO2会逐渐积累并扩散到细胞间隙中,造成胞间CO2浓度增多。
2.2 不同光质补光处理对人参叶绿素荧光参数的影响
2.2.1 不同光质补光处理对人参生育期叶绿素荧光参数的影响
Fo表示初始荧光,是PSII反应中心完全开放时的荧光产量,该值的增加表明 PSII反应中心受到了破坏或造成了可逆性失活,而且增加的越多,说明损伤程度越严重。由表1可知,Fo在开花期,各处理低于对照组,但无显著差异,绿果期,各处理均显著高于对照,其中,黄光最高,与其他几个处理差异不显著,红果期红蓝混合光高于其他处理,黄光最低,随着补光时间的增加,整个生育期内,CK呈先下降后上升趋势,黄光先上升后下降,其他处理呈先升高后平稳的的趋势,说明在绿果期和红果期黄光和混合光的PSII反应中心受到的破坏较大。
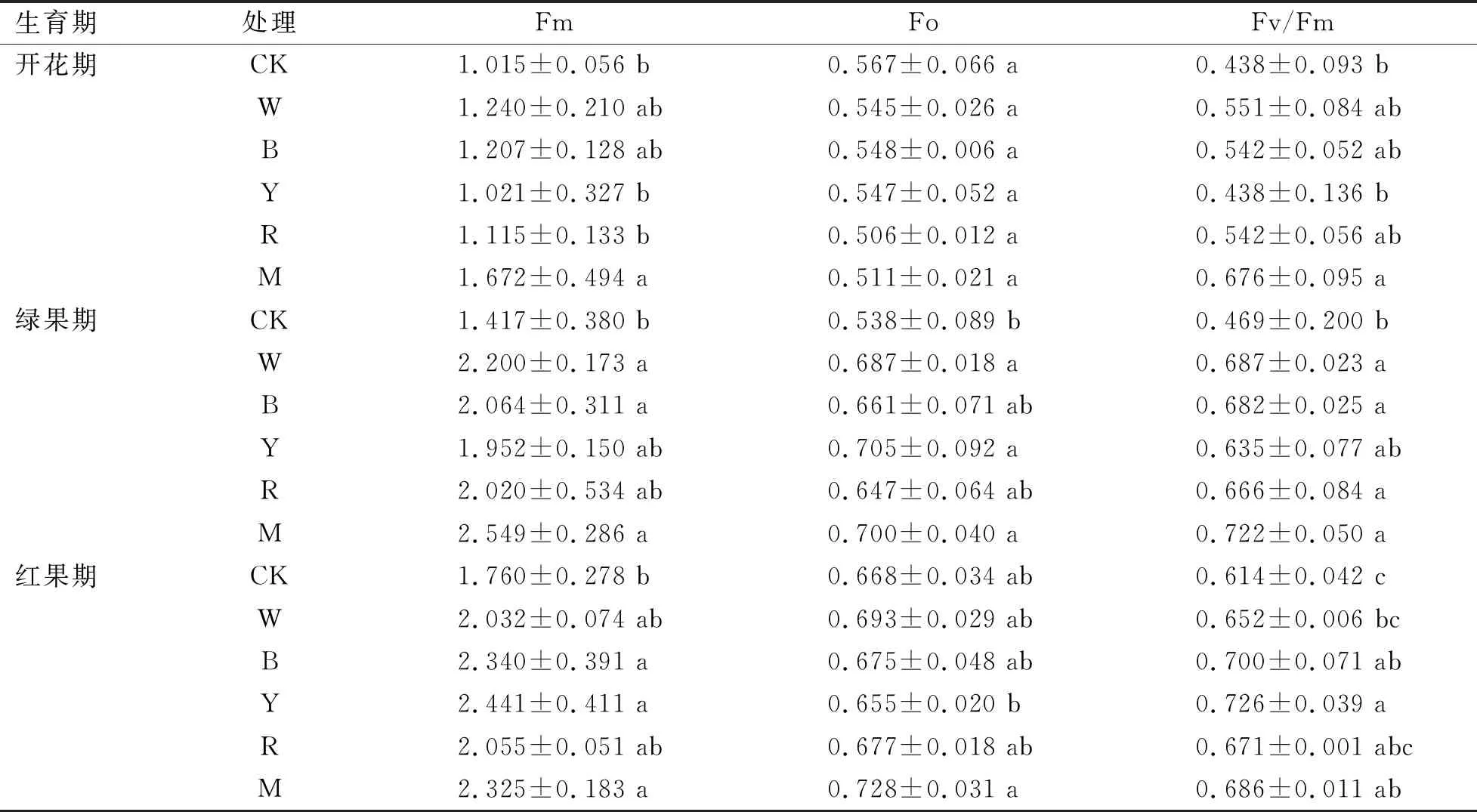
表1 不同光质补光处理对人参各生育期叶绿素荧光参数(Fm、Fo、Fv/Fm)的影响Table 1 Effects of different light quality supplementary light treatments on chlorophyll fluorescence parameters (Fm,Fo,Fv/Fm) of ginseng at different growth stages
Fm表示最大荧光,是指光系统II反应中心完全关闭时荧光的产量,反映PSII电子传递的情况,Fm降低是环境抑制了PSII原初光化学活性的表现,Fm在开花期白光、蓝光和混合光显著高于对照和其他处理,其中,混合光最高,绿果期和红果期各处理也均高于对照,说明各处理均能不同程度的提高PSII的电子传递速率,混合光效果最好。
Fv/Fm能够反映光系统II的光能转换效率,当植物受到胁迫时,该指标会明显下降,是植物是否发生光抑制最明显的特征,Fv/Fm值的降低说明环境使PSII原初光化学活性受到抑制作用[16],Fv/Fm随着处理时间的增加与Fm有相似的变化趋势,在开花期和绿果期混合光显著高于其他处理,各处理在各个时期均高于对照,除白光和混合光在红果期有下降趋势,其他处理均持续上升,其中,黄光变化最显著,在红果期均高于其他处理,说明白光和混合光的光抑制较明显,而黄光处理下的人参光抑制较小。
Y(II)是有效量子产量,表示PSII的实际光化学效率,能够反映光化学反应对光能的利用情况,当植物的PSII开放性能下降时,实际光化学效率会显著降低[17]。由表2可知,Y(II)除黄光开花期与绿果期差异不显著,其他处理均呈持续上升趋势,其中,红光在整个生育期变化最大,红果期比开花期增加了118%,说明在整个生育期红光处理对光能的利用率较高。
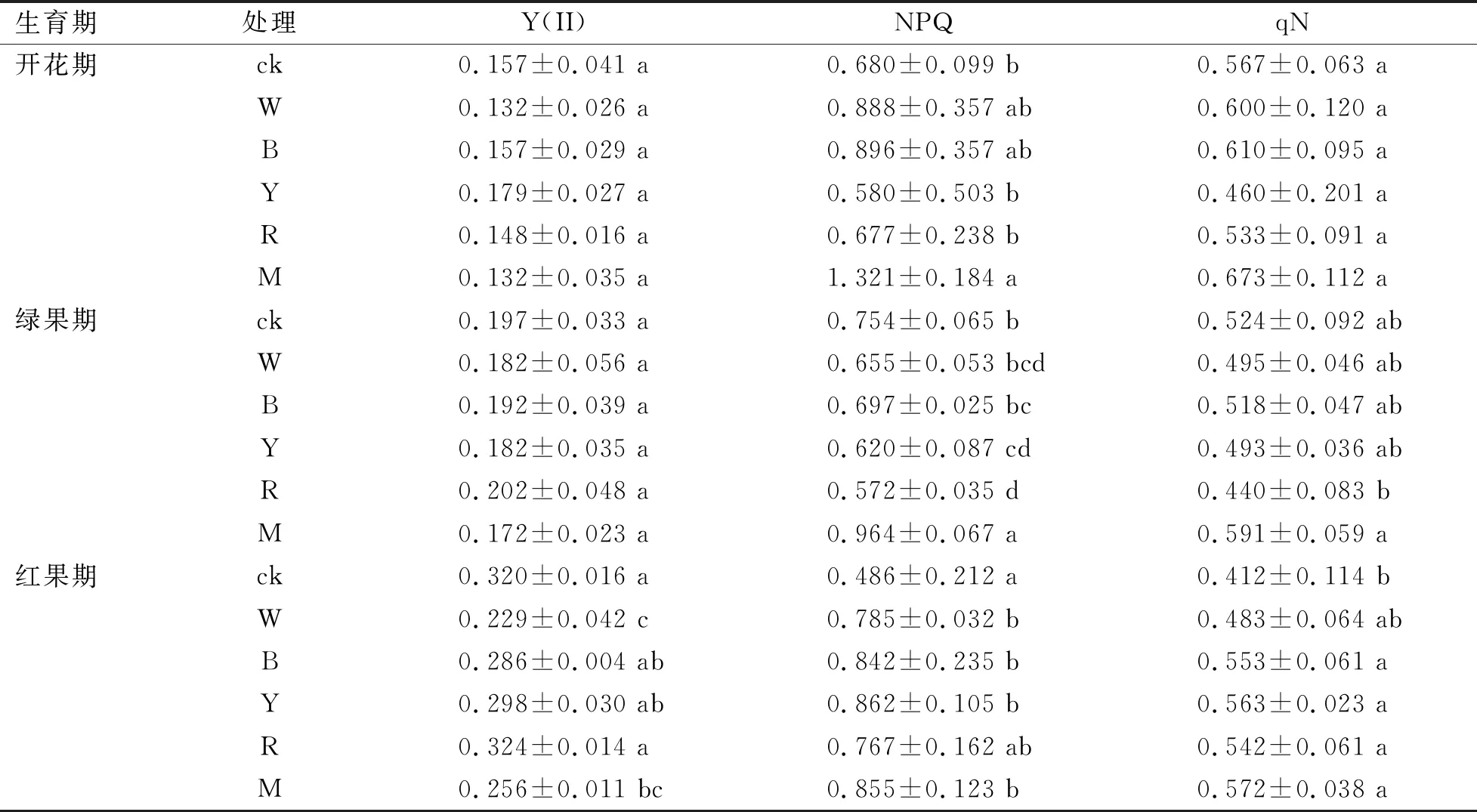
表2 不同光质补光对人参各生育期叶绿素荧光参数(Y(II)、NPQ、qN)的影响Table 2 Effects of different light quality supplementary light on chlorophyll fluorescence parameters (Y(II),NPQ,qN) of ginseng in different growth periods
NPQ和qN是非光化学猝灭系数,表示PSII吸收的光能无法用于光合电子传递而以热能的形式散失掉的部分[18],其值大小表示光合机构的损伤程度,其值降低说明光能用于光化学反应的比例增加[19],NPQ开花期和绿果期红蓝混合光均最高,且显著高于对照,红果期CK最高,除红光外其他处理组均显著低于对照,非光化学淬灭系数(qN)在开花期和绿果期各处理组与对照之间差异不显著,红果期除白光外各处理组均显著高于对照,NPQ的黄光处理是持续上升的,对照先升高后降低,红蓝混合光持续下降,其他几个处理均先降低后升高,对于整个生育期而言,红光和黄光NPQ增加了,分别增加了48.4%和13.2%,其他几个处理均有不同程度的下降,其中,对照下降的最大,下降了28.5%;蓝光和红光的qN先下降后升高,黄光一直升高,其他处理组从开花期到红果期持续升高,从整个生育期来看,各处理组中红光和黄光的qN是增加的,分别增加了1.75%和22.4%,其他处理的qN是下降的,其中,对照组减少的最低,减少了27.4%,可以看出混合光下叶片吸收的光能以热能散失的部分最少。
qP、qL是光化学猝灭系数,表示光合作用反应中心的开放程度[20],由表3可知,光化学淬灭系数(qP)在开花期黄光显著高于红蓝混合光和红光处理,绿果期无显著差异,红果期各处理均低于对照,光化学淬灭系数(qL)在开花期与qP相同,也是黄光最高,绿果期和红果期各处理也均低于对照。qP、qL整个生长期内存在相似的变化趋势,整体呈先下降后升高的趋势,整个生育期中红蓝混合光、红光处理的qP变化最大,红果期相对开花期分别增加了70.0%和68.1%,除黄降低了6.5%外,对照升高的最小,升高了24.6%;qL呈现同样结果,红蓝混合光和红光变化最大,分别增加了72.1%和67.4%,说明开花期黄光的电子传递活性最大,混合光和红光的光化学淬灭增长率最高。

表3 不同光质补光对人参各生育期叶绿素荧光参数(qP、qL、ETR)的影响Table 3 Effects of different light quality supplementary light on chlorophyll fluorescence parameters (qP,qL,ETR) of ginseng at different growth stages
ETR表示通过PSII的电子传递速率,ETR在开花期和绿果期各处理与对照差异不显著,红果期红光处理最高,与黄光和对照无显著差异,显著高于白光、蓝光和红蓝混合光处理,整个生长期内呈升高的趋势,说明红光和黄光能够提高PSII的电子传递速率。
2.2.2 不同光质补光处理对人参叶绿素荧光参数日变化的影响
由图9~12可知,整体来看,Fm 1 d内变化不大,蓝光和混合光在9:00~11:00上升,在11:00~13:00下降,其他处理变化不显著。除混合光外,各处理Fo 1 d中最高的是上午7:00~9:00,中午11:00~13:00下降,13:00之后开始回升,直到傍晚均保持较稳定水平。Fv/Fm 1 d中变化不大,整体从早上开始升高,中午之后保持平稳不变,上午在各处理组Fv/Fm均高于对照,7:00~9:00黄光和混合光高于其他处理组,中午时混合光低于对照和其他处理组。
由图13~14可知,NPQ、qN 1 d内的变化趋势相似,上午时较高,11:00~13:00开始下降并在整个下午都保持较低的平稳水平,除对照组和黄光上午处于持续的下降,其他处理9:00~11:00的NPQ、qN均高于7:00~9:00。
由图15~16可知,qP、qL与Y(NPQ)、NPQ、qN的变化相反,呈上午低下午高的趋势,7:00~9:00,9:00~11:00变化缓慢,13:00之后明显高于上午,7:00~9:00各处理差异较大,且各处理均低于对照,各处理中混合光最高,白光和黄光较低。
由图17可知,ETR整体呈上午高下午低的趋势,7:00~11:00变化较小,13:00之后开始下降,7:00~9:00是混合光高于其他处理,9:00~15:00红光高于其他处理。
2.2.3 叶绿素荧光参数之间的相关性分析
由表4可知,Fm和Fv/Fm呈极显著正相关,二者都是反应植物是否发生光抑制的参数,Fm还与NPQ、qN呈显著正相关,和qP和qL呈显著负相关,因为NPQ、qN反映的是电子传递过程中以热能的形式耗散掉的光能部分,qP和qL表示植物对光能的利用效率,Fv/Fm和NPQ、qN呈显著正相关,Y(II)与ETR呈极显著正相关,二者是表示光化学效率和电子传递效率,NPQ和qN都是表示非光化学猝灭系数,二者与光化学淬灭系数呈负相关,qP和qL之间也是极显著正相关,原因是二者只是基于不通过的模型计算。
2.3 不同光质补光处理对人参生长的影响
由表5可知,停止对人参光照后每个处理随机挖取9株人参,对其生长指标进行考察,茎高、根粗、根鲜重、根干重均表现为混合光处理均最高,混合光的茎高比对照高24.57%,黄光和红光也较高但与其他处理差异不显著;根长各处理均高于对照,但差异不显著;混合光和蓝光的根粗最大,但与对照差异不显著,分别比对照高14.8%和6.78%,红光显著低于对照和其他处理;混合光下根鲜重显著高于其他处理和对照,其他处理及对照间无显著差异;根干重同样混合光显著高于对照和其他处理,其他处理和对照间无显著差异,混合光比对照高52.38%。整体来看,红蓝混合光下人参生长状况最好。
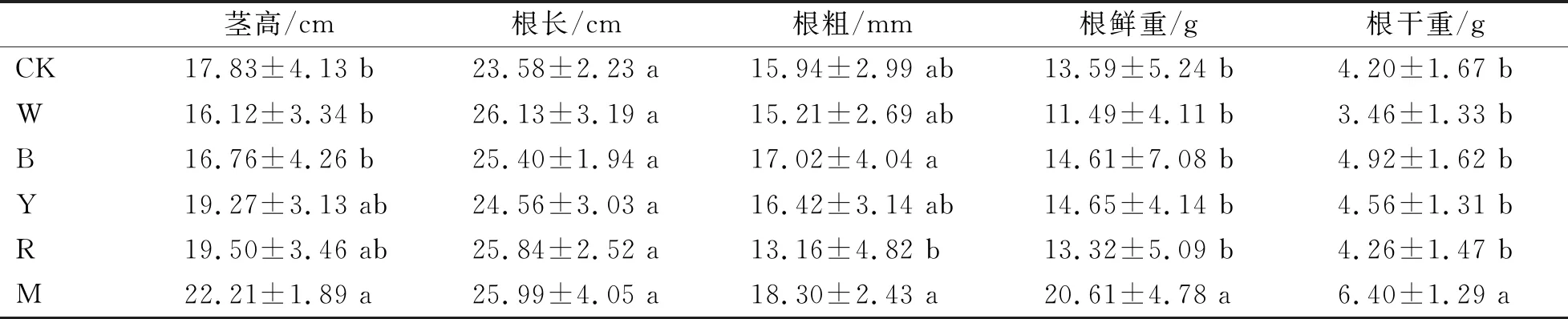
表5 不同光质补光处理对人参生长的影响Table 5 Effects of different light quality supplemental light treatments on ginseng growth
3 讨论
从生长指标上看,红蓝混合光处理下的人参长势最好,黄光和红光能够提高植株高度,蓝光能够增加根粗,蓝光和黄光能够增加叶片长度和叶片高度,刘辉等[21]表示,在红蓝光配比照射下植物的高度与宽度之比和叶长与宽度之比均最高。Ren X等对轮叶党参照射红光、白光和红蓝混合光的研究表明,在红蓝混合光下生长的幼苗,总生物量,茎粗,枝重与枝长的比率,根生物量以及根重与枝重的比率最大[22]。闫晓花研究表明[7],利用红蓝混合光对黄瓜幼苗进行补光,对叶绿素荧光参数表现为红蓝混合光Fv/Fm、ΦPSII和光化学猝灭系数(qP)值显著高于对照,且均高于补充蓝光、红光的处理,而非光化学猝灭系数(NPQ)低于其他处理。李强等[23]对茅苍术的研究表明,表明对茅苍术进行红蓝光混合处理下其叶片的光合作用显著高于其他处理。尹娟[24]对芹菜叶片光合色素和光合荧光特性的研究表明,红蓝混合光(6∶1)处理下Fv/Fm和Fv/Fo、ΦPSⅡ和qP高于其他处理,不同光质下芹菜净光合速率(Pn)、气孔导度(Gr)、蒸腾速率(Ts)整体上呈正相关,与胞间 CO2浓度(Ci)呈负相关;在红蓝光(6∶1)处理下光合速率、气孔导度和蒸腾速率均显著高于其他处理,除胞间CO2浓度在蓝光处理下最高,与该研究得到的结果相似。
4 结论
1) 补光对人参光合作用及叶绿素荧光参数均有显著影响,其中,红蓝混合光和蓝光显著增加了净光合速率、气孔导度、蒸腾速率和胞间CO2浓度。
2) 混合光和红光的电子传递速率较大,生长后期物质积累时黄光更有利于PSII电子的传递和PSII的光能转换效率,且对光能的利用率较高,黄光的电子传递活性最大,混合光处理下人参叶片吸收的光能以热能的形式耗散掉的光能部分较低。
3) 净光合速率、蒸腾速率和叶片气孔导度1天中均呈现“双峰”变化的趋势,且其峰值均分别出现在上午9:00-11:00和下午13:00-15:00,一天中这2个时间段人参叶片的光合作用较强;一天中上午时人参的电子传递效率较高,下午电子传递效率开始降低。
4) 红蓝混合光对于人参茎高、根粗、根鲜重、根干重有一定的促进作用,白光下根长的增长比红蓝混合光的效果略微明显,但总体差异不大,蓝光下根粗的增长略低于红蓝混合光。

