南极磷虾蛋白抗氧化酶解物的制备及其活性研究
党慧敏,郑平安,赵文浩,王 斌
(1.浙江海洋大学食品与药学学院,浙江舟山 316022;2.浙江海力生生物科技股份有限公司,浙江舟山 316022)
南极磷虾Euphausia superba 生物量可达(6.5~10)×108t,是世界上最大的生物资源之一[1-3]。研究表明南极磷虾富含多种营养成分和功能分子,其脂质含量约为2.11%,主要是不饱和脂肪酸,易于人体吸收,能够预防老年痴呆、降压、降脂、预防冠心病及动脉粥样硬化、提高免疫力和降低心血管疾病发病率[4];蛋白质含量超过60%,含人体所需的8 种必需氨基酸,生物效价远高于肉类蛋白质和牛乳蛋白质[5-7];南极磷虾的甲壳中含有的虾青素能预防肾病、糖尿病、增强免疫力、促进生长繁殖,甚至起到减肥的功效[8];此外,南极磷虾富含维生素A、维生素E、钙、镁、锌、磷、碘、铁和硒等[9]。因此,南极磷虾具有可观的经济和研究价值。
肽是介于氨基酸和蛋白质之间以肽键将氨基酸链接形成的一类化合物,具有抗氧化、抗肿瘤、消除疲劳、抗菌、抗高血压和抗炎等生物活性,在食品、医药、农业等较多的领域具有广阔市场前景[10-12]。海洋生物长期生活在高盐、高压、低温、缺氧等极端环境中,其蛋白质的氨基酸组成或序列都与陆地生物蛋白有很大的不同,潜在着许多具有生物活性的氨基酸序列[13]。因此,以海洋生物蛋白资源为原料,利用酶工程技术开发天然、高效、新颖的海洋蛋白酶解物或者活性肽成为研究焦点[13-15]。例如:李亚会等[16]利用动物蛋白水解酶和风味酶水解拟沙丁鱼Sardinops sagax 蛋白,利用超滤获得的抗氧化肽,可调节细胞中失衡的抗氧化体系,显示良好的保护作用。邓志程等[13]利用酶解、超滤和色谱技术制备马氏珠母贝Pinctada martensii 免疫活性肽AR/PM 和VR,可显著促进脾淋巴细胞的增殖与提高巨噬细胞的吞噬能力。张元元[17]采用超滤膜法分离南极磷虾多肽,MW≤5 ku 的多肽超氧阴离子、羟自由基和DPPH 自由基的清除能力最佳,并对小鼠模型表现出较好的抗氧化活性。
南极磷虾是重要的蛋白资源,以其为原料制备蛋白酶解物或者活性肽也备受关注。ZHAO Yuqin,et al[18]从南极磷虾胰蛋白酶酶解物中制备了8 个ACE 抑制寡肽,其中Phe-Ala-Ser (FAS) 可促进HUVEC 细胞中内源性舒张因子(NO)的释放,抑制内皮素(ET-1)的生成。XIA Guanghua,et al[21]证明磷酸化的南极磷虾多肽可以显著的阻止去卵巢大鼠骨质量的降低,改善松质骨结构和生物化学特性。HOU Hu,et al[20]发现南极磷虾寡肽VLGYIQIR 可以作为一种新型的钙补充剂。基于此,本实验以自由基清除率为指标,筛选制备南极磷虾蛋白抗氧化酶解物(EPAH)的最适酶种,并对其氨基酸组成和抗氧化活性进行综合分析,为南极磷虾资源的高值化利用提供支持。
1 材料与方法
1.1 材料与试剂
南极磷虾虾粉(脱脂)由浙江海力生生物科技股份有限公司提供。张氏肝细胞(Chang liver)购买于中国科学院上海细胞库。活性氧(ROS)测试盒购买于南京建成生物工程有限公司。胰蛋白酶(200 000 U·g-1)、碱性蛋白酶(160 000 U·g-1)、胃蛋白酶(500 000 U·g-1)、中性蛋白酶(50 000 U·g-1)和风味蛋白酶(300 000 U·g-1)购买于上海源聚生物科技有限公司。
1.2 实验方法
1.2.1 蛋白酶种类筛选
将南极磷虾虾粉(脱脂)按照料液比1:20 加入到酶解溶液中,搅拌均匀。选用胰蛋白酶、碱性蛋白酶、胃蛋白酶、中性蛋白酶和风味蛋白酶,在其最佳酶解条件下(表1)进行酶解。双酶体系(胃蛋白酶+胰蛋白酶)制备EPAH 时,溶液pH 首先调至2.0,加入1.0%胃蛋白酶,于37 ℃酶解2 h;然后将溶液pH 调至8.0,加入1.0%胰蛋白酶,于37 ℃酶解2 h。酶解液于沸水浴灭酶10 min,以4 000 r·min-1的条件下离心15 min,舍弃下层沉淀,上清液冷冻干燥得南极磷虾蛋白抗氧化酶解物(EPAH),以DPPH 自由基(DPPH·)和羟基自由基(HO·)清除率为指标评价EPAH,筛选最适酶种及其组合。

表1 5 种蛋白酶的酶活力及最适温度和pHTab.1 The enzyme activity,optimum temperature and pH of the five enzymes
1.2.2 自由基清除和脂质过氧化抑制实验
DPPH·和HO·清除率实验参照文献[21-22]描述的方法进行。脂质过氧化抑制实验参照文献[23-24]描述的方法进行。
1.2.3 氨基酸组成成分分析
参照GB 5009.124-2016 使用氨基酸分析仪进行测定。按照联合国粮农组织/世界卫生组织(FAO/WHO) 1973 年建议的氨基酸评分标准模式[25]和中国预防医学科学院提出的鸡蛋蛋白质评分标准模式进行比较分析,包括:氨基酸评分(AAS)、化学评分(CS)和必需氨基酸指数(EAAI)[26]。
1.2.4 细胞氧化损伤保护实验
1.2.4.1 氧化损伤模型的建立
将张氏肝细胞按照1.5×105个/孔接种于4 个96 孔培养板,置于37 ℃、5% CO2的恒温箱中孵育24 h后,继续将每个96 孔板分为空白对照组和8 个实验组,空白组加入20 μL 细胞培养基,8 个实验组分别加入20 μL 的双氧水(H2O2)使其终浓度分别为100、200、300、400、500、600、700 和800 μmol·L-1,平行6 个复孔。培养12 h 后,加入20 μL 5 mg·mL-1的噻唑蓝(MTT)溶液,培养4 h,将孔内液体倒置在吸水纸上吸干,每孔再加入150 μL 的二甲基亚砜(DMSO),37 ℃避光震荡15 min,于570 nm 波长测定吸光值(OD)。细胞存活率按以下公式计算:

式中:CSR 为细胞存活率,%;OD实验组为实验组吸光值;OD空白对照组为空白对照组吸光值。
1.2.4.2 南极磷虾蛋白水解物对氧化损伤张氏肝细胞细胞给药浓度的筛选
将制好的细胞悬液接种于96 孔板。待细胞贴壁后加双氧水处理12 h,建立张氏肝细胞氧化损伤模型。同时将细胞分为空白组、10 mg·mL-1、20 mg·mL-1、30 mg·mL-1EPAH 给药组培养24 h,通过MTT 实验检测EPAH 对细胞存活率的影响。
1.2.4.3 南极磷虾蛋白水解物对氧化损伤张氏肝细胞细胞存活率的测定
将张氏肝细胞接种于96 孔板,建模后将细胞分为空白组、模型组、EPAH 组和GSH 组,以最佳浓度的EPAH (15 mg·mL-1)干预24 h,再检测细胞存活率。
1.2.4.4 细胞内活性氧(ROS)水平的测定
细胞前处理方法同1.2.3.1,在加入20 μL 双氧水(H2O2)的同时加入10 μmol·L-1的荧光染料2',7'-二氯荧光黄双乙酸盐(DCFH-DA),并在恒温细胞培养箱中培养2 h。然后用磷酸盐缓冲液洗涤细胞2 次。通过荧光显微镜(激发/发射波长为485 nm/535 nm)进行定量分析。
2 结果与讨论
2.1 蛋白酶种类的筛选
蛋白酶的种类显著影响蛋白酶解物的分子量及其活性[2,24]。因此,本实验利用胰蛋白酶、中性蛋白酶、风味蛋白酶、碱性蛋白酶和胃蛋白酶对南极磷虾虾粉进行酶解,并比较5 种EPAH 的自由基清除活性。
图1A 结果表明:在15.0 mg·mL-1的样品浓度下,胰蛋白酶和胃蛋白酶EPAH 的DPPH·清除率分别为44.09%±1.04%和46.7%±2.39%,显著高于中性蛋白酶(35.28%±2.33%)、风味蛋白酶(32.54%±1.86%)、碱性蛋白酶(41.12%±1.2%)EPAH 的DPPH·清除率(P<0.05),且胰蛋白酶和胃蛋白酶EPAH 的DPPH·清除率无显著性差异(P>0.05)。图1B 结果表明:在15 mg·mL-1的样品浓度下,胰蛋白酶和胃蛋白酶EPAH 的HO·清除率分别为35.76%±1.58%和33.03%±1.71%,显著高于中性蛋白酶(29.39%±1.57%)、风味蛋白酶(23.53%±1.35%)、碱性蛋白酶(28.13%±2.36%)EPAH 的HO·清除率(P<0.05),且胰蛋白酶和胃蛋白酶EPAH 的HO·清除率无显著性差异(P>0.05)。
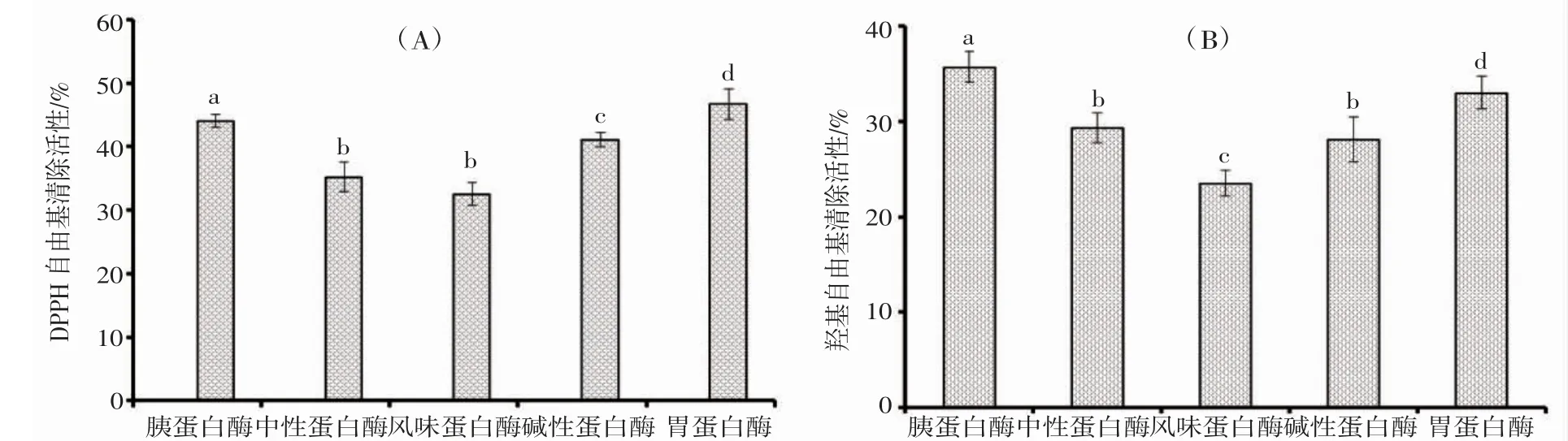
图1 5 种南极磷虾蛋白抗氧化酶解物的DPPH 自由基(A)和羟基自由基(B)清除活性Fig.1 DPPH radical (A) and hydroxide radical (B) scavenging rate of five antioxidant hydrolysates of E.superba protein
图2 结果表明:在15 mg·mL-1的样品浓度下,双酶体系(胰蛋白酶+胃蛋白酶)制备的EPAH 的DPPH·和HO·清除率分别为55.49%±3.05%和48.94%±1.11%,显著高于胰蛋白酶和胃蛋白酶制备的EPAH (P>0.05)。因此,选取双酶体系(胰蛋白酶+胃蛋白酶)制备EPAH。
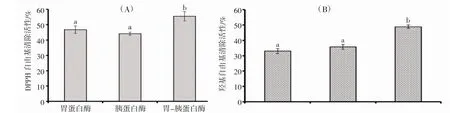
图2 胰蛋白酶、胃蛋白酶和双酶体系(胰蛋白酶+胃蛋白酶)南极磷虾蛋白抗氧化酶解物的DPPH 自由基(A)和羟基自由基(B)清除率Fig.2 DPPH radical (A) and hydroxide radical (B) scavenging rates of antioxidant hydrolysates of E.superba protein using pepsin,trypsin,and double enzyme system (pepsin+trypsin),respectively
2.2 南极磷虾蛋白水解物(EPAH)的氨基酸组成分析
EPAH 氨基酸组成如表2 所示。测定17 种氨基酸,其中包括Val、Met、Ile、Leu、Thr、Phe 和Lys 7 种必需基酸,His 和Arg 2 种半必需氨基酸,Gly、Ala、Pro、Asp、Ser、Cys、Glu 和Tyr 8 种非必需氨基酸,总氨基酸(WTAA)含量为62.72%±0.42%,必需基酸、半必需氨基酸和非必需氨基酸分别占总氨基酸含量的26.17%±0.16%、5.64%±0.03%和30.91%±0.24%。
表2 南极磷虾蛋白水解物的氨基酸组成分析(,n=3)Tab.2 The contents of amino acids in protein hydrolysate of E.superba
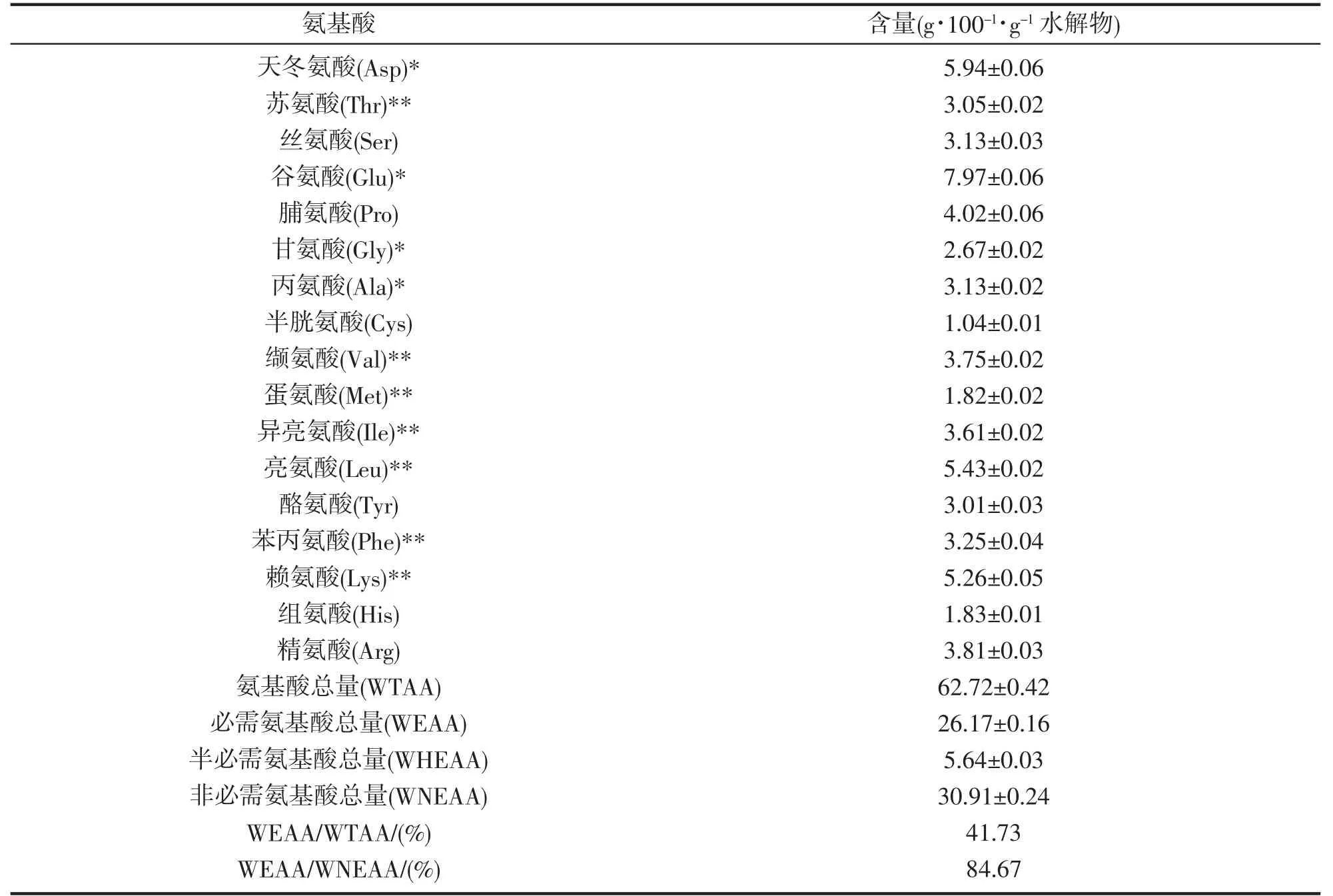
表2 南极磷虾蛋白水解物的氨基酸组成分析(,n=3)Tab.2 The contents of amino acids in protein hydrolysate of E.superba
注:* 鲜味氨基酸;** 必须氨基酸.
南极磷虾蛋白水解物必需氨基酸的AAS、CS和必需氨基酸指数(EAAI)计算结果(表3)显示:AAS 第一限制性氨基酸为缬氨酸(Val),评分为0.75,其次是苏氨酸(Thr),评分为0.76;苯丙氨酸+酪氨酸(Phe+Tyr)评分最高,AAS为1.04,其次为赖氨酸(Lys),AAS 为1.09。在CS中,赖氨酸(Lys)的化学评分最高,为0.75,其次是苏氨酸(Thr),为0.65,最低的是甲硫氨酸+半胱氨酸(Met+Cys),CS为0.50,其次为缬氨酸(Val),CS 为0.57。金枪鱼鱼卵必需氨基酸指数EAAI 值为63.02。必需氨基酸/氨基酸总量(WEAA/WTAA)的值为40.73%,WEAA/WNEAA 的值为84.67%。
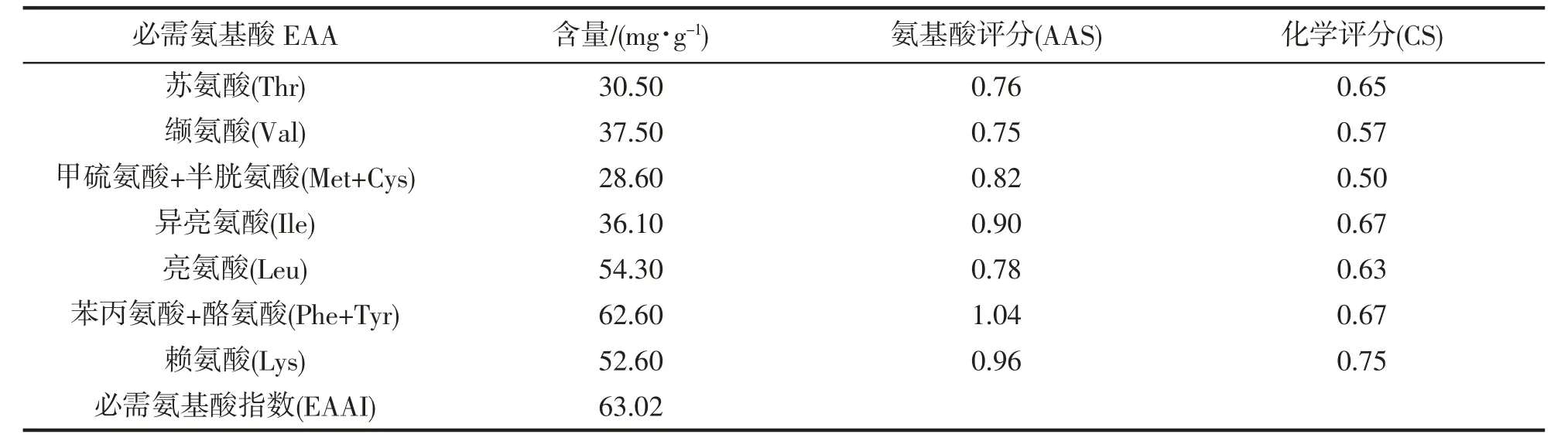
表3 南极磷虾蛋白水解物的氨基酸评分(AAS)和化学评分(CS)Tab.3 Amino acids scores (AAS) and chemical score(CS) in protein hydrolysate of E.superba
2.3 南极磷虾蛋白水解物脂质过氧化抑制活性
抗氧化物结构的不同,对自由基清除的机制和能力有所差异。因此,常采用脂质过氧化抑制实验综合评估蛋白水解物的抗氧化能力[18,24]。以谷胱甘肽(GSH)为阳性对照物,将浓度为15.0 mg·mL-1的EPAH 加入到实验体系中,每天记录500 nm 吸光值。化合物的抗氧化能力越强,其对亚油酸氧化的抑制作用就越大,500 nm 吸光值上升缓慢。
图3 结果表明:空白对照组500 nm 吸光值变化最大,在7 d 时间里迅速上升,表明亚油酸的氧化程度最高;谷胱甘肽(GSH)组500 nm 吸光值变化最小,说明GSH 具有最强的抗氧化能力,很好地抑制了亚油酸的氧化变质;EPAH 组500 nm 吸光值显著低于空白对照组,说明其可以较好地抑制系统中亚油酸的过度氧化。因此,南极磷虾蛋白水解物具有明显的脂质过氧化抑制能力,但活性低于GSH。
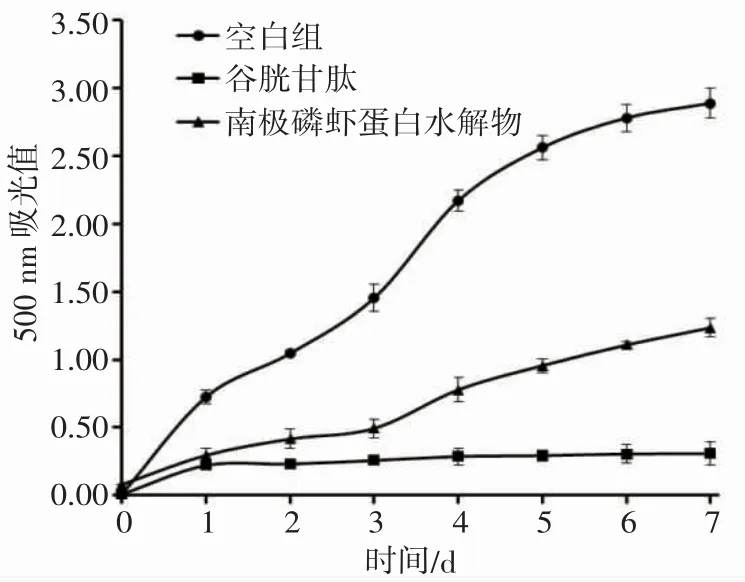
图3 南极磷虾蛋白水解物的抗脂质过氧化能力Fig.3 Lipid peroxidation inhibition assays of protein hydrolysate of E.superba
2.4 南极磷虾蛋白水解物对氧化损伤张氏肝细胞的保护作用
2.4.1 张氏肝细胞氧化损伤模型的建立
以MTT 检测不同浓度H2O2对张氏肝细胞存活率的影响,细胞存活率在50%左右为建模最佳浓度[27]。图4 结果表明:双氧水(H2O2)浓度对张氏肝细胞存活率有显著性的影响(P<0.05),随着双氧水浓度的增加,细胞存活率显著下降,在300 μmol·L-1浓度下,细胞存活率为47.61%±3.92%。因此,选择浓度为300 μmol·L-1的H2O2建立张氏肝细胞氧化损伤模型。
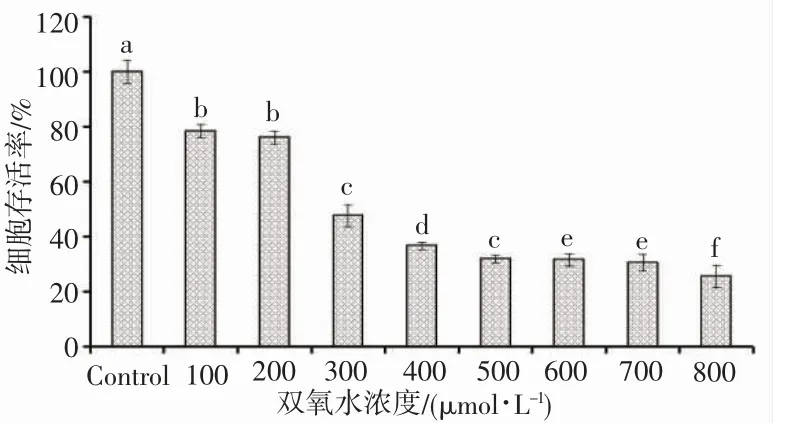
图4 双氧水浓度对张氏肝细胞存活率的影响Fig.4 Effects of H2O2 concentration on viability of Chang liver cells
2.4.2 南极磷虾蛋白水解物对氧化损伤张氏肝细胞细胞存活率的影响
图5A 结果表明:EPAH 作用张氏肝细胞24 h 后,细胞存活率均保持在90%以上,与空白组无显著性差异(P>0.05)。说明EPAH 在0~30 mg·mL-1浓度下对张氏肝细胞的增殖没有显著的抑制作用。图5B 结果表明:在15 mg·mL-1浓度下,EPAH 将张氏肝细胞的存活率提高到57.98%±2.57%,显著高于模型组(47.61%±3.92%) (P<0.01),但其活性略低于阳性对照GSH。因此,EPAH 可以显著降低H2O2对张氏肝细胞的氧化损伤。

图5 南极磷虾蛋白水解物对张氏肝细胞(A)和氧化损伤张氏肝细胞(B)存活率的影响Fig.5 Effects of protein hydrolysate of E.superba on viability of Chang liver cells (A) and H2O2 damaged Chang liver cells (B)
2.4.3 南极磷虾蛋白水解物对氧化损伤张氏肝细胞活性氧(ROS)水平的影响
图6 结果表明:模型组较对照组张氏肝细胞中ROS 水平显著性升高(P<0.001),说明所建氧化损伤模型可用。与模型组相比,15 mg·mL-1浓度的EPAH 可以显著降低H2O2损伤的张氏肝细胞内的ROS 水平(P<0.01),降低H2O2对细胞的氧化损伤。
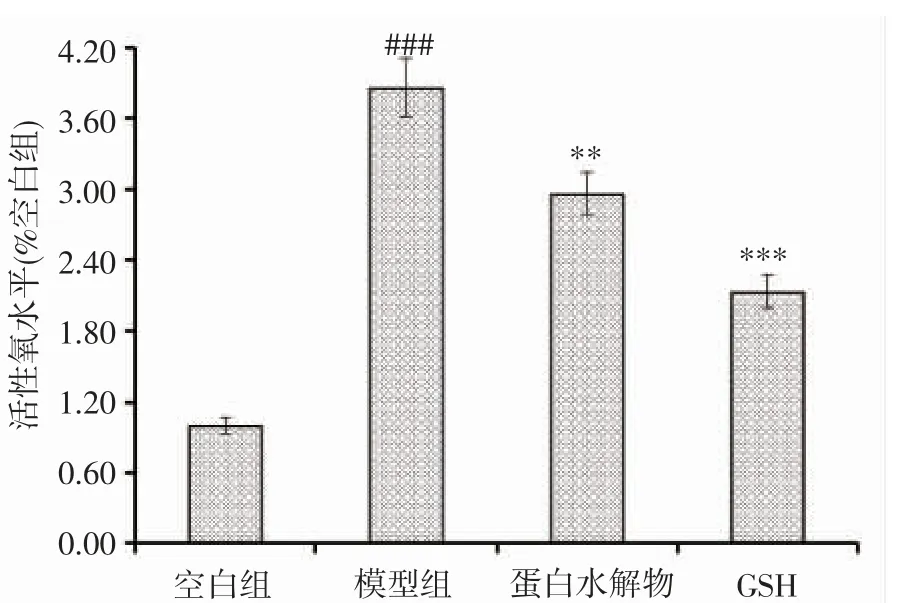
图6 南极磷虾蛋白水解物对氧化损伤张氏肝细胞活性氧水平的影响Fig.6 Effects of protein hydrolysate of E.superba on level of reactive oxygen species of H2O2 damaged Chang liver cells
3 结论
南极磷虾是目前储量最丰富的海洋优质蛋白资源,其高值化开发利用备受关注。本实验以DPPH·和HO·清除率为导向,筛选出双酶体系(胰蛋白酶和胃蛋白酶)制备南极磷虾蛋白抗氧化酶解物。制备的南极磷虾蛋白抗氧化酶解物富含必需基酸和半必需氨基酸,必需氨基酸指数(EAAI)为63.02,具有较高的营养价值。另外,南极磷虾蛋白抗氧化酶解物具有显著的脂质过氧化抑制作用。用南极磷虾蛋白抗氧化酶解物配成一定浓度的溶液,建立细胞氧化损伤模型,测定ROS 水平变化情况,以此为指标来衡量南极磷虾蛋白抗氧化酶解物的抗氧化活性强弱。实验结果表明,15 mg·mL-1的酶解物抗氧化活性较好。本实验为进一步进行南极磷虾蛋白抗氧化酶解物抗氧化活性机制研究提供了一定的参考价值,可通过测定南极磷虾蛋白抗氧化酶解物的氨基酸序列来验证本实验结果。因此,双酶体系(胰蛋白酶+胃蛋白酶)制备的南极磷虾蛋白抗氧化酶解物为抗氧化功能产品的研发提供了一定的方向。

