速生湿地松良种胚性愈伤组织诱导与增殖
徐康 程强强 杨春霞 谷振军 丁伟 李火根
摘要:为使速生湿地松良种快速大规模繁殖,对其胚性愈伤组织进行诱导和增殖优化研究。该文以1代湿地松种子园中10个速生湿地松优良无性系(基因型)的未成熟合子胚为外植体,系统研究基因型、合子胚发育阶段、基本培养基、植物生长调节剂种类和浓度等不同因子对胚性愈伤组织诱导效率的影响,探讨胚性愈伤组织的增殖条件。结果表明:基因型、合子胚发育阶段、基本培养基及植物生长调节剂种类和浓度等均对胚性愈伤组织诱导有不同程度的影响。10个基因型均诱导出了胚性愈伤组织,其中以2号基因型诱导率最高,达到25.37%;合子胚发育阶段中,以处于多胚阶段的球果诱导率最高;四种基本培养基中,以在DCR基本培养基上诱导效果最佳;植物生长调节剂浓度及组合中以2,4D 2.0 mg·L1 + KT 2.5 mg·L1诱导率最高,达到27.78%。湿地松胚性愈伤组织增殖的最佳培养基为在DCR基本培养基上添加0.5 mg·L1 2,4D、1.0 mg·L1 KT、500 mg·L1 CH和300 mg·L1 L谷氨酰胺。综上研究结果,为湿地松良种进一步开展成熟胚诱导及植株再生奠定了基础。
关键词: 湿地松, 未成熟合子胚, 体细胞胚胎发生, 胚性愈伤组织
中图分类号:Q943.1
文献标识码:A
文章编号:10003142(2021)02028309
Abstract:In order to make the rapid and largescale propagation of fastgrowing varieties of Pinus elliottii, the induction and proliferation of embryogenic callus were studied. The immature zygotic embryos (with endosperm) of ten P. elliottii families were used to systematically study the effects of different factors on the induction efficiency of embryogenic callus, including genotype, the developmental stage of zygotic embryos, basic medium, types and concentrations of plant growth regulator (PGR). At the same time, the proliferation conditions of embryogenic callus were discussed. The results were as follows: The genotype, the developmental stage of zygotic embryos, basic medium and types and concentrations of plant growth regulator (PGR) all had different degrees of influence on the induction of embryogenic callus. Embryogenic callus were induced in all ten genotypes, of which the induction rate of Genotype 2 was the highest, reaching 25.37%; In the stage of zygotic embryo development, the induction rate of cones at the multiple embryo stage was the highest; Among the four basic media, the induction effect on DCR basic medium was the best; The induction rate of 2,4D 2.0 mg·L1+KT 2.5 mg·L1 was the highest, reached 27.78%. The proliferation of embryogenic callus for P. elliottii was achieved on DCR medium, supplemented with 2,4D (0.5 mg·L1), KT (1.0 mg·L1), CH (500 mg·L1) and Gln (300 mg·L1). This study laid a foundation for further developing mature embryo induction and plant regeneration of fastgrowing varieties of P. elliottii.
Key words: Pinus elliottii, immature zygotic embryo, somatic embryogenesis, embryonic callus
濕地松(Pinus elliottii)在20世纪30年代引入我国,因其表现出速生、产脂量高及适应性强等优点在我国大规模推广,现已成为我国南方地区主要造林树种之一。速生和高产脂是湿地松良种选育的主要目标,迄今已选育出一批速生高产脂湿地松良种。目前,湿地松良种繁育仍以种子园种子的有性繁殖为主。虽然湿地松速生和高产脂种子园已更新至第二代,但传统的种子繁育存在种子园世代更新慢、育种周期长、后代变异大、育种经费高等问题。为了使选育出的湿地松良种得到快速推广应用,且更好地保持良种的优良特性,无性繁殖技术在良种繁育中显得尤为重要。
植物体细胞胚胎发生(somatic embryogenesis)具有稳定性好、繁殖系数高、同步化水平高等优点(Gupta et al., 1993),已成为植物无性繁殖研究中的热点。胚性愈伤组织诱导是体胚发生的第一步,其诱导成功是否及质量在体胚发生中处于关键地位。湿地松胚性愈伤组织诱导最早由日本学者Jain et al.(1989)开始研究,随后Newton(1995)、Liao et al.(1995)、唐巍等(1997)、吴丽君(2009)、Newton et al.(2011)、张彩云(2016)及胡继文等(2019)相继对湿地松胚性愈伤组织进行了诱导,不同研究中胚性愈伤组织的诱导率存在显著差异,有的研究中胚性愈伤组织诱导率高达49.0%,而有的仅为0.8%,甚至诱导失败。与其他松科松树的树种(如火炬松、马尾松、落叶松等)相比,湿地松胚性愈伤组织诱导率差异不明显,杨模华等(2011)报道马尾松胚性愈伤组织的平均诱导率为9.66%~22.59%,Pullman et al.(2006)通过在火炬松培养基中添加有机酸和维生素等提高了胚性愈伤组织诱导率,平均诱导率在13.2%~42.9%之间,而宋跃等(2016)报道长白落叶松胚性愈伤组织平均诱导率为3.11%~11.17%。
虽然对湿地松胚性愈伤组织诱导与增殖研究较多,但仍存在胚性愈伤组织诱导率低、愈伤组织质量不高、增殖效果不理想等问题(Nunes et al., 2018),且胚性愈伤组织诱导受基因型、合子胚发育程度、培养基种类及植物生长调节剂浓度等因素影响(Stasolla & Yeung, 2003)。因此,对于不同育种目标的湿地松良种很有必要开展胚性愈伤组织诱导与增殖研究。本研究以10个速生湿地松优良无性系未成熟种子为材料,研究了不同基因型、合子胚不同发育时期、不同基本培养基、植物生长调节剂组合及浓度等对胚性愈伤组织诱导的影响,并探索了胚性愈伤组织最佳增殖培养条件,旨在为下一步体胚成熟和萌发研究奠定基础,并为湿地松速生良种进一步快速繁殖利用提供技术支撑。
1材料与方法
1.1 材料
湿地松速生良种的未成熟种子采自江西省吉安市峡江县林木良种场1代无性系种子园,选择10株长势好、结果量多,且后代速生特性明显的无性系作为采种母树,采种时间从6月24号开始至8月11号截止,每周采集一次,共采集8次,每次采集20~30个球果,球果采集后置于4 ℃冰箱中保存备用。
1.2 方法
1.2.1 外植体消毒与接种从冰箱中取出球果,剥出种子,选择饱满、发育良好种子去除种翅。在超净工作台内,先用无菌水冲洗3次,转入75%酒精中浸泡30 s,用无菌水冲洗3次后再转入0.1%升汞中消毒7~8 min,然后用无菌水清洗3~5次,最后用无菌滤纸吸干表面水分,备用。
取出消毒好的湿地松种子于无菌培养皿中,用无菌解剖刀和镊子去除种壳和种皮后置于诱导培养基上,每皿接种10粒,接种后用封口膜封口,置于培养箱中暗培养。
1.2.2 胚性愈伤组织诱导开展不同家系、不同基本培养基、不同取样时间、不同植物生长调节剂组合及浓度(2,4D、6BA和KT)等因素对湿地松胚性愈伤组织诱导影响的研究,诱导培养基中添加L谷氨酰胺300 mg·L1、水解酪蛋白500 mg·L1、蔗糖30 g·L1、卡拉胶7 g·L1;每种处理设置3个重复,(23 ± 1) ℃ 暗培养。接種后定期观测种子变化,并于4~8周后统计愈伤组织和胚性愈伤组织的个数,计算诱导率。
1.2.3 胚性愈伤组织增殖选择生长状态一致的胚性愈伤组织置于不同植物生长调节剂浓度组合的增殖培养基上,DCR为基本培养基,添加麦芽糖30 g·L1、卡拉胶7 g·L1、L谷氨酰胺300 mg·L1、水解酪蛋白500 mg·L1。培养温度(23±1)℃,湿度60%~65%,15 d后观测愈伤组织生长状态。
1.3 数据统计分析
(胚性)愈伤组织诱导率(%) =诱导出(胚性)愈伤组织的未成熟合子胚数/接种的未成熟合子胚数×100,采用SPSS软件对数据进行统计分析,Duncan法进行多重比较。胚性愈伤组织增殖培养时生长状态用“+”表示程度。
2结果与分析
2.1 不同基因型对胚性愈伤组织诱导的影响
湿地松10个速生优良基因型的胚性愈伤组织诱导效果见表1。从表1可以看出,不同基因型诱导胚性愈伤组织存在明显差异,10个基因型中诱导率最高的为2号,达到25.37%,其次是5号和10号,诱导率最低的为17号家系,胚性愈伤组织诱导率仅为1.43%。方差分析结果显示,2号基因型胚性愈伤组织组织的诱导率显著高于其他基因型,而1号基因型的非胚性愈伤组织诱导率显著高于其他基因型,说明不同基因型胚性愈伤组织诱导与非胚性愈伤组织诱导无相关性。
2.2 采集时间(合子胚发育时期)对胚性愈伤组织诱导的影响
从10个湿地松优良家系中挑选诱导效果较好的10号家系开展不同采集时间(6月至8月)对胚性愈伤组织诱导的影响,结果见表2。从表2可以看出,胚性愈伤组织诱导率随采集时间呈现先升后降的变化趋势,7月21号采集的球果胚性愈伤组织和非胚性愈伤组织诱导率均最高,分别达到11.29%和43.55%,其次是7月14号和7月7号,胚性愈伤组织诱导率分别为8.22%和4.55%,而6月24号、7月1号和8月11号则未诱导出胚性愈伤组织。方差分析结果显示,未成熟合子胚的采集时间对胚性愈伤组织和非胚性愈伤组织诱导率有显著影响,7月14号和21号采集球果的胚性愈伤组织诱导率显著高于其他6个时期,尤其是以7月21号为最佳采样时期。
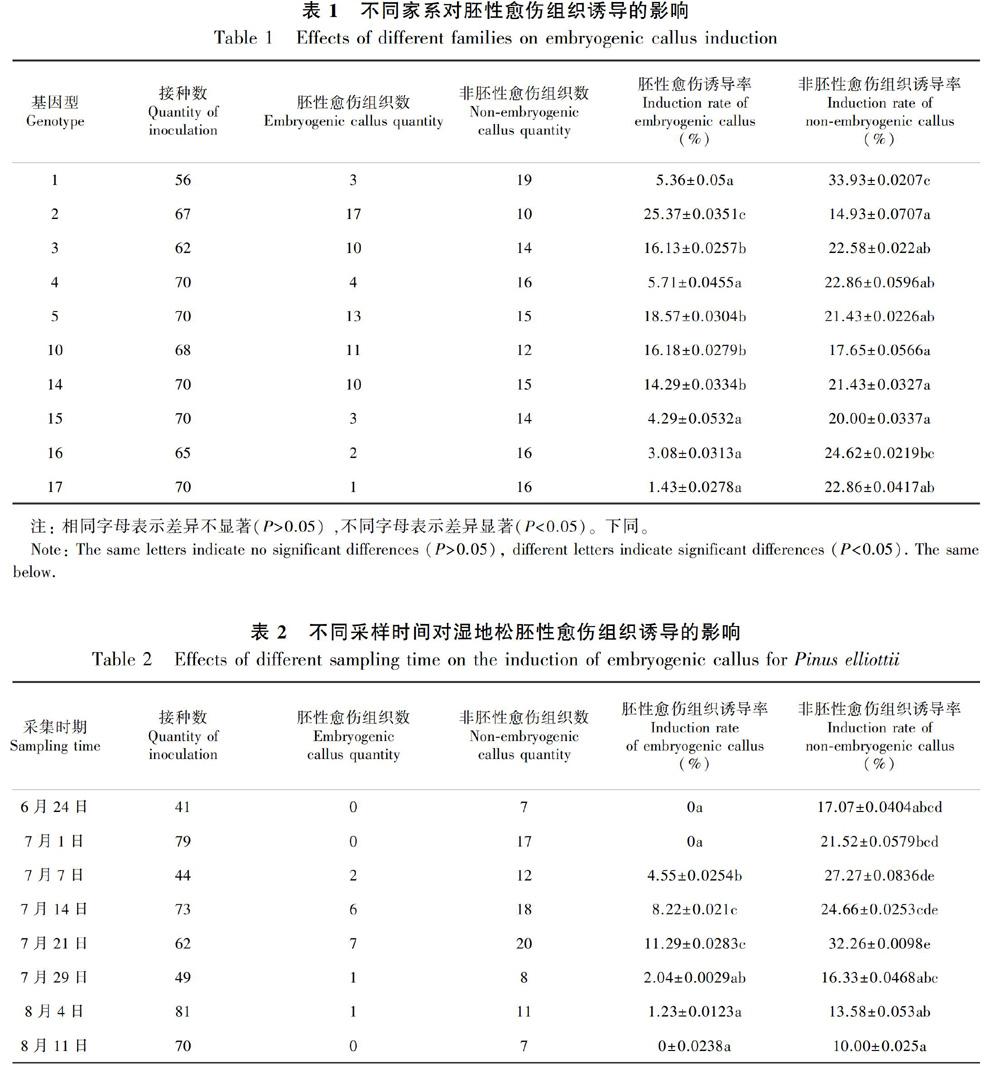
在7月14日和7月21日采集的球果中随机取出3~5个球果,先从球果不同部位取出种子,然后用解剖刀剥去种壳和胚乳,得到合子胚,体视显微镜下观察(图1),发现7月14号种子中约有2/3处于裂生多胚阶段(图1:A,多胚明显,胚体透明),即合子胚发育的第Ⅱ阶段,1/3处于湿地松合子胚发育的第Ⅲ阶段(图1:B,胚头清晰,渐变为白色不透明),而7月21号采集的种子发育时期约有2/3处于湿地松合子胚发育的第Ⅲ阶段,1/3种子处于合子胚发育的第Ⅳ阶段(图1:C,胚头乳白色,不透明,开始发育为圆筒状)。本研究最佳采集时期虽然与其他文献报道有差异,但球果中大多种子合子胚发育阶段处于第Ⅱ阶段至第Ⅳ阶段,与张彩云等(2016)研究结果一致。
2.3 不同基本培养基对胚性愈伤组织诱导的影响
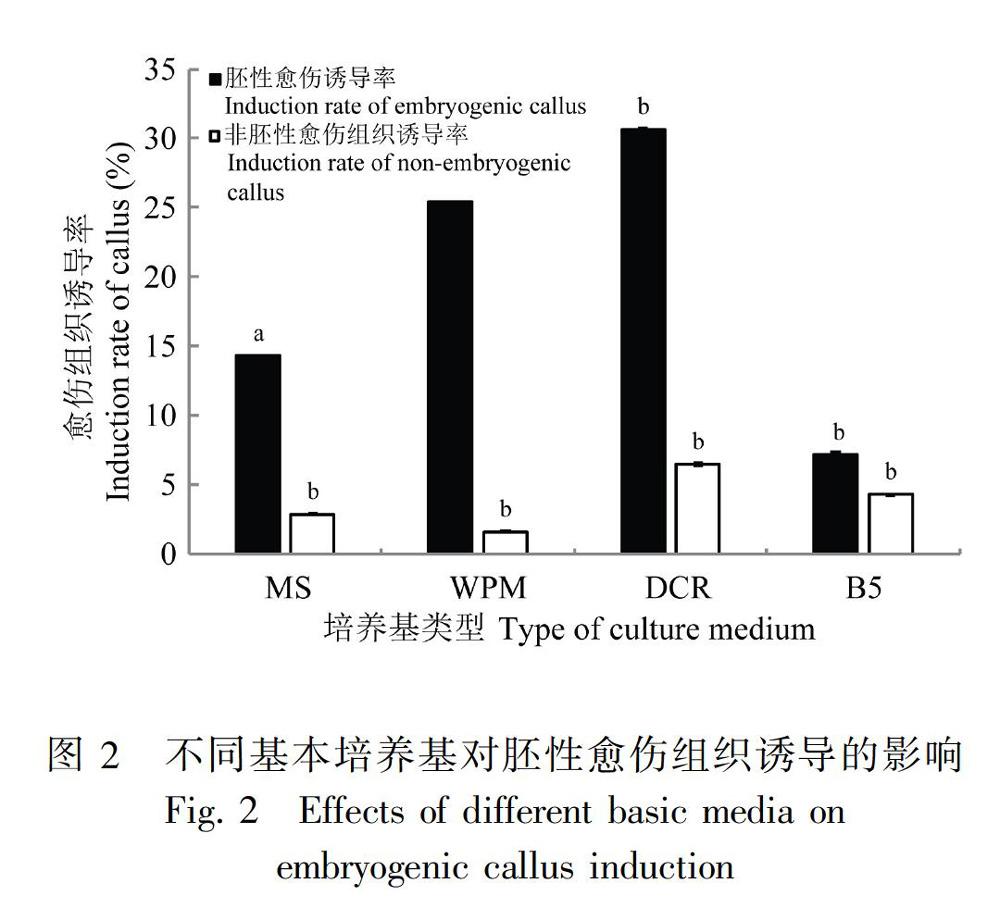
保持植物生长调节剂配比和浓度不变,外植体在MS、 WPM、 DCR和B5四种不同基本培养诱导胚性愈伤组织效果存在一定差异(图2)。其中:DCR和WPM为基本培养基时胚性愈伤组织的诱导率较高,分别为30.65%和25.40%;MS和B5为基本培养基时诱导率较低,分别为14.29%和7.14%,而非胚性愈伤组织在四种基本培养基上的诱导率均低于胚性愈伤组织。方差分析结果表明,在DCR和WPM培养基上胚性愈伤组织诱导率显著高于MS和B5(P<0.05),而非胚性愈伤组织在四种培养基上的诱导率差异不显著,说明DCR和WPM基本培养基更适合湿地松未成熟种子胚性愈伤组织诱导。
2.4 不同植物生长调节剂组合及浓度配比对胚性愈伤组织诱导的影响
2,4D、6BA和KT三种植物生长调节剂及其
A. 合子胚发育第Ⅱ阶段; B. 合子胚发育第Ⅲ阶段; C. 合子胚发育第Ⅳ阶段。
A. The second stage of zygotic embryo development;B. The third stage of zygotic embryo development;C. The fourth stage of zygotic embryo development。
组合对胚性愈伤组织诱导的影响结果见表3。从表3可以看出,不添加任何植物生长调节剂的培养基中,没有诱导出胚性愈伤组织;单一添加植物生长调节剂6BA、 KT和2,4D的培养基中只有2,4D能诱导胚性愈伤形成;当2,4D与6BA、KT组合使用胚性愈伤组织诱导率明显高于各生长调节剂单独使用,2,4D与KT组合使用明显好于与6BA组合使用。方差分析结果显示,不同植物生长调节剂组合之间胚性愈伤组织诱导率存在显著差异,其中2,4D 2.0 mg·L1+ KT 2.5 mg·L1中组合的胚性愈伤组织诱导率显著高于其他植物生长调节剂组合,诱导率达到27.78%。
2.5 胚性愈伤组织的增殖培养
在DCR基本培养并添加 L谷氨酰胺300
A. 湿地松雌配子体;B. 诱导6周后的胚性愈伤组织;C. 胚性愈伤组织增殖;D. 体视显微镜下的胚性愈伤组织(10倍)。
A. Female gametophyte of Pinus elliottii; B. Embryogenic callus after six weeks of induction; C. Embryogenic callus proliferation; D. Embryogenic callus under stereoscopic microscope (10 fold).
Fig. 3Induction and proliferation of embryogenic callus from Pinus elliottiimg·L1、水解酪蛋白500 mg·L1、麦芽糖30 g·L1、卡拉胶7 g·L1条件下,试验了不同植物生长调节剂组合对湿地松胚性愈伤组织增殖的影响,在增殖试验过程中,我们将试验持续进行4次增殖,每隔15 d从上一代中取一团愈伤组织进行增殖,增殖过程中观察愈伤组织的形态、颜色、生长速度、水渍化以及细胞表面突起形态,甚至细胞间粘连情况,结果如表4。从表4结果可以看出,2号植物生长调节剂浓度及配比条件下,胚性愈伤组织增殖效果最佳,愈傷组织增殖快、细胞间有粘性,且愈伤组织表面有突起,说明胚性愈伤组织在增殖过程中很好地保持了胚性(图3)。
3讨论与结论
湿地松胚性愈伤组织诱导与基因型、合子胚发育阶段、基本培养基种类、植物生长调节剂种类及植物生长调节剂浓度等因素关系密切,是诱导成败的关键因子(Pinto et al., 2008)。外植体基因型在胚性愈伤组织诱导中起着关键作用,不同基因型对胚性愈伤组织诱导率的影响存在明显差异。本研究选取的10个速生湿地松优良无性系,胚性愈伤组织诱导率最高的为2号,诱导率达到25.37%,最低的为17号,诱导率仅为1.43%。相同的结果在火炬松(Pullman et al., 2003;Tang,2001)、海岸松(Park et al., 2006)、辐射松(Hargreaves et al., 2009)及地中海松(Montalbán et al., 2012)等中均有报道。因此,对于湿地松不同良种的快速利用,可以通过筛选并利用易诱导胚性愈伤组织的家系(基因型)进行诱导,以获得更多的胚性系,为后期的无性快繁提供技术支持。
合子胚发育阶段是影响胚性愈伤组织起始的关键因子之一,研究发现,在松属树种中处于早期发育阶段的合子胚(未成熟合子胚)更有利于诱导胚性愈伤组织的产生(Montalbán et al., 2012; Alvarez et al., 2013)。本研究中随着雌配子体中合子胚发育,胚性愈伤组织的诱导率呈现先升后降的变化趋势,诱导率最高的2个采样时期(7月14日和7月21日),其球果中大多种子合子胚发育阶段处于第Ⅱ阶段至第Ⅳ阶段,与以往研究结论一致。虽然文中诱导率最高的采样时期与吴丽君(2009)采样时期符合,与张彩云等(2016)采样时期相差较大,但球果中合子胚发育阶段(Ⅱ~Ⅳ)一致,采集球果时间上的差异可能与不同地区气候条件有关,且同一时期采集的不同家系的球果发育时期也存在差异。因此,为了获得较高的胚性愈伤组织诱导率,可以预先检测一下合子胚的发育阶段,根据发育阶段确定最佳采样时期。
培养基组成(基本培养基及植物生长调节剂种类和浓度等)做为影响胚性愈伤组织诱导的另一关键因子,在体胚诱导中举足轻重。在松树体胚发生技术研究中,发现DCR是体胚诱导较佳的基本培养基(胡继文等,2018),这与本研究结论一致,四种基本培养中以DCR培养基上胚性愈伤组织诱导效率最高,达到30.65%。但也有报道称湿地松未成熟种子在DCR培养上诱导胚性愈伤组织效率较低(Nunes et al., 2018),这可能与不同基因型的湿地松对培养条件的需求不一致有关,也可能与合子胚发育阶段等其他影响因素相关。相对于基本培养基而言,植物生长调节剂种类及其浓度对胚性愈伤组织诱导效率影响更大(张建伟等,2014;Nunes et al., 2018)。本研究发现单独使用一种植物生长调节剂效果不理想,2,4D浓度为2.0 mg·L1和KT浓度为2.5 mg·L1时,胚性愈伤组织诱导率最高,达到27.78%。
胚性愈伤组织继代增殖时体胚发生的一个重要环节。研究表明,在培养基中添加适当浓度的植物生长调节剂可以使胚性愈伤组织保持增殖,并保持胚性,但高浓度植物生长调节剂则会使胚性愈伤组织增殖速度降低,甚至导致体细胞胚成熟能力丧失等(宋跃等,2016),故需要调整植物生长调节剂浓度以获得最佳增殖条件。本研究发现降低诱导培养基中植物生长调节剂浓度,其他条件不变,即胚性愈伤组织在含2,4D 0.5 mg·L1 、KT1.0 mg·L1的DCR培养基上增殖效果好,愈伤组织洁白、生长较快、愈伤表面有大量突起、无水渍化现象,细胞间有粘性。Klimaszewska et al.(2007)研究发现降低2,4D浓度获得正常增殖的胚性愈伤组织,这与本研究的结论一致。
综上所述,本研究以湿地松速生良种的未成熟种子为材料,成功诱导出胚性愈伤组织、筛选到易诱导的基因型、明确采样时期、建立胚性愈伤组织诱导与增殖最适培养基,为下一步体胚诱导、成熟及萌发等奠定基础。
参考文献:
ALVAREZ JM, ORDAS R J, 2013. Stable agrobacteriummediated transformation of maritime pine based on kanamycin selection[J]. Sci World J, 2013:1-9.
GUPTA PK, PULLMAN GS, TIMMIS R, et al., 1993. The biotechnology of somatic embrygenesis[J]. Biotechnology, 11(4): 454-459.
HARGREAVES CL, REEVES CB, FIND JI, et al., 2009. Improving initiation genotype capture, and family representation in somatic embryogenesis of Pinus radiata by a combination of zygotic embryo maturity, media, and explant preparation[J]. Can J For Res, 39(8): 1566-1574.
HU JW, GUO WB, DENG LP, et al., 2018. The development and application on pine somatic embryogenesis[J]. For Environ Sci, 34(4):152-160. [胡繼文,郭文冰,邓乐平,等,2018. 松树体细胞胚胎发生技术的发展与应用 [J]. 林业与环境科学,34(4):152-160.]
HU JW, GUO WB,DENG LP, et al., 2019. Somatic embryogenesis and plant regeneration of Pinus massoniana and its hybrids[J]. J S Chin Agric Univ, 40(1):113-121.[胡继文,郭文冰,邓乐平,等,2019. 湿地松及其杂种的体细胞胚胎发生与植株再生 [J]. 华南农业大学学报,40(1):113-121.]
JAIN SM, DONG N,NEWTON RJ, 1989. Somatic embryogenesis in slash pine (Pinus elliottii) from immature embryos cultured in vitro[J]. Plant Sci, 65(2): 233-241.
JAIN SM,GUPTA PK, NEWTON RJ, 1995. Somatic embryogenesis in woody plants[J]. For Sci, 59(4):500.
KLIMASZEWSKA K, TRONTIN JF, BECWAR MR, et al., 2007. Recent progress in somatic embryogenesis of four Pinus spp.[J]. Tree For Sci Biotechnol, 1: 11-25
LIAO YK, AMERSON HV, 1995. Slash pine somatic embryogenesis: Initiation of embryogenesis from immature zygotic embryos[J]. New For, 10(2): 145-163.
MONTALBN IA, DE DIEGO N, MONCALEN P, 2012. Enhancing initiation and proliferation in radiata pine (Pinus radiata D. Don) somaticembryogensis through sees family screening, zygoticembryo staging and media[J]. Acta Physiol Plant, 34(2): 451-460.
NEWTON RJ, MAREKSWIZE KA, MAGALLANESCEDENO ME, et al., 1995, Somatic embryogenesis in slash pine (Pinus elliottii Engelm.) [J]. Som Embry Woody Plants,44-46(5):183-195.
NUNES S, MARUM L, FARINHA N, et al., 2018. Somatic embryogenesis of hybrid Pinus elliottii var. hondurensis and ploidy assessment of somatic plants [J]. Plant Cell Tissue Organ Cult, 132(1):71-84.
PARK YS, LELUWALTER MA, HARVENGT L, et al., 2006. Initiation of somatic embryogenesis in Pinus banksiana, P. strobus, P. pinaster and P. sylvestris at three laboratories in Canada and France[J]. Plant Cell Tissue Organ Cult, 86(1): 87-101.
PINTO G, SILVA S, PARK Y, et al., 2008. Factors influencing somatic embryogenesis induction in Eucalyptus globulus Labill.: Basal medium and antibrowning agents [J]. Plant Cell Tissue Organ Cult, 95(1):79-88.
PULLMAN GS, CHOPRA R, CHASE KM, 2006. Loblolly pine (Pinus taeda L.) somatic embryogenesis: Improvements in embryogenic tissue initiation by supplementation of medium with organic acids, Vitamins B12 and E[J]. Plant Sci (Oxford), 170(3):648-658.
PULLMAN GS, NAMJOSHI K, ZHANG Y, 2003. Somatic embryogenesis in loblolly pine (Pinus taeda L.): Improving culture initiation with abscisic acid and silver nitrate[J]. Plant Cell Rep, 22(2): 85-95.
SALAJ T, KLUBICOVA K, MATUSOVA R, et al., 2019. Somatic embryogenesis in selected conifer trees Pinus nigra Arn. and Abies hybrids[J]. Front Plant Sci, 10:13.
SONG Y, ZHEN C, ZHANG HG, et al., 2016. Embryogenic callus induction and somatic embryogenesis from immature zygotic embryos of Larix olgensis[J]. Sci Silv Sin, 52(10):45-54.[宋躍,甄成,张含国,等,2016. 长白落叶松胚性愈伤组织诱导及体细胞胚胎发生 [J]. 林业科学,52(10):45-54.]
STASOLLA C, YEUNG EC, 2003. Recent advances in conifer somatic embryogenesis: Improving somatic embryo quality[J]. Plant Cell Tissue Organ Cult, 74(1): 15-35.
TANG W, 2001. Somatic embryogenesis and plant regeneration of loblolly pine were improved by suspension culture and medium[J]. For Ecosyst, 3(2): 1-9.
TANG W, OU YP, GUO ZC, 1997. Somatic embryogenesis and plant regeneration[J]. J Plant Resour Environ, 6(2):8-11. [唐巍,欧阳潘,郭仲琛,1997. 湿地松体细胞胚胎发生和植株再生 [J]. 植物资源与环境,6(2):8-11.]
WEI T, FAN O, CHEN GZ, 1997. Plantlet regeneration via somatic embryogenesis in slash pine[J]. J Plant Resour Environ, 6:8-11.
WU LJ, 2009. Development of zygotic embryo and induction of somatic embryo in Pinus massoniana [J]. J Fujian For Coll, 29(3):243-246.[吴丽君,2009. 湿地松合子胚发育与体胚诱导的研究 [J]. 福建林学院学报,29(3):243-246. ]
YANG MH, ZHANG DL, LI ZH, et al., 2011. Somatic embryogenesis with immature embryos of masson pine (Pinus massoniana Lamb.)[J]. Acta Phytophysiol Sin, 47 (9): 904-912.[杨模华,张冬林,李志辉,等,2011. 马尾松幼胚体细胞胚胎发生研究 [J].植物生理学报,47(9):904-912.]
ZHANG JW, WANG JH, LI QF, et al., 2014. Somatic embrogenesis of Picea asperata induced from immature embryos[J]. Sci Silv Sin, 50(4):39-46. [张建伟,王军辉,李青粉,等,2014. 云杉未成熟合子胚诱导体细胞胚胎发生 [J]. 林业科学,50(4):39-46.]
ZHANG ZY, ZHU LH, TAN JJ, et al., 2016. Somatic cell embryogenesis of Pinus massonifera against brown spot of pine needle occurred in plant regeneration[J]. J NE For Univ, 44(6):17-22. [张彩云,朱丽华,谈家金,等,2016. 抗松针褐斑病湿地松体细胞胚胎发生与植株再生 [J]. 东北林业大学学报,44(6):17-22. ]
(责任编辑周翠鸣)

