微正压、流动氩气下碳热还原法制备碳氧化铝的研究
张梦阳,冯月斌**,李金会,郁青春
(1. 昆明理工大学 理学院,云南 昆明 650500;2. 昆明理工大学 冶金与能源工程学院,云南 昆明 650093;3. 昆明理工大学 真空冶金国家工程实验室,云南 昆明 650093)
耐火材料是指在高温条件下能够保持其性能的材料,由于允许运用在高温环境中的特性,被广泛应用于化工、石油、机械、冶金、陶瓷、建工等各个行业[1]. 研究表明,碳氧化铝具有很强的高温稳定性,在1 900 ℃左右的温度下才能分解[2],同时碳氧化铝还表现出很强的抗水化和抗氧化性、抗热冲击、耐腐蚀、密度低等[3-4]一系列的优异特性,因此使其在耐火材料领域具有潜在的应用前景. 此外,碳氧化铝也常常被研究应用于复合材料中,作为增强相提高材料的稳定性、耐高温等物理性能[5].
在Al-O-C三元体系中,已知的碳氧化铝有2种类型:Al4O4C和Al2OC[6]. 目前,这2种碳氧化铝的制备仍处于实验室研究阶段,市面上未见商品化的碳氧化铝. 在现有的报道中,碳热还原法是制备碳氧化铝的主要方法,而反应温度、保温时间[3,7]、原料配比[4,8-9]和原料粒度[10]等条件是制备碳氧化铝的主要影响因素. Yu等[3]研究了氩气下1 700 ℃、2 h,以Al2O3、炭黑和铝粉为原料制备碳氧化铝,当Al粉过量20%时,制备出单相Al4O4C. 赵建立等[7]研究了氩气气氛下1 700 ℃、9 h,Al2O3和石墨的反应,制备出含少量杂相的Al4O4C. 刘杰等[4]以氧化铝、乙炔炭黑和纳米Al粉为原料,以微波加热在1 500 ℃得到了Al2O3、Al4C3和Al2OC的混 合 物. Zhang等[8]研究了氩气下,n(α-Al2O3) ∶n(Al) ∶n(C) = 4 ∶ 4 ∶ 3的反应,大约1 400 ℃、3 h生成了含Al2OC的混合物. 赤峰经一郎等[9]将碳质原料与氧化铝质原料在电弧炉内熔融,得到了一种以Al4O4C和刚玉为主的混合物. 张忻等[10]在1 500 ℃真空条件下,将Al2O3粉、Al粉和石墨进行球磨,得到了含微量C的Al2O3和Al4O4C的混合物. 以上这些研究虽已成功制备了以Al4O4C为主或含Al2OC的材料,但难以合成纯相,且反应时间长,合成温度高,在一定程度上限制了碳氧化铝材料的应用. 因此,探究碳热还原过程中影响碳氧化铝制备的其他条件是至关重要的.
在氧化铝-碳体系中,碳氧化铝的形成可能分为2步[11]:首先氧化铝与碳反应生成低价含铝气体和CO,然后气体产物二次反应形成碳氧化铝,气体分压是碳氧化铝制备中的重要条件. 维持反应性气体较高的分压,有利于碳氧化铝的形成,同时及时排除过量的未反应气体CO,有利于氧化铝与碳的反应,因此微正压、流动惰性气氛可能有利于碳热还原法制备碳氧化铝. 前期研究发现,在氧化铝碳热还原体系中添加铝可以降低反应所需要的温度,且有研究者[3]以氧化铝、碳和铝为原料制备出单相Al4O4C,因此铝的加入可能有利于碳热还原法制备碳氧化铝.
本文在微正压、流动氩气下,研究碳热还原法制备碳氧化铝,并研究铝的加入对制备条件和产物的影响,以期在相对较低的合成温度和较短的反应时间下得到较高纯度的碳氧化铝.
1 实验部分
1.1 实验原料及设备实验中α-氧化铝粉为分析纯(上海阿拉丁生化科技股份有限公司),铝粉为分析纯(天津市风船化学试剂科技有限公司),石墨粉为化学纯(天津市风船化学试剂科技有限公司).
碳管炉(上海辰荣电炉有限公司),最高温度:1 800 ℃,极限真空度:1.33×10-3Pa,功率:10 kW.
本文中,用X射线衍射仪(XRD,D/max 2200)分析物相的组成.
1.2 实验方法将原料按一定比例配比,混合均匀后,在0.4 MPa的压力下压片,压成直径为0.5 cm的圆柱体料块,放入石墨坩埚中,盖上石墨盖,放入碳管炉内. 用真空泵抽真空到压力至0.01Pa,充入氩气至炉内压力呈微正压+15 kPa,保持氩气流速为0.1L/min. 在合成温度分别为1 300 ℃、1 400 ℃、1 500 ℃,保温时间分别为30min、60min、90min的条件下进行反应。待试样冷却后取出,处理产物.按照生成Al4O4C和Al2OC的总反应方程式(1)~(4),分别配制反应原料,如表1所示.

表1 原料配比Tab. 1 Raw material ratios

2 结果与讨论
2.1 原料按生成Al4O4C配比时产物的物相分析图1为n(α-Al2O3) ∶n(C) = 1 ∶ 1.5,保温时间30 min,不同合成温度下产物的XRD衍射图. 从图1可见,1 300 ℃时,未见Al4O4C衍射峰,1 400 ℃观察到Al4O4C衍射峰,表明1 400 ℃时Al4O4C已经开始生成. 比较1 400 ℃和1 500 ℃时产物的XRD衍射图,合成温度升高至1 500 ℃时,Al4O4C含量反而降低. 推测Al4O4C在高温下可能分解成气态产物[12],流动氩气降低了碳热还原过程中气体产物的分压,促进了Al4O4C的分解.
图2为n(α-Al2O3) ∶n(Al) ∶n(C) = 4 ∶ 4 ∶ 3,保温时间30 min,不同合成温度下产物的XRD衍射图. 从图2可见,1 300 ℃时,即可观察到很强的Al4O4C衍射峰,Al的添加明显降低了Al4O4C的形成温度. 这是因为Al2O3与Al在1 200 ℃即可反应生成含铝气体Al2O(g)[13],促使Al4O4C在较低温度下大量生成,从而降低了Al4O4C的形成温度.1 400 ℃时,Al的衍射峰消失,Al2O3的衍射峰减弱,Al4O4C的衍射峰增强. 1 500 ℃时,Al2O3的峰已经很弱,以Al4O4C为主要相. 但该实验条件下均出现了Al4C3相,Al4C3易吸水使材料崩解,不适合用于耐火材料中.
图3为n(α-Al2O3) ∶n(Al) ∶n(C) = 4 ∶ 4 ∶ 3,合成温度1 500 ℃,不同保温时间下产物的XRD衍射图. 从图3可见,1 500 ℃、60 min时,Al2O3特征峰消失,XRD无法检出Al2O3,表明Al2O3几乎完全反应,但含少量的Al4C3,低于文献中报道的合成温度和保温时间[3,7]. 以氧化铝和石墨为原料时,在1 700 ℃下加热8 h仍存在少量Al2O3[14],进一步表明铝的添加可以显著降低Al4O4C的合成温度. 本论文采用的微正压条件是有利于Al4O4C合成的另一个重要因素. 根据前期研究结论[11],在氧化铝的碳热还原过程中,首先生成气态产物Al2O(g)、Al(g)和CO(g),在温度降低时,气态产物与CO进一步反应生成Al4O4C,而微正压条件能够维持反应性气体较高的分压,流动氩气能及时排出未反应的气体成分,促进了Al4O4C的生成. 90 min时,Al4C3衍射峰消失,出现了Al2O3衍射峰,少量Al2O3的存在不影响Al4O4C在耐火材料中的应用.
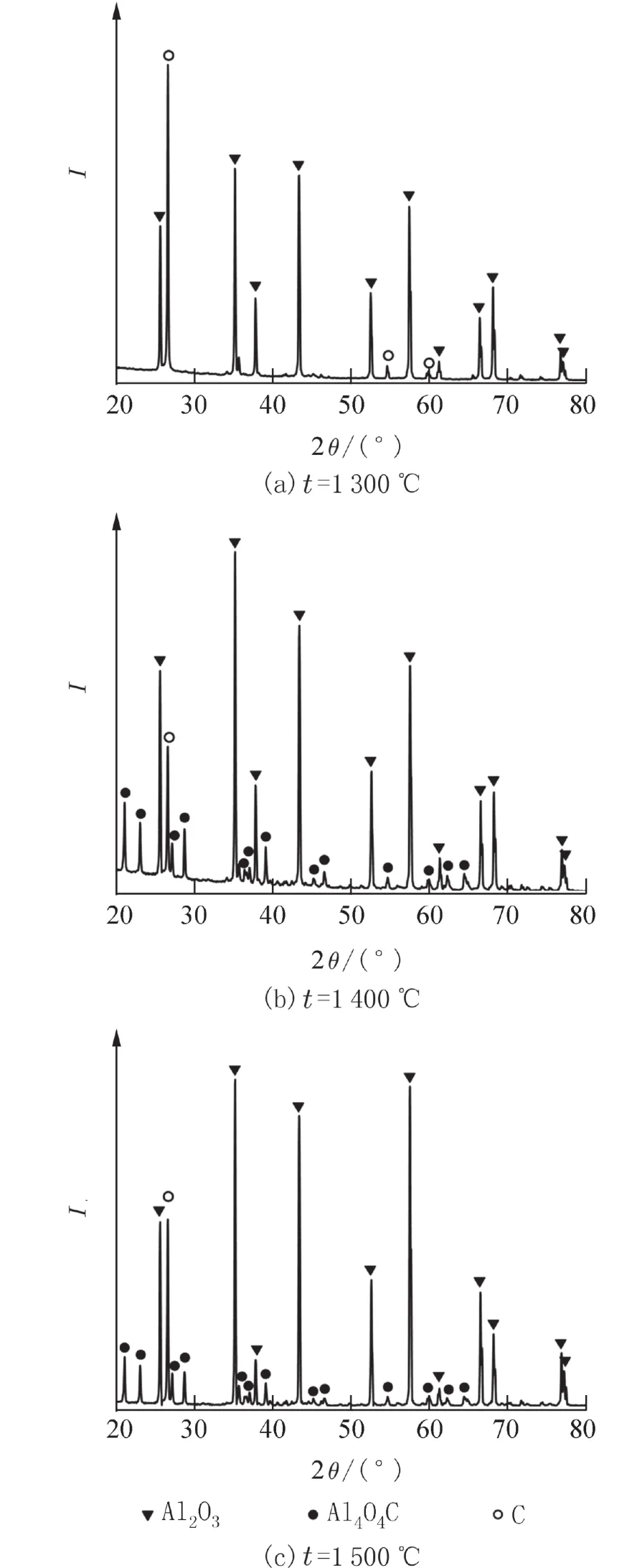
图1 不同合成温度下产物的XRD衍射图[n(α-Al2O3) ∶n(C) = 1 ∶ 1.5]Fig. 1 XRD patterns of the product at different reaction temperatures [n(α-Al2O3) ∶ n(C) = 1 ∶ 1.5]
图4为n(α-Al2O3) ∶n(Al) ∶n(C) = 4 ∶ 4.9 ∶ 3,Al过量20%,保温时间30 min,不同合成温度下产物的XRD衍射图. 比较图4和图2,当Al粉过量20%时,1 300 ℃和1 400 ℃增加了铝相,产物均以Al4O4C为主要相,各物相的变化规律与生成Al4O4C理论配比的规律类似. 表明Al过量对促进反应没有明显影响,反而可能在产物中引入铝杂相.

图2 不同合成温度下产物的XRD衍射图[n(α-Al2O3) ∶n(Al) ∶ n(C) = 4 ∶ 4 ∶ 3]Fig. 2 XRD patterns of the product at different reaction temperatures [n(α-Al2O3) ∶ n(Al) ∶ n(C) = 4 ∶ 4 ∶ 3]
综上,以α-氧化铝和石墨为原料,1 400 ℃开始生成Al4O4C;添加Al粉后,1 300 ℃开始生成Al4O4C. 以α-氧化铝、铝和石墨为原料时,随着合成温度升高和保温时间延长,产物以Al4O4C为主,含有少量Al4C3;n(α-Al2O3) ∶n(Al) ∶n(C) = 4 ∶ 4 ∶ 3,1 500 ℃、90 min时,得到制备Al4O4C的最佳条件,产物以Al4O4C为主,含有少量Al2O3,可用于耐火材料中.

图3 不同保温时间下产物的XRD衍射图[n(α-Al2O3) ∶n(Al) ∶ n(C) = 4 ∶ 4 ∶ 3]Fig. 3 XRD patterns of the product at different holding times[n(α-Al2O3) ∶ n(Al) ∶ n(C) = 4 ∶ 4 ∶ 3]
2.2 原料按生成Al2OC配比时产物的物相分析图5为n(α-Al2O3) ∶n(C) = 1 ∶ 3,保温时间30 min,不同合成温度下产物的XRD衍射图. 从图5可见,随合成温度的升高,1 300~1 500 ℃,Al4O4C峰增强,Al2O3峰减弱,未出现Al2OC衍射峰. 产物的物相组成与n(α-Al2O3) ∶n(C) = 1 ∶ 1.5配比时形成的产物类似(见图1). 表明本研究条件下,Al2O3和C反应的主要产物均为Al4O4C,碳氧化铝的种类与Al2O3和C的配比无关.
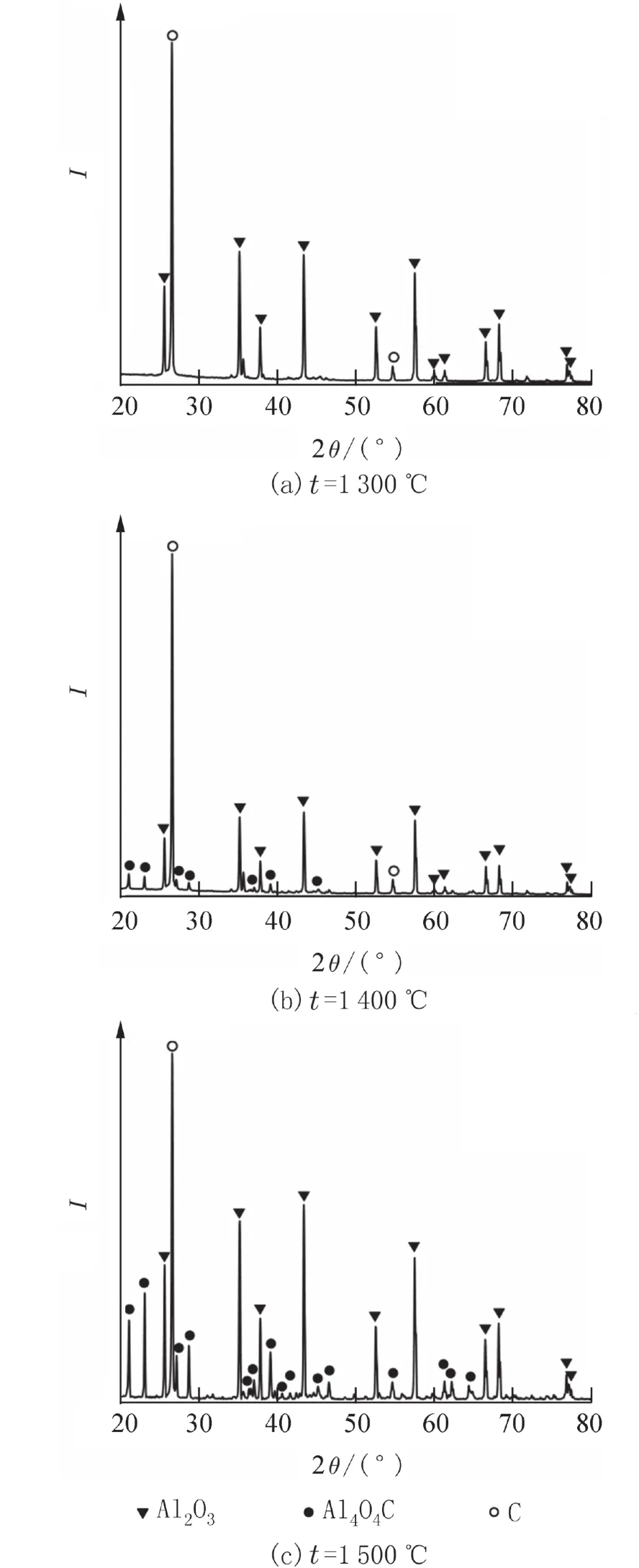
图5 不同合成温度下产物的XRD衍射图[n(α-Al2O3) ∶n(C) = 1 ∶ 3]Fig. 5 XRD patterns of the product at different reaction temperatures [n(α-Al2O3) ∶ n(C) = 1 ∶ 3]
图6为n(α-Al2O3) ∶n(Al) ∶n(C) = 1 ∶ 4 ∶ 3,保温时间30 min,不同合成温度下产物的XRD衍射图. 从图6可见,1 400 ℃、30 min时,Al2O3几乎反应完全,但Al4C3峰较强. 随着合成温度的升高,Al4C3含量显著增加,未见Al2OC,再次表明碳氧化铝类型的制备与原料配比无关. 结合图5中的结论,2种配比均未生成Al2OC,表明产物并未按原料的理论配比反应,碳氧化铝的生成可能不是直接的固-固相反应,而是形成了气态产物,进而生成Al4O4C. 与n(α-Al2O3) ∶n(Al) ∶n(C) = 4 ∶ 4 ∶ 3配比时比较(见图2),原料中Al2O3配比降低、Al配比升高,导致Al2O3反应完全所需温度更低,时间更短,但有大量Al4C3形成.

图6 不同合成温度下产物的XRD衍射图[n(α-Al2O3) ∶n(Al) ∶ n(C) = 1 ∶ 4 ∶ 3]Fig. 6 XRD patterns of the product at different reaction temperatures [n(α-Al2O3) ∶ n(Al) ∶ n(C) = 1 ∶ 4 ∶ 3]
图7为n(α-Al2O3) ∶n(Al) ∶n(C) = 1 ∶ 4 ∶ 3,合成温度1 500 ℃,不同保温时间下产物的XRD衍射图. 从图7可见,延长保温时间至60 min,Al4O4C消失,以Al4C3为主要相,含少量Al,未观察到Al2OC.
图8为n(α-Al2O3) ∶n(Al) ∶n(C) = 1 ∶ 4.8 ∶ 3,Al过量20%,合成温度1 500 ℃,不同保温时间下产物的XRD衍射图. 从图8可见,产物以大量Al4C3为主,无Al4O4C和Al2OC生成. 原料中Al的配比提高到一定程度,可能抑制了Al4O4C的形成. 产物中未生成Al4O4C,而生成了大量Al4C3,推测Al4O4C在高温下分解出大量Al2O(g)、Al(g)[12],石墨坩埚提供了充足的碳源,含铝气体与C迅速反应形成Al4C3,使Al4O4C向Al4C3转化;对比图7和图8,产物中均含Al相,过量的Al与C也生成了Al4C3,使得产物以Al4C3为主.
本研究条件下未见Al2OC生成,随着合成温度升高和保温时间延长,Al4C3含量增加;n(α-Al2O3) ∶n(Al) ∶n(C) = 1 ∶ 4 ∶ 3,1 500 ℃、60 min时,产物以Al4C3为主要相,同时含少量Al. Al粉过量时,产物中存在大量Al4C3,未见碳氧化铝.
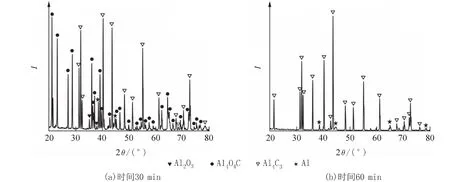
图7 不同保温时间下产物的XRD衍射图[n (α-Al2O3) ∶ n(Al) ∶ n(C) = 1 ∶ 4 ∶ 3]Fig. 7 XRD patterns of the product at different holding times [n(α-Al2O3) ∶ n(Al) ∶ n(C) = 1 ∶ 4 ∶ 3]
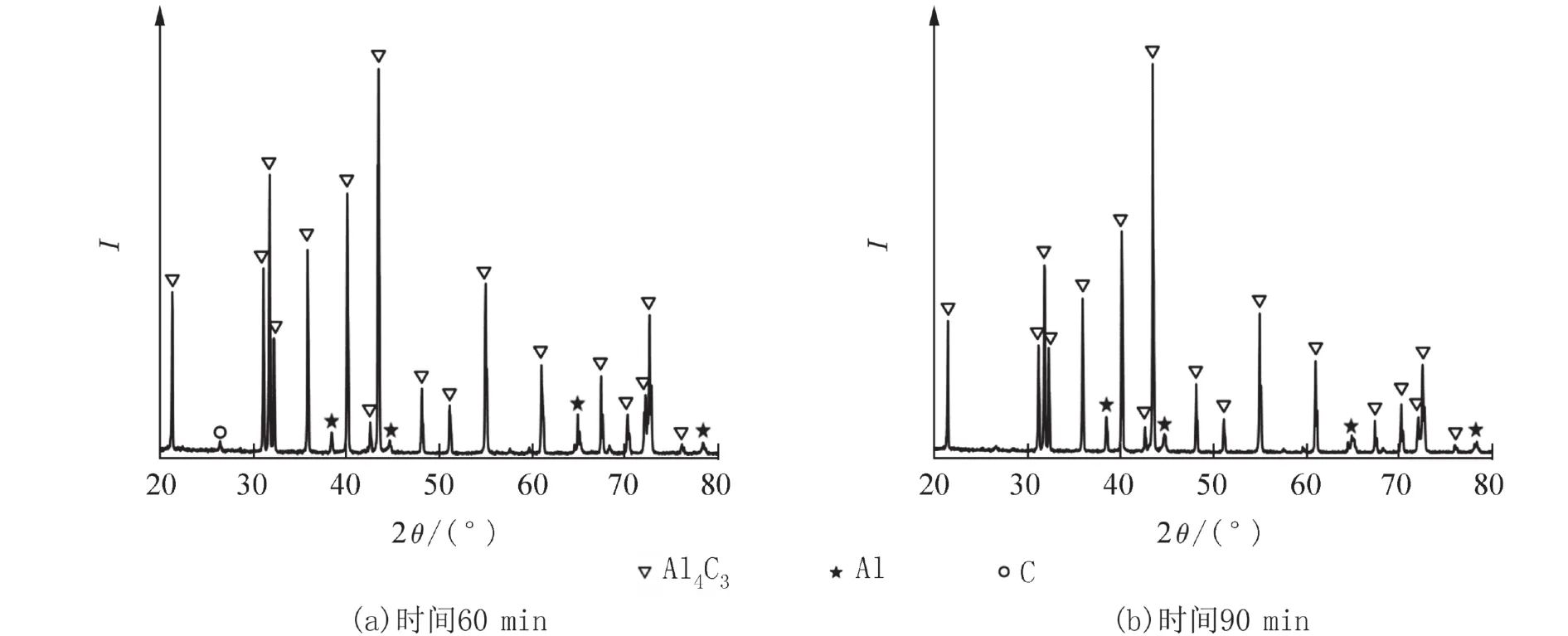
图8 不同保温时间下产物的XRD衍射图[n (α-Al2O3) ∶ n(Al) ∶ n(C) = 1 ∶ 4.8 ∶ 3]Fig. 8 XRD patterns of the product at different reaction temperatures [n(α-Al2O3) ∶ n(Al) ∶ n(C) = 1 ∶ 4.8 ∶ 3]
3 结论
(1)微正压+15 kPa、0.1 L/min流动氩气下,在氧化铝碳热还原体系中加入铝粉,Al4O4C的形成温度明显降低,Al2O3反应完全的时间明显缩短.当n(α-Al2O3) ∶n(Al) ∶n(C) = 4 ∶ 4 ∶ 3时,1 500 ℃、60 min,Al2O3反应完全,但存在少量的Al4C3;1 500 ℃、90 min时,Al4C3消失,但存在少量Al2O3,适用于耐火材料中.
(2)在微正压+15 kPa、0.1 L/min流动氩气下,不论是生成Al4O4C配比n(α-Al2O3)∶n(C) = 1∶1.5,n(α-Al2O3)∶n(Al)∶n(C) = 4∶4∶3、4∶4.9∶3,还 是 生 成Al2OC配 比n(α-Al2O3)∶n(C) = 1∶3,n(α-Al2O3)∶n(Al)∶n(C) = 1∶4∶3、1∶4.8∶3,1 300~1 500 ℃形成的碳氧化铝均为Al4O4C,未见Al2OC. 本论文研究条件下,碳氧化铝种类与原料配比无关.
(3)原料中Al2O3配比低、Al配比高时,有利于Al2O3反应完全,但产物中Al4C3含量升高. 当n(α-Al2O3) ∶n(Al) ∶n(C) = 1 ∶ 4 ∶ 3时,随合成温度升高和保温时间的延长,Al2O3完全反应所需温度降低,时间缩短,Al4C3含量显著升高,1 500 ℃、60 min时,产物以Al4C3为主要相. 当n(α-Al2O3) ∶n(Al) ∶n(C) = 1 ∶ 4.8 ∶ 3时,产物中已无Al4O4C.
本研究未得到单相Al4O4C,且未见Al2OC生成. 后续需进一步研究Al4O4C的形成路径,以确定杂质相的来源和设计杂质相的去除方法;需进一步研究Al2OC的形成条件和形成路径,以达到选择性制备碳氧化铝的目的.

