食管癌浸润深度相关危险因素分析
丁丹丹,周英发,黄琳凯
(郑州大学第二附属医院消化内科,河南 郑州 450014)
在全球范围内,食管癌的发病率和死亡率分别位居全部恶性肿瘤的第七位和第六位,我国是食管癌的高发地区之一[1]。食管癌分为食管鳞状细胞癌(简称食管鳞癌)和食管腺癌,在我国食管癌病理类型以鳞癌为主,占比超过90%[2]。本研究中如无特殊指出均指食管鳞癌。然而早期食管癌症状隐匿,90%以上的首诊都已是中晚期,治疗费用高,患者预后差,早发现、早诊断是其根治性治疗的关键[3]。早期食管癌浸润深度不超过黏膜下层浅层(superficial submucosa,SM1)时可行内镜下手术治疗,而超过SM1则因其淋巴结转移风险高,建议采用进展期食管癌的处理方式,因此准确判断食管癌浸润深度是选择治疗方法的重中之重[4]。全身炎症性指标如血小板淋巴细胞比值(platelet to lymphocyte ratio,PLR)、中性粒细胞淋巴细胞比值(neutrophil to lymphocyte ratio,NLR)、淋巴细胞单核细胞比值(lymphocyte to monocyte ratio,LMR)与食管癌病理特征如T分级、M分级具有相关性[5]。术前白光内镜下肿瘤长度与食管癌预后及肿瘤浸润深度的相关性被广泛研究[6]。本文通过对纳入研究的174例患者的性别、年龄、肿瘤部位、肿瘤长度、术前PLR、NLR、LMR及术后病理诊断结果进行回顾性分析,旨在探讨影响食管癌浸润深度的危险因素,为食管癌浸润深度提供更加准确的判断方法。
1 资料与方法
1.1一般资料:回顾性分析2014年6月至2020年6月于郑州大学第二附属医院行胃镜+病理检查确诊为食管癌,并行手术治疗的174例患者。记录每位患者年龄、性别、白光内镜下肿瘤长度、部位及术后病理诊断结果;每位患者术前均行血常规检查,计算PLR、LMR及NLR。排除标准:①术前诊断食管癌远处转移;②术前出现大出血、感染、合并风湿免疫系统疾病等影响血常规结果的情况;③合并其他器官癌症患者。
1.2方 法
1.2.1术后病理浸润深度判断:术后病理标本由病理科进行处理及诊断。浸润层次分为:黏膜上皮层(epithelium M1)、黏膜固有层(lamina propria mucosae M2)、黏膜肌层(muscularis mucosae M3)、黏膜下层浅层(superficial submucosa,SM1)、黏膜下层深层(deep layer of submucosa,SM2-SM3)(SM1指病变浸润黏膜下层上1/3,SM2指病变浸润黏膜下层中1/3,SM3指病变浸润黏膜下层下1/3。)固有肌层(muscularis propria MP)、浆膜层(adventitia AD),对于内镜下切除的食管鳞癌标本,以200μm作为区分黏膜下浅层和深层浸润的临界值[7]。见图1。

图1 食管癌术后病理标本a:食管癌浸润至粘膜下层浅层(HE X10) b:食管癌浸润至粘膜下层深层,白色箭头所指为癌细胞团 (HE X10)
1.2.2统计学方法:应用SPSS25.0软件进行统计学分析。应用logistic回归分析各变量与浸润深度之间的相关性;根据logistic回归和受试者工作特征曲线(Receiver operating characteristic curve,ROC曲线)计算最佳截距值及曲线下面积(area under curve,AUC)、敏感度、特异性等诊断指标;检验水准α=0.05,以P<0.05为差异有统计学意义。
2 结 果
2.1患者特征:共有174名患者入选(102名男性和72名女性),中位年龄为64岁(41~83岁)。临床病理特征见表1。
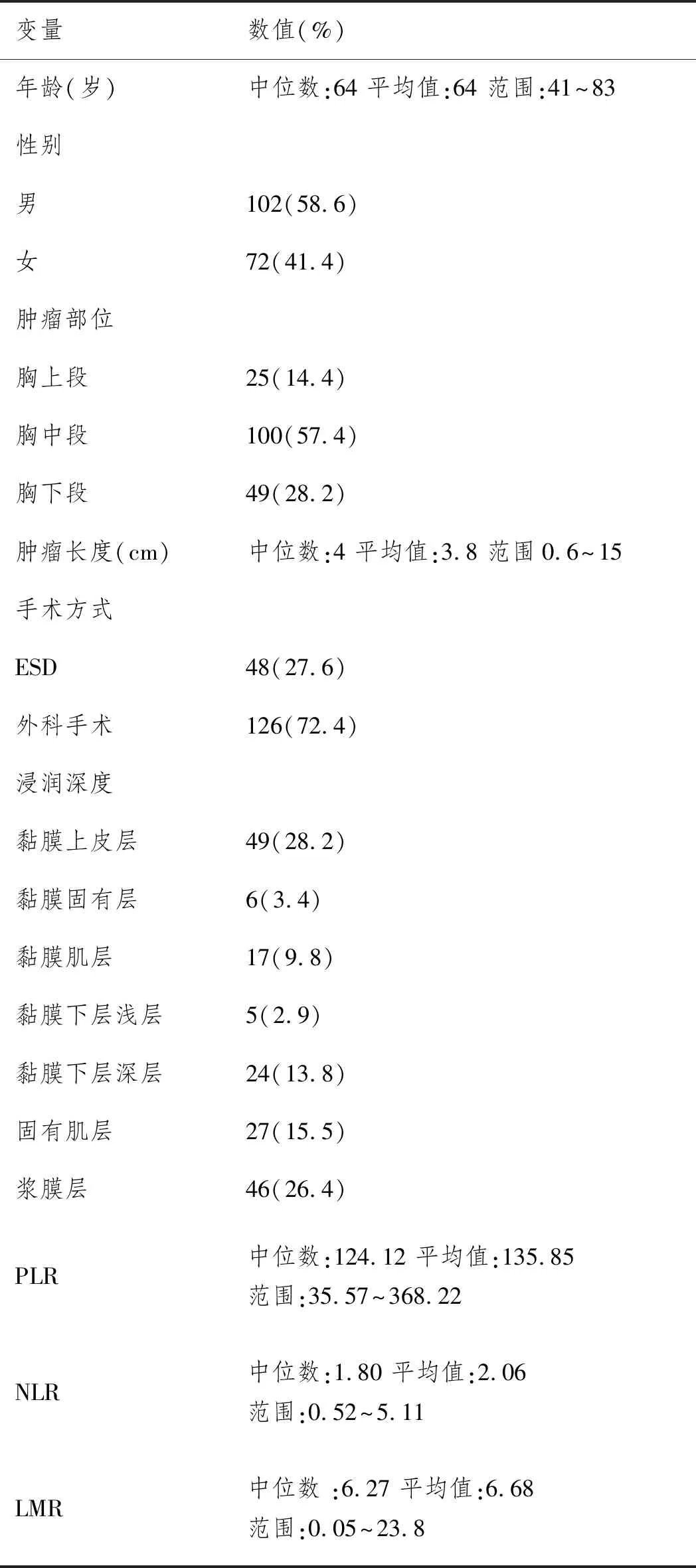
表1 174名食管癌患者的一般特征
2.2各变量与浸润深度的相关性:高PLR与食管癌浸润深度相关,PLR每增加一个单位,食管癌浸润深度超过SM1的概率增加1.017倍:(>SM1 vs ≤SM1:OR=1.017,95%CI=1.006~1.028,P=0.002)。肿瘤长度与食管癌浸润深度相关,肿瘤长度每增加一个单位,肿瘤浸润深度超过SM1的概率增加1.581倍:(>SM1 vs ≤SM1:OR=1.581,95%CI=1.234~2.024,P<0.001)。NLR(P=0.443)、LMR(P=0.323)、肿瘤部位(P=0.065)、年龄(P=0.418)、性别(P=0.621)与肿瘤浸润深度不相关。见表2。
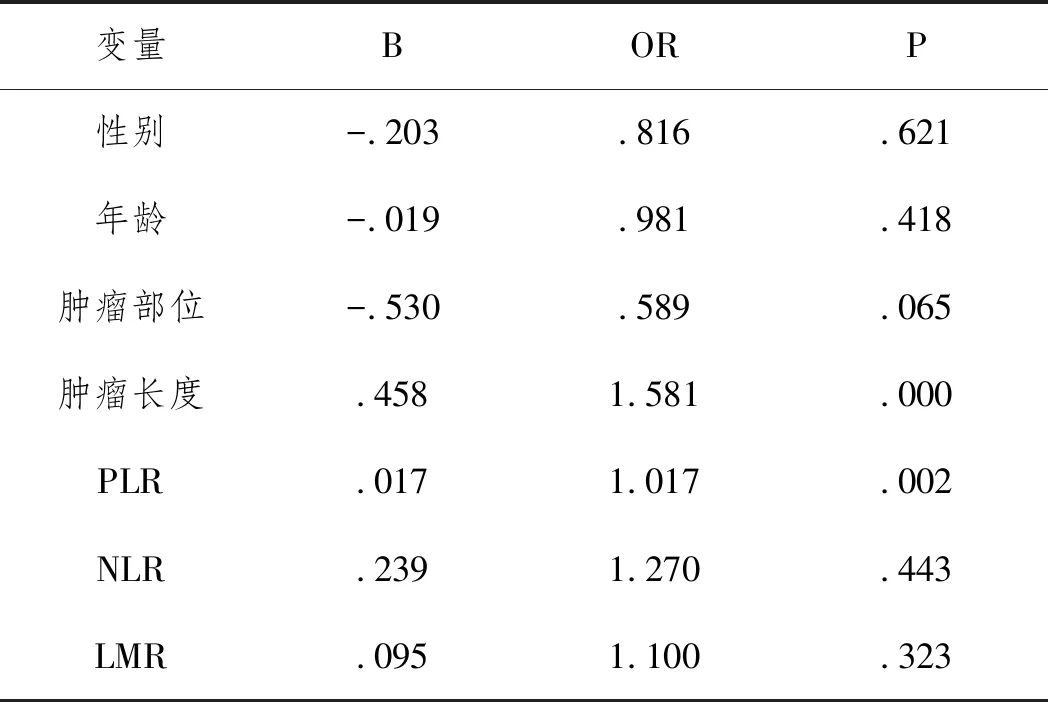
表2 各变量与食管癌浸润深度的相关性
2.3PLR和肿瘤大小对食管癌浸润深度的判断:依据ROC曲线计算得PLR最佳截距值为145.47,AUC为0.74,95%CI:0.667~0.813,P<0.001;对浸润深度>SM1的敏感度为0.495,特异性为0.883。肿瘤大小最佳截距值为3.1cm,AUC为0.796,95%CI:0.698~0.841,P<0.001;对浸润深度>SM1的敏感度为0.722,特异性为0.714。两者联合诊断,AUC为0.812,95%CI:0.747~0.876,P<0.001;对浸润深度>SM1的敏感度为0.866,特异性为0.61。见图2。PLR和肿瘤长度在判断食管癌浸润深度中都具有较好的准确性,两者联合诊断,对浸润深度>SM1的敏感度高达0.866,诊断准确性优于单独检测。见表3。

图2 PLR、肿瘤长度及两者联合诊断食管癌浸润深度ROC曲线

表3 PLR肿瘤长度及两者联合的AUC敏感度特异性比较
3 讨 论
在1987年以前,美国癌症联合委员会(AJCC) TNM分期系统将食管肿瘤长度≤5cm划分为T1,>5cm划分为T2,在1987年版的AJCC TNM分期系统中,肿瘤长度被食管壁浸润深度取代,这一变化是基于1969年至1980年日本食管癌登记数据库,该数据库显示,肿瘤浸润深度与食管鳞状细胞癌患者10年生存率的相关性大于肿瘤的表面范围大小。近年来肿瘤长度与食管癌预后及病理特征如T分级、N分级、M分级的相关性被广泛研究。Arigami T[8]等人的研究显示:肿瘤长度与肿瘤入侵深度(P<0.0001)、淋巴结转移(P=0.0066)、静脉入侵(P=0.0025)和肿瘤分期(P<0.0001)显著相关。全身炎症性指标PLR与食管癌之间的关系已被许多研究报道。Sun Y[9]等人的荟萃分析显示:高PLR与入侵深度(P<0.001)、肿瘤长度(P<0.001)、淋巴结转移(P =0.001)和肿瘤分期(P =0.001)相关。然而肿瘤长度和PLR用于诊断食管癌浸润深度的研究少之又少。本研究从食管癌治疗方式的选择入手,标志性选用食管癌内镜下切除适应症的最大浸润深度为界限,研究食管癌浸润深度的相关危险因素,结果显示:肿瘤长度与浸润深度明显相关(P<0.001),其诊断食管癌浸润深度中,AUC为0.796,敏感度为0.722,特异性为0.714;高PLR与肿瘤浸润深度相关(P=0.002),AUC为0.74,敏感度为0.495、特异性为0.883。两者联合诊断,AUC为0.812,敏感度为0.866,特异性为0.61。两者联合AUC和敏感度均高于单独诊断,对浸润深度>SM1的敏感度高达0.866,具有较好的诊断价值。
食管癌尤其是早期食管癌治疗方式的选择主要根据肿瘤浸润深度,术前准确判断浸润深度对患者的治疗方式选择、生存质量、治疗效果以及经济获益方面都有着重大的意义[10]。目前诊断肿瘤浸润深度的方法主要有白光内镜、超声内镜及电子染色放大内镜[11]。本研究选用临床极易获得的病人参数:PLR和术前白光内镜下肿瘤长度,探讨其与肿瘤浸润深度的关系,结果显示PLR与术前白光内镜下肿瘤长度是食管癌浸润深度的危险因素;两者联合可进一步提高肿瘤浸润深度判断的准确性,具有良好的临床应用价值。因此我们建议,把两者联合应用于食管癌浸润深度的诊断,为治疗方式的选择提供更加可靠的依据。
但有一些限制也是不得不承认的。首先,本研究是回顾性设计,这不可避免会造成一些偏差。第二,本研究中样本量不大,这些可能会影响结果的准确性:比如最佳截距值的界定,这在以后的研究中仍需大样本的前瞻性研究进一步验证。

