视神经脊髓炎谱系疾病一般临床特征和神经系统外表现研究
张洋洋,黄丽琴,张倩,焦雯钰
视神经脊髓炎谱系疾病(neuromyelitis optica spectrum disorders,NMOSDs)是一种致残性高、复发率高的主要累及脊髓和视神经的中枢神经系统(central nervous system,CNS)炎性脱髓鞘疾病。特异性水通道蛋白4-抗体(water channel aquaporin-4 immunoglobulin G antibodies,AQP4-IgG)主要攻击CNS 的星形胶质细胞足突,进而引起相应临床症状,因此被认为是具有高度诊断价值的致病性生物学标志物,且AQP4 抗体的发现使NMOSDs 得以区别于多发性硬化(multiple sclerosis,MS),被看做是一种独立的疾病[1]。既往一直认为表达AQP4的外周组织器官处于免疫豁免状态,但近年来,越来越多证据表明NMOSDs 还会引起神经系统以外的器官损伤,如骨骼肌、血液系统、肾脏、胃肠道、肺及胎盘、前庭蜗神经等,其中以前三者损害最常见[2]。作为一种免疫介导、各种炎性因子参与的疾病,体内炎性指标的变化常反映疾病活动状态、进展倾向及预后。有学者提出反映炎性疾病活动度的新指标,如中性粒细胞/淋巴细胞计数比值(neutrophil/lymphocyte ratio,NLR)、血 小 板/淋 巴 细 胞 计 数 比 值(platelet-lymphocyte ratio,PLR)等[3]。在某些患者中,NMOSDs发作较频繁,且复发次数越多,遗留后遗症的概率越高,严重影响日常生活及工作。因此,本研究主要探讨NMOSDs患者的一般临床特点、是否合并外周组织器官受累、以及影响复发的相关临床因素等,以便为患者提供及时的诊治及干预措施。
1 资料与方法
1.1 一般资料
连续回顾性收集于2018年6月1日至2019年12月30日入住我院神经内科并被诊断为NMOSDs的患者为NMOSDs 组,纳入标准:均符合Wingerchuk 2015 年诊断标准,且均知情,并自愿参加临床观察及随访[4,5]。排除标准:心脑血管疾病、恶性肿瘤、凝血功能障碍、严重肝肾功能不全等。并收集性别、年龄相匹配的健康体检者为对照组,同样排除出现上述各类疾病的患者,此外同时排除合并干燥综合征、多发性硬化、系统性红斑狼疮、结缔组织病等自身免疫性疾病的患者。
1.2 方法
收集并记录所有受试者的基本信息,包括性别、年龄等,以及在入院后次日清晨空腹时抽取肘静脉血,检测常见血细胞计数,如白细胞(white blood cells,WBC)、中 性 粒 细 胞(neutrophil,N)、淋 巴 细 胞(lymphocyte,L)、血小板(platelet,P),NLR、PLR、超敏-C 反 应 蛋 白(hypersensitive C-reactive protein,hs-CRP)、肌酐(creatine,Cr)、预估肾小球滤过率(estimated glomerular filtration rate,eGFR)、肌酸激酶(creatine kinase,CK)等指标。此外,由专业神经内科医师详细记录所有确诊患者的临床特征,包括首发核心临床症状、起病形式及病程长短、脑脊液AQP4抗体和1 年内复发次数,并根据MRI 影像学检查结果评估有无颅内受累和病灶范围等。
1.3 统计学处理
所有数据均采用SPSS24.0 软件进行统计学分析。经正态性和方差齐性检验,符合正态分布的计量资料以(均数±标准差)表示,2组间比较采用两独立样本t检验;不符合正态分布的计量资料以中位数(四分位数间距)表示,2组间比较采用非参数检验之两独立样本秩和检验。计数资料以例(%)表示,χ2检验。P<0.05为差异有统计学意义。
2 结果
2.1 NMOSDs患者的一般临床特点
本研究总共纳入NMOSDs 患者55 例,男5 例,女50例,男女比例为1∶10;年龄20~77岁,平均发病年龄为(48.71±14.41)岁,男性发病年龄(50.00±21.97)岁,女性发病年龄(48.58±13.75)岁,男女之间发病年龄差异无统计学意义(P>0.05);初发19例,复发36例;1年内复发<3 次23 例,≥3 次13 例;55 例患者中,29 例行腰椎穿刺,其中脑脊液AQP4 抗体阳性21 例,阴性8 例;首发核心症状为脊髓炎32 例,视神经炎14 例,延髓极后区综合征(area postrema syndrome,APS)9 例;颅内受累13 例,未受累32 例;脊髓病灶于颈段11 例,颈胸腰段6 例,颈胸段4 例,胸腰段3 例;延髓病灶于延髓2例,延髓及颈髓8 例,延髓及颈胸段脊髓3 例。本研究中NMOSDs 患者首发核心临床症状主要表现为脊髓炎、视神经炎、APS,32例(58.2%)以急性横贯性脊髓炎形式起病。脊髓病灶以颈髓最多见,且其常与胸髓、延髓合并受累,13例(28.9%)出现颅内病灶,主要包括丘脑、胼胝体、侧脑室等部位。
2.2 2组各项指标比较
2 组之间年龄及性别差异无统计学意义(P>0.05),N、L、NLR、eGFR、CK等指标之间差异有统计学意义(P<0.05),除L 外,其他各指标均为NMOSDs 组高于对照组,见表1。
2.3 不同临床指标对NMOSDs发病1年内复发次数的影响
将性别、脑脊液AQP4-Ab、有无颅内组织受累及病灶范围纳入分析,结果显示各临床指标之间的差异均无统计学意义(P>0.05),见表2。
3 讨论
NMOSDs好发于中青年女性,临床表现多样,主要包括视神经炎、急性脊髓炎、APS,以及急性间脑、脑干、大脑综合征6 种核心临床症状,以前3 种最常见[5]。作为一种主要由体液免疫介导,IL-6、IL-8、IL-17 等多种免疫因子参与的自身免疫性疾病,炎性指标的变化常与疾病活动度密切相关。分泌大量炎症介质的中性粒细胞和释放各种氧自由基和蛋白酶的淋巴细胞在免疫应答中起重要作用,相比于易受感染、应激等因素影响的中性粒细胞计数,作为一项新型全身炎性指标,NLR似乎更能反映体液免疫和细胞免疫之间的平衡。目前已经证实NLR 与多种疾病有关,如卵巢癌、非小细胞肺癌等恶性肿瘤预后[6,7],预测急性冠脉综合征死亡等不良事件发生率,及系统性红斑狼疮、干燥综合征、类风湿性关节炎等免疫性疾病的严重程度和活动度[8-10]。研究表明NMOSDs患者的NLR显著高于健康对照组,这与本研究结果一致,且处于急性发作期的显著高于缓解期,这表明NLR或许可用于评估NMOSDs疾病活动性变化和反映神经功能障碍的加重程度[11,12]。NMOSDs发病具有明显的缓解-复发交替发作特点,既往研究表明AQP4-IgG 滴度与疾病严重程度和复发率呈正相关[13],病灶受累范围广甚至出现颅内组织损害,表明血脑屏障(blood brain barrier,BBB)严重受损,但本研究结果显示复发次数多少在上述各临床指标的差异无统计学意义,可能与本研究将脑脊液AQP4-IgG而非血清AQP4-IgG 纳入分析、样本量较小、回顾性研究存在选择偏倚等有关。

表1 2组各项指标比较
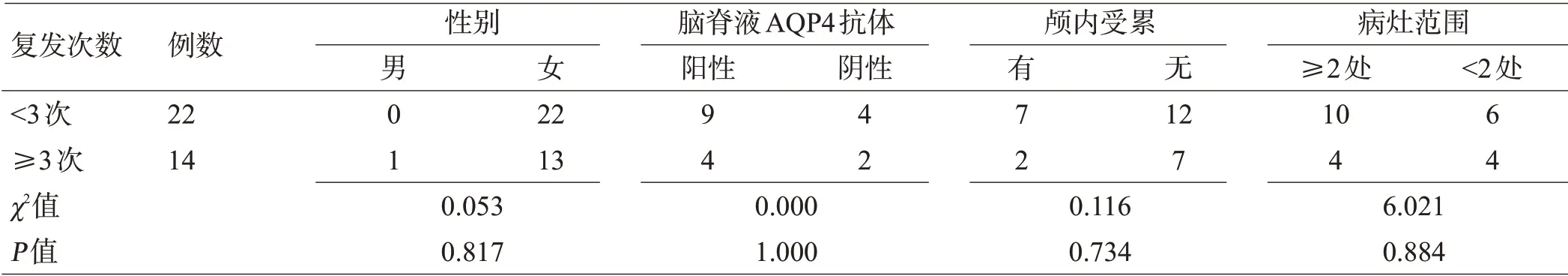
表2 NMOSDs发病1年内复发次数的影响因素
AQP4 是一种具有多个抗原表位的胸腺(T 细胞)依赖性抗原,在星形胶质细胞足突质膜中、视神经、脊髓等神经组织中高度表达,主要参与转运水分子、维持细胞容积、调节细胞内外渗透压变化等生理过程。AQP4主要有两种亚型:M1-AQP4和M23-AQP4,电镜下观察到AQP4 单体组装成同种或异种四聚体,这些四聚体进一步在细胞质膜上自发聚集形成高度有序的超分子结构,称为颗粒正交阵列(orthogonal arrays of particles,OAPs)。由于N-末端多肽的不同,只有M23-AQP4 可形成OAP,且当M1-AQP4 和M23-AQP4同时表达时,前者可抑制后者形成OAPs的大小[14]。在IL-6 刺激下,由浆细胞分泌产生的IgG 通过内皮细胞内吞作用或BBB 受损或薄弱区进入CNS,进而与靶细胞或靶组织上的AQP4结合,产生一系列致病作用,且IgG与AQP4的结合具有亚型特异性,优先与OAP结合是AQP4-IgG 引起补体依赖细胞毒性的先决条件[15]。AQP4-IgG与AQP4结合使星形胶质细胞功能受损,影响水分子转运等功能的正常发挥,且体外实验发现二者结合还会引起细胞黏附分子、细胞及趋化因子、补体等免疫因子表达上调[16],进一步破坏局部炎性微环境稳态,甚至引发少突胶质细胞损伤,导致脱髓鞘、轴突损伤和神经元丢失等病理改变。AQP4-IgG 与AQP4结合形成抗原-抗体复合物,使兴奋性谷氨酸转运蛋白-2 数量减少,导致突触间隙星形胶质细胞对谷氨酸摄取、再循环以及降解减少,细胞外堆积的谷氨酸产生兴奋毒性,可直接引起少突胶质细胞死亡[17]。尽管AQP4-IgG是目前研究最广泛的NMOSDs致病性抗体,但仍有一部分患者AQP4-IgG检测阴性,而髓鞘少突胶质细胞糖蛋白抗体(myelinoligodendrocyte glycoprotein antibody,MOG-Ab)检测阳性[18]。AQP4-IgG(+)和MOG-Ab(+)的NMOSDs 患者在临床特征上有明显差异,后者发病无明显的年龄及性别差异,首发临床症状以单相病程的视神经炎更多见,脊髓病灶以胸腰髓为主,脊髓圆锥与马尾神经丛常受累而引起直肠、膀胱功能障碍,对激素治疗反应敏感,故整体预后较好[19]。研究发现NMOSDs发病率在不同种族人群中存在差异,目前研究最多的是人类白细胞抗原(human leucocyte antigen,HLA)及 其 等位 基 因,HLA-DPB1*0501 和DRB1*1602会增加遗传易感性,DRB1*0901则是保护性因素[20,21]。此外,幽门螺旋杆菌、EB病毒等病原微生物感染[22],疫苗接种、手术外伤、氧化应激同样参与NMOSDs的发生发展。
除神经系统外,AQP4还表达于骨骼肌、胃肠道、肾脏、肺、胎盘等外周组织器官,尤其是近年来,关于NMOSDs患者合并外周组织器官受累的病例报道越来越多,如表现为肌痛、乏力等非特异性症状伴高肌酸激酶血症的骨骼肌受累,免疫性溶血、血细胞减少的血液系统表现,肾病综合征、膜性肾病等肾脏损害[23,24],其中以NMOSDs相关的肌肉损伤研究最多。
Guo及Malik等[25,26]通过对出现高肌酸激酶血症的NMOSDs患者进行肌肉活检,发现核内化、肌纤维萎缩或再生、局部淋巴细胞及嗜酸性粒细胞浸润等非特异性改变,而肌纤维坏死不明显;同时免疫组化结果显示快速收缩的骨骼肌纤维(II 型肌纤维)肌膜上AQP4 表达减少或免疫活性降低,伴随局部IgG和OAPs增加及补体沉积。根据上述病理结果进行推测,在NMOSDs患者中,高肌酸激酶血症的出现或许与肌纤维坏死无关,可能是由于AQP4-IgG与OAPs结合激活补体介导的细胞毒性,肌膜完整性遭到破坏,引起CK泄漏。此外,AQP4还参与肌细胞钙离子稳态的维持和生物能量的代谢,而AQP4 表达减少或丢失引起肌膜结构和功能紊乱,导致大量CK渗漏入血[25]。但也有肌活检标本在镜下未见明显组织病理学改变,且肌膜的免疫荧光染色完全正常,或许与标本取样误差有关。Chen 等[27]进行一项纳入168 例NMOSDs 患者的前瞻性研究,结果表明处于发病急性期的患者血清CK水平显著高于稳定期,这或许与AQP4-Ab滴度高低有关。随后该课题组Zhang等[28]通过大规模队列研究证实AQP4-Ab阳性患者的血清CK水平明显高于阴性患者,且出现高水平的CK 概率更高(sCK>300 IU/L)。然而,在一项大型回顾性研究中,仅<1%患者有明显的高CK 血症,且不同患者肌肉损伤的表现不同,有的表现为无症状或症状轻微的高肌酸激酶血症,有的表现为全身乏力、肌肉酸胀等,严重的甚至出现CK持续升高危及生命,因此肌病可能是NMOSDs临床表现的一部分,可使用肌酶检测筛查NMOSDs患者是否存在潜在的肌肉损害,尤其是疾病恶化进展期间。
除少数病案报道外,Chen 等[29]通过对处于急性期NMOSDs 患者和MS 患者的尿液进行分析,发现前者尿液pH 值、24 h 尿钠及尿量均显著高于后者,而尿比重显著低于后者,提示NMOSDs 患者可合并肾脏损害。Na-K-ATP 酶及AQP4 共定位于远端肾小管、集合管等部位的主细胞基底膜外侧,钠钾泵是钠水重吸收的驱动力,因此IgG沉积和AQP4丢失可能会损伤肾小管上的钠钾泵和钠氢泵,从而导致尿液PH值升高以及尿量、尿钠排泄增加。但Chen等[27]还发现较高的肾小球滤过率、表现为视神经炎的核心临床症状、血清抗SSA 抗体阳性是处于急性期NMOSDs 患者较低肌酸激酶水平的独立预测因子,可能与其合并其他自身免疫性疾病有关。NMOSDs 患者出现反复粒细胞减少、血小板减少、自身免疫性溶血、甚至淋巴瘤的报道不在少数[30,31]。但迄今为止,国内外的病案报道均仅限于NMOSDs患者合并出现自身免疫性血液系统疾病或自身免疫性肾病,而后二者本身均可引起血细胞、肾功能等指标异常,且诸多风湿免疫相关的疾病均有一定的遗传易感性,因此NMOSDs发病机制中的致病性抗体AQP4-IgG是否会直接引起肾脏、血液系统损害尚不得而知,仍需要大规模临床研究进一步证实。同时也有AQP4-IgG阳性处于妊娠期的妇女出现不明原因流产、恶性子痫及原有NMOSDs疾病复发或加重,最终导致胎儿死亡[32]。动物实验表明,在妊娠小鼠的腹腔注射AQP4-IgG 和补体,观察到IgG 与胎盘上表达的AQP4结合并激活补体,引起胎盘广泛炎细胞浸润甚至坏死。Saadoun 等[33]发现肾脏、骨骼肌、胃壁细胞及单独培养的星形胶质细胞均可共表达AQP4 及CD46、CD55、CD59 等补体调节蛋白,后者可通过抑制C3 转化酶活性、抑制攻膜复合物C5b-9 形成等保护细胞免受补体介导的细胞毒性损伤。而与内皮细胞共培养的星形胶质细胞以及NMOSDs病灶周围均缺乏CD59免疫反应性,对IgG和补体介导的细胞裂解更敏感,证明补体调节因子CD59 对表达AQP4 的外周组织器官有保护作用,而低表达或不表达的靶器官更易受到损害,Yao 和Verkman[34]在CD59-/-大鼠上进行的实验结果支持这一点。综上所述,NMOSDs 患者是否出现外周器官受累及严重程度,原因可能有以下四点:不同个体或同一个体不同组织器官的AQP4 表达量存在差异;AQP4-IgG的致病性与M1-AQP4和M23-AQP4两种亚型的表达水平和比值有关,即能否形成IgG 抗体特异性识别的OAPs;外周组织中除AQP4 外,其他水通道蛋白的代偿性表达上调或可弥补AQP4-IgG 引起的神经功能缺损;正常外周组织中补体介导的细胞毒性作用受到补体调节因子CD59的保护性抑制,而CD59在CNS和外周器官之间存在差异性表达。
总之,NMOSDs 好发于青年女性,且复发率较高,多为延髓、颈髓或胸髓联合受累,相较于单纯中性粒细胞或淋巴细胞计数,NLR在预测疾病活动性上具有更好的稳定性。骨骼肌、肾脏等外周器官受累或许构成NMOSDs 临床特征的一部分,但多为非特异性或亚临床表现易被患者自身或临床医师忽略,未来仍需大规模基础实验或临床研究进一步探讨相关的病理生理机制,为扩大NMOSDs疾病谱提供更多证据。
