地黄RgMYB10基因的克隆与表达分析
李铭铭,索艳飞,左 鑫,李欣容,谢彩侠,王丰青*
(1 河南农业大学 农学院,郑州 450046; 2 河南中医药大学 药学院,郑州 450046)
转录因子是能够与真核基因启动子区域中顺式作用元件发生特异性相互作用的DNA结合蛋白,通过转录因子间及其他相关蛋白间的相互作用,激活或抑制转录[1],保证目的基因在特定的时间与空间以特定的强度表达。从蛋白质结构分析,转录因子一般由DNA结合区、转录调控区(激活区或抑制区)、寡聚化位点以及核定位信号这4个功能区组成,其调控基因转录表达的机制为:功能区域与启动子顺式元件作用或与其他转录因子的功能区域相互作用[2],DNA结合区决定了它与顺式作用元件结合的特异性,转录调控区则决定了它对基因表达起激活或抑制作用。根据DNA结合区域的特点可将转录因子分为若干个家族,其中bZIP、WRKY、AP2/ERF和MYB这4类转录因子在植物抗逆中发挥着重要的作用[3]。
MYB转录因子是一个庞大的家族,是植物中最大的转录调控因子家族之一,其结构上存在一段保守的DNA结合区-Myb结构域,因而被称为MYB类转录因子[4]。MYB基因根据其包含的结构域数目的不同可将它分为4个亚类:第1类为只含有1个R结构域的R1-MYB亚类;第2类是含有2个R结构域的R2R3-MYB转录因子亚类,此类是植物中存在数目最多的一种,具有广泛的生物活性,参与植物体内的各种生理生化活动;第3类为含有3个R结构域的R1R2R3-MYB转录因子亚类,其功能主要为调节细胞周期和细胞分化;第4类为含有4个R结构域的4R-MYB转录因子亚类,目前发现的数量较少,对其研究也较少[5]。MYB转录因子在调控植物激素、次生代谢物和环境之间的互作,细胞的分化、器官的形成、叶片形态的建成及生物胁迫和非生物胁迫等过程中起着重要的作用,几乎参与了植物生长发育过程中的各个方面,在植物的生命活动中起着至关重要的作用[6]。ZmMYBC1是第一个在植物中被发现的编码MYB结构域蛋白的基因,它参与了玉米(Zeamays)糊粉层中花青素的生物合成[7]。此后,随着分子生物学和基因组学的快速发展,越来越多的植物MYB转录因子基因相继被人们发现,其分子功能不断得到解析。徐俊雄等[8]利用酵母单杂交技术分析出虎杖(Polygonumcuspidatum)MYB1具有转录抑制活性,PcMYB1的转基因拟南芥(Arabidopsisthaliana)的株高与野生型相比降低24.07%,参与木质素合成的5个相关基因下调表达,说明PcMYB1对木质素合成起负调控作用。王霜等[9]克隆苦荞(Fagopyrumtataricum)中1个与黄酮代谢相关的MYB基因FtMYB23,功能研究发现其对花青素的合成与积累起到促进的作用。在拟南芥中过表达人参(Panaxginseng)MYB4基因,可显著提高植株的耐旱能力[10]。Chu等[11]在大豆(Glycinemax)的毛状根中过表达GmMYB29基因,使大豆毛状根异黄酮含量提高到1.6~3.3倍,相反地,基因沉默(RNAi)株系中异黄酮的含量降低为对照的1/2。茉莉酸甲酯(MeJA)作为一种重要的信号分子,可诱导植物次生代谢产物的积累,在植物次生代谢途径研究中广泛应用,同时也在植物抵抗逆境胁迫中发挥重要作用[12]。丹参(Salviamiltiorrhiza)经MeJA处理后SmMYB7的表达量上调,可提高丹参对逆境的防御[13],并且MeJA处理可以显著提高丹参毛状根中丹参酮类成分的积累[14]。MeJA可诱导甘草(Glycyrrhizauralensis)悬浮细胞中MYB10基因和菘蓝(Isatisindigotica)MYB4基因的表达[15-16],为进一步探索其分子功能奠定基础。
地黄(Rehmanniaglutinosa)为玄参科(Scrophulariaceae)地黄属多年生草本植物,以块根入药,是中国著名的“四大怀药”之一。因其含有苯乙醇苷类、环烯醚萜苷类、酚酸、多糖、紫罗兰酮等活性成分,而具有抗肿瘤、保护神经、抗糖尿病及其并发症、增强免疫等多种药理活性[17-18]。其指标性成分之一毛蕊花糖苷具有抗氧化[19]、抗炎[20]、保肝[21]、增强记忆力[22]和免疫调节[23]等多种功能。课题组前期推导优化了毛蕊花糖苷的生物合成途径,鉴定出219个可能参与地黄毛蕊花糖苷合成的转录本,基于它们的表达模式筛选出与毛蕊花糖苷积累一致的关键候选基因[24]。然而,转录因子在地黄毛蕊花糖苷合成中的分子功能迄今未见报道。课题组前期研究发现,适宜浓度的SA和MeJA可显著诱导提高地黄毛状根中的毛蕊花糖苷含量[24]。宋小峰等[25]也发现,用MeJA处理地黄的毛状根,毛蕊花糖苷含量在诱导后的第二天达到峰值,为对照的1.41倍。本研究从课题组前期筛选出与毛蕊花糖苷积累一致的候选基因中,检索到1个注释为MYB的核酸序列,应用分子手段对它进行PCR克隆,并对其分子结构特征和进化关系进行分析,检测地黄MYB基因在不同部位的表达量和响应诱导子的表达特性,以期揭示其在地黄毛蕊花糖苷合成中所发挥的作用。
1 材料和方法
1.1 试验材料
以怀地黄品种‘温85-5’为材料,经福建农林大学张重义教授鉴定为R.glutinosa。种植于河南武陟百疗怀药科技开发有限公司的基地,在地黄出苗后90 d取样,分别取块根、须根、茎、嫩叶、初展开叶、老叶的鲜样于液氮中速冻,置于-80 ℃冰箱保存备用。以实验室培养的发根农杆菌(Agrobacteriumrhizogenes)A4诱导的‘温85-5’毛状根为诱导子处理的材料。
1.2 试验方法
1.2.1 RNA的提取和反转录将备用样品每个称取50 mg,采用宝生物的RNA提取试剂盒提取地黄的总RNA(方法参照说明书进行)。反转录采用反转录试剂盒进行。用于cDNA第1链合成需要约2 μg的总RNA,1 μL oligo dT(50 μmol·L-1)引物,1 μL dNTP,0.5 μL RNase抑制剂(40 U·μL-1),1 μL Prime Script Ⅱ反转录酶(200 U·μL-1),最后加入去离子水至总体积20 μL。反应程序为:65 ℃ 5 min,42 ℃ 60 min,95 ℃ 5 min,4 ℃ 2 min。
1.2.2 cDNA克隆从GenBank中下载拟南芥MYB基因的核酸序列,利用软件BLASTn在地黄转录组文库中进行同源搜索,对获得的序列利用在线软件ORF Finder进行开放阅读框(ORF)预测,获得1个具有完整ORF的MYB10基因。根据基因编码区设计特异性引物来扩增包含完整编码区的cDNA片段,引物具体序列见表1。以地黄的cDNA为模板进行PCR扩增,反应体系为25 μL,包括5×PrimeSTAR®Buffer 5 μL,dNTP 2 μL,正向引物(10 μmol·L-1)和反向引物(10 μmol·L-1)各0.5 μL,cDNA模板0.5 μL,PrimeSTAR®HS DNA 聚合酶0.25 μL,添加16.25 μL的ddH2O。PCR扩增程序:98 ℃预变性30 s,98 ℃变性10 s,65 ℃退火15 s,72 ℃延伸60 s,循环2次,退火温度梯度降低至55 ℃,最后循环20次,72 ℃延伸5 min。PCR反应结束后,用1%琼脂糖凝胶电泳检测,检测电压为120 V,时间为30 min。PCR产物纯化后送上海生工测序,确定基因的正确序列。
1.2.3MYB10基因的生物信息学分析利用NCBI在线分析软件ORF Finder(https://www.ncbi. nlm.nih.gov/orffinder/)分析其开放阅读框,运用在线软件ExPASy(http://web.expasy.org/protparam/)分析蛋白质一级结构,利用在线软件Clustal Omega(https://www.ebi.ac.uk/Tools/msa/clustalo/)和序列编辑软件GENEDOC对氨基酸进行多序列联配分析,用在线软件MEME(http://meme-suite.org/)预测蛋白质的结构域,用在线分析软件MAFFT和离线软件MEGA7.0构建系统发育树。
1.2.4 诱导子处理地黄毛状根以发根农杆菌A4诱导的‘温85-5’的毛状根为处理材料,在MS液体培养基中悬浮培养30 d,进行诱导子处理。诱导子种类和浓度分别为:25 μmol·L-1SA、5 μmol·L-1Ag+、5 μmol·L-1MeJA和15 μmol·L-1Put。分别在添加诱导子后的3、9、12和24 h取样置于液氮,之后于-80 ℃冰箱保存,以未添加诱导子的毛状根作为对照。
1.2.5 基因表达量检测用1.2.1的方法提取地黄不同组织部位和诱导子处理后的毛状根的总RNA并经过反转录后进行基因表达量的检测。用Bio-Rad iQ5仪器进行实时荧光定量PCR(qRT-PCR)的检测。根据地黄MYB基因的编码序列信息设计特异引物(表1),以RgTIP41为内参基因。实时荧光定量分析试剂盒SYBR Premix Ex TapTMⅡ(Tli RNaseH Plus)。PCR扩增体系为:SYBR Premix Ex Taq 12.5 μL,正向引物(10 μmol·L-1)1 μL,反向引物(10 μmol·L-1)1 μL,cDNA模板2.0 μL,ddH2O 8.5 μL,共计25 μL。反应条件为:95 ℃ 30 s,95 ℃ 5 s,60 ℃ 30 s,40个循环。以2-ΔΔCt计算MYB基因的相对表达量。

表1 引物序列
2 结果与分析
2.1 基因克隆
地黄MYB基因PCR扩增结果(图1)显示,扩增产物在750 ~1 000 bp之间,经测序该序列全长875 bp。ORF Finder预测结果显示,该序列包含一个完整的开放阅读框,推测其编码的蛋白质序列为247 aa,将其命名为RgMYB10。序列已经提交到NCBI GenBank数据库,注册号为KR780086。
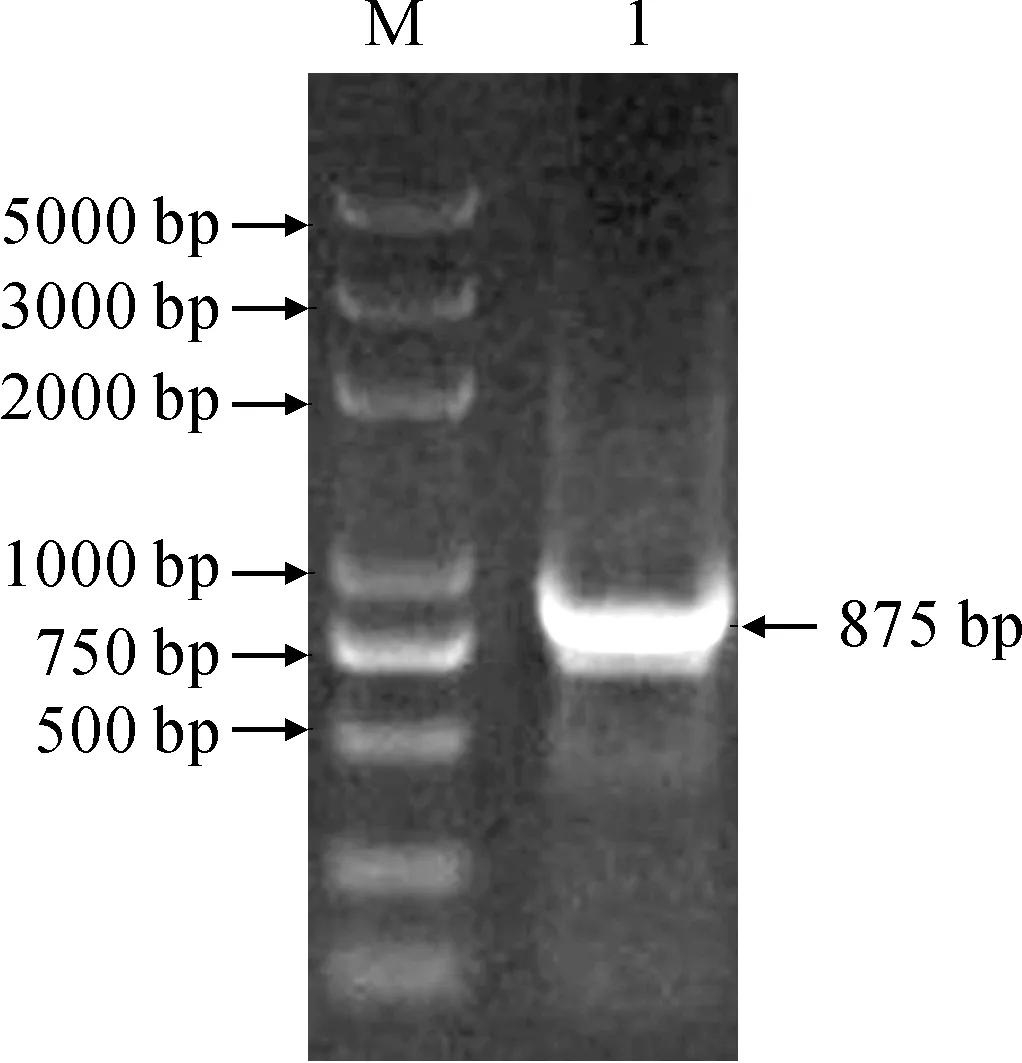
M. DL2000;1. RgMYB10
2.2 RgMYB10的序列特征分析
应用Ex PASy在线软件计算RgMYB10蛋白的理化性质。结果发现,RgMYB10编码蛋白由247个氨基酸组成,原子总数为3 913,分子式为C1247H1911N347O396S12,预测其相对分子质量为28.48 kD,理论等电点为5.14,说明这个蛋白偏酸性。蛋白的不稳定系数为49.13,说明其为不稳定蛋白。总平均亲水系数为-0.846,说明该蛋白是亲水性蛋白。应用NCBI在线工具(http://www.ncbi.nlm.nih.gov/Structure/cdd/wrpsb.cgi)和在线软件SMART(http://smart.embl-heidelberg.de/smart/batch.pl)对RgMYB10基因所编码的氨基酸序列进行保守结构域分析。结果如图2所示,RgMYB10蛋白具有2个SANT结构域,即属于MYB家族中的R2R3家族。分别在第13~63和66~114个氨基酸处各为一个SANT结构域,在第151~165和193~210个氨基酸处有2个成分复杂度较低的区域。
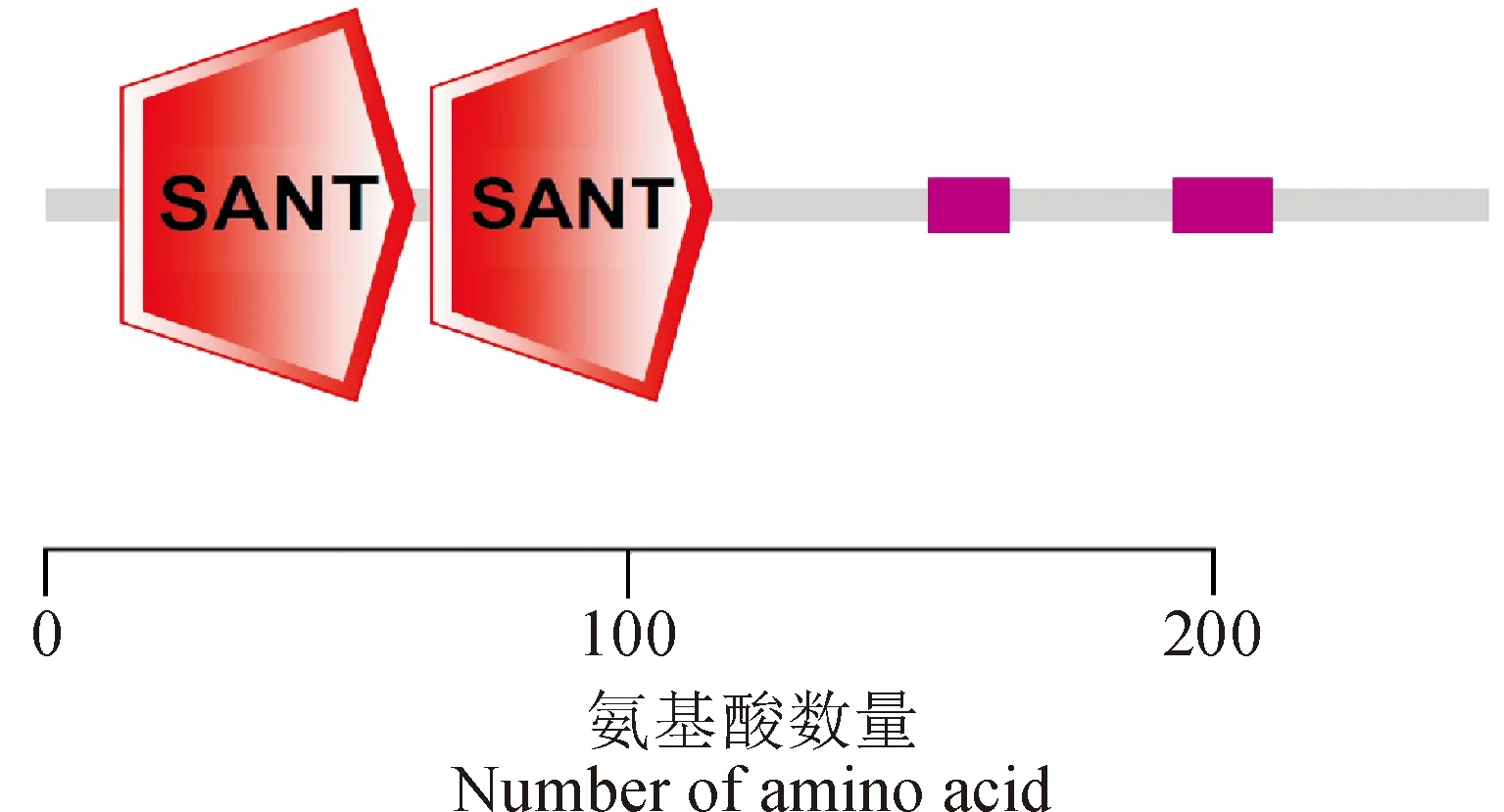
图2 地黄RgMYB10蛋白质的保守结构域Fig.2 Conserved domains of R. glutinosa RgMYB10 protein
2.3 RgMYB10蛋白的保守结构域和多序列比对
为了进一步了解RgMYB10蛋白的功能和进化特征,从NCBI上下载了与RgMYB10相似性较高的9个物种的氨基酸序列,利用在线软件MEME(http://meme-suite.org/)将这些蛋白进行保守结构域的预测。如图3所示,预测结果表明,10个物种中除松蒿以外,其他9个物种均具有3个相同且保守的基序(Motif),说明RgMYB10在进化过程中相对保守,并且,Motif1、Motif2和Motif3均为保守的DNA结合结构域。利用GENEDOC对这10个MYB蛋白进行多序列联配,如图4所示,这10个MYB蛋白在N端高度保守,共同拥有R2R3 DNA结合区,其中包含一系列高度保守的色氨酸(Trp)残基,而在C端差异很大,进一步说明RgMYB10在进化过程中具有一定的保守性。
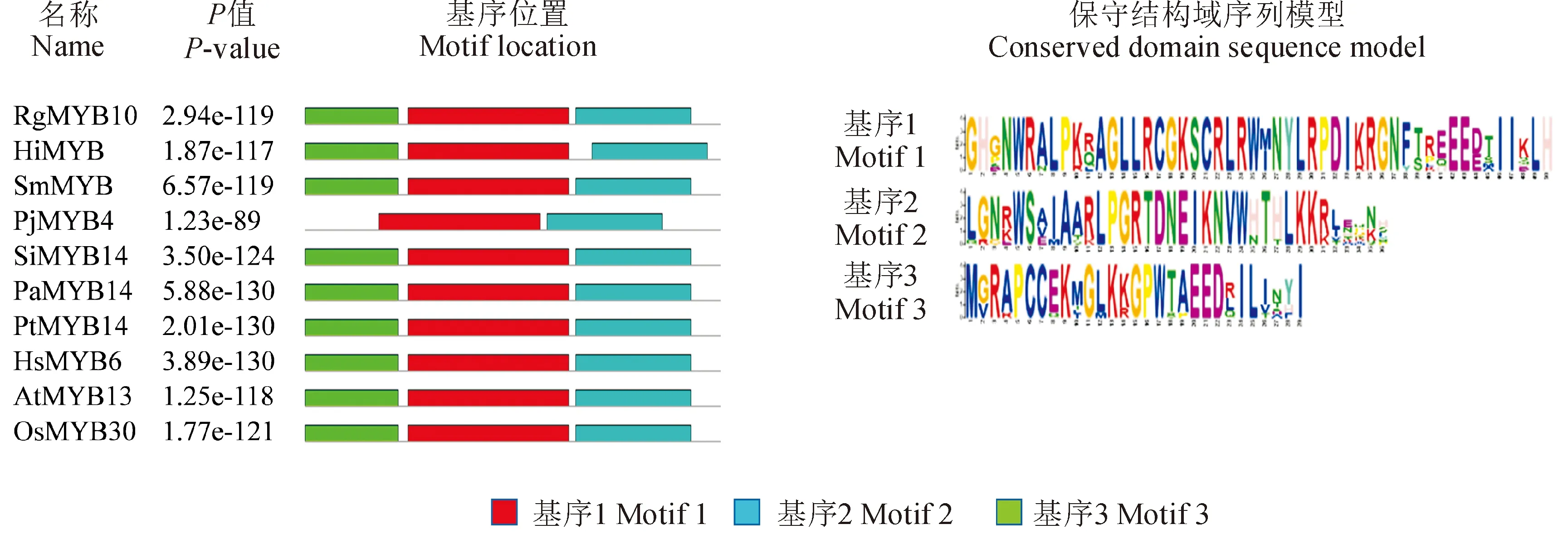
Rg,地黄;Hi,紫花风铃木;Sm,丹参;Pj,松蒿;Si,芝麻;Pa,银白杨;Pt,毛果杨;Hs,木槿;At,拟南芥;Os,水稻

*MYB结构域保守的色氨酸(W)残基。Rg.地黄;Hi.紫花风铃木;Sm.丹参;Pj.松蒿;Si.芝麻;Pa.银白杨;Pt.毛果杨;Hs.木槿;At.拟南芥;Os.水稻
2.4 RgMYB10的3D结构预测及二级结构分析
用SWISS-MODEL在线软件(http://swissmodel.expasy.org/interactive)对RgMYB10蛋白进行3-D建模,结果如图5所示,RgMYB10以6kks.1.A为建模模板,序列一致性为57.52%,在空间上都包含6个α螺旋。利用SOPMA在线软件(https://npsa-prabi.ibcp.fr/cgi-bin/secpred_sopma.pl)预测RgMYB10蛋白的二级结构,结果显示,RgMYB10基因编码的蛋白质由α-螺旋、β-折叠、无规则卷曲和延伸链组成,分别占总蛋白的34.82%、4.05%、55.47%和5.67%。
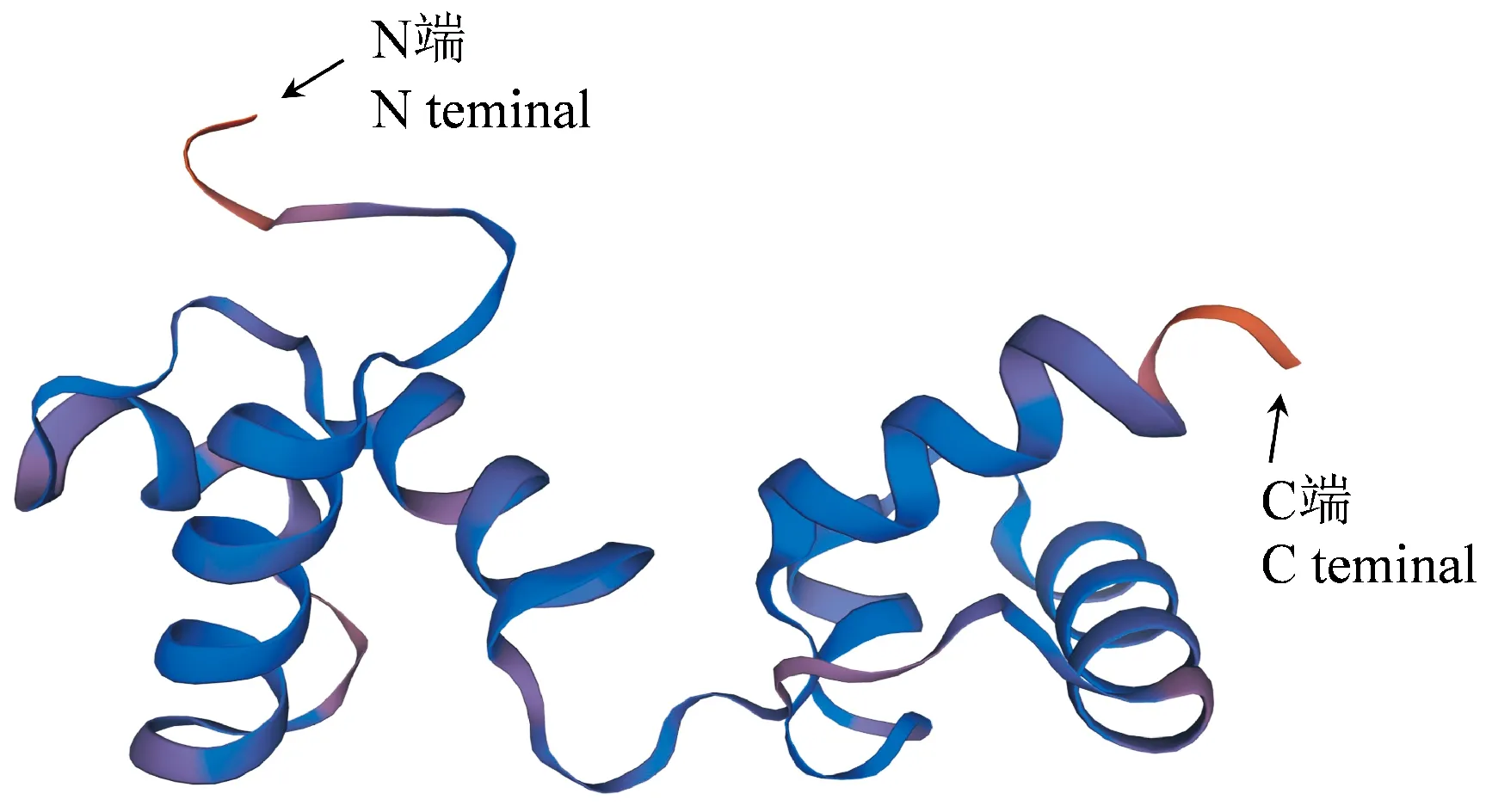
图5 地黄RgMYB10蛋白的三维结构预测模型Fig.5 Three-dimensional structure prediction model of R. glutinosa RgMYB10 protein
2.5 RgMYB10的系统进化分析
以地黄MYB10蛋白的氨基酸序列在NCBI上进行同源搜索,将获取的同源蛋白用MEGA 7.0软件以邻接法(Neighbor-Joining)进行分析,构建系统发育进化树。结果(图6)表明,RgMYB10蛋白与其同源蛋白分成3个不同类群,3个类群均聚在一起的概率皆为100%,可信度非常高。RgMYB10与同为玄参科松蒿的同源蛋白PjMYB4(GFP99600.1)聚在一起,概率为67%,序列相似性为64.63%,与独脚金(Strigaasiatica)同源蛋白SaMYB(GER55192.1)的序列相似性为56.8%,与猴面花(Erythrantheguttata)同源蛋白EgMYB4(XP_012828913.1)的序列相似性为58.17%,与芝麻同源蛋白SiMYB14(XP_011080041.1)的序列相似性为62.7%,与紫花风铃同源蛋白HiMYB(PIN01206.1)的序列相似性为58.96%,它们的亲缘关系较近,同属类群Ⅰ。同属于杨柳科的银白杨、毛果杨和胡杨(Populuseuphratica)的MYB同源蛋白聚在一起,同属类群 Ⅱ。单子叶植物水稻、玉米和高粱(Sorghumbicolor)的MYB同源蛋白聚在一起,同属类群 Ⅲ。进化分析结果表明RgMYB10在进化上相对保守,不同物种间的关系符合物种进化规律。
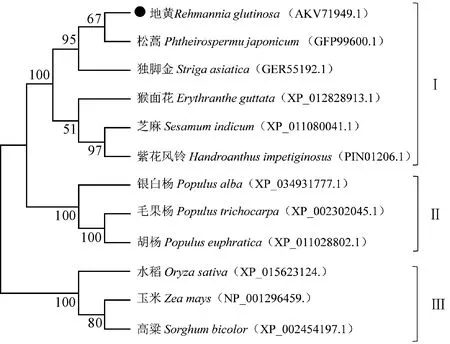
图6 地黄RgMYB10的分子进化系统发育树Fig.6 Molecular evolutionary phylogenetic tree of R. glutinosa RgMYB10
2.6 RgMYB10基因组织特异性表达分析
分析了RgMYB10基因在地黄块根、须根、茎、嫩叶、初展开叶和老叶6个组织中的表达量,结果(图7)表明,RgMYB10基因在6个地黄组织中均有表达,且在不同的组织器官中呈现不同的表达模式。RgMYB10在须根中的表达量最高,达到399.97,茎中次之为100.73,在块根中的表达量非常低,仅为1.02。随着叶片的生长发育,由嫩叶到初展开叶再到老叶,表达量先升高后降低,在初展开叶中最高,达到30.42,老叶次之为25.35,嫩叶最低为5.53。根据表达量的结果,RgMYB10在须根中的表达明显高于其他5个部位,可推测RgMYB10为须根中特异表达的基因,在须根中起到非常重要的生物学作用。
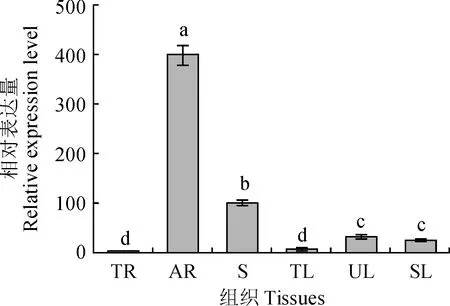
TR. 块根;AR. 须根;S. 茎;TL. 嫩叶;UL. 初展开叶;SL. 老叶。不同小写字母表示基因表达量在不同组织中有显著差异(P<0.05)
2.7 RgMYB10基因响应诱导子处理的表达特性
为了分析RgMYB10基因响应外源诱导子的表达,在地黄毛状根培养30 d时分别添加SA、Ag+、Put和MeJA,在处理后的3、9、12、24 h取样,提取总RNA,应用qRT-PCR检测RgMYB10的表达量。如图8所示,在SA处理后,所检测的4个时间段内RgMYB10基因的表达量均没有上调,且在9 和24 h显著低于对照。Ag+作用下,在处理后的3和9 h,与对照相比表达量有所上升,在处理后3 h达到最大,为对照的1.83倍,随后持续下降,在6 h时为对照的1.81倍,之后低于对照。MeJA处理后,在所检测的4个时间内,地黄RgMYB10基因的表达量与对照相比均显著上调,处理后3 h达到峰值,为对照的30.5倍,随后表达量有所下降但都显著高于对照,在处理后24 h表达量最低但仍为对照的11.7倍。Put作用下基因表达量变化规律同Ag+,同样在处理后3 h达到峰值,为对照的5.9倍,随后持续下降在6 h为对照的2.5倍,之后低于对照。由此可以看出,地黄RgMYB10是特异响应MeJA诱导上调表达的基因。

* 表示与对照相比在0.05水平上存在显著差异
3 讨 论
MYB转录因子不但是植物生长发育的重要调节因子,而且在植物的多种次生代谢途径中发挥重要的调控作用[26],其中,R2R3-MYB亚家族是植物中发现的最丰富的MYB家族,广泛参与植物黄酮类[27-29]、萜类[30-31]和苷类[32]化合物的生物合成。本研究利用分子手段克隆了地黄的1个MYB(RgMYB10)基因,结构分析表明,RgMYB10编码的蛋白由247个氨基酸组成,N端具有2个SANT结构,属于典型的R2R3-MYB转录因子结构特征,2个结构域分别由51和49个氨基酸组成,并且这两个结构域中含有典型的R2R3-MYB转录因子所特有的保守的色氨酸残基W,因此,克隆的地黄RgMYB10为R2R3-MYB转录因子。
MeJA作为内源信号分子参与植物在干旱、低温、盐胁迫、机械伤害、病虫害等条件下的抗逆反应,保护植物免受生物和非生物胁迫[33]。研究表明,15~60 μmol·L-1浓度范围内的MeJA处理可减轻甘草的氧化胁迫,增强其碳和氮代谢,促进盐胁迫下甘草幼苗的生长[34],10 μmol·L-1MeJA处理烟草幼苗可降低低温对植物体的损伤[35]。同时,MeJA作为基因调控的诱导子,对参与植物次生代谢产物合成的相关基因的表达起到调控作用,进而调控植物次生代谢产物的合成与积累[36]。Li等[37]在甘草悬浮细胞中加入MeJA,甘草GlMYB4和GlMYB88的表达量明显增加,过量表达GlMYB4和GlMYB88基因的甘草悬浮细胞中,类黄酮的含量均显著提高。张文娟等[38]用MeJA诱导大戟(Euphorbiapekinensis)愈伤组织,发现大戟愈伤组织中总三萜的含量提高,大戟三萜类成分合成途径中的HMGR、SQS和FPS基因的表达量也显著增加。行冰玉等[39]研究表明,丹参悬浮细胞经外源施用MeJA处理后,提高了迷迭香酸生物合成途径中苯丙氨酸解氨酶(PAL)和酪氨酸氨基转氨酶(TAT)的生物活性,进而显著提高愈伤细胞中迷迭香酸的积累量。课题组前期研究发现,在地黄毛状根中添加适宜浓度的MeJA可显著促进毛蕊花糖苷的积累[24],说明MeJA正向调控了地黄毛蕊花糖苷的生物合成,因此,通过检测MeJA添加后地黄毛状根中RgMYB10基因的表达量有助于揭示其在毛蕊花糖苷合成中的分子功能。
植物体中,关键催化酶基因和转录因子基因的表达与植物次生代谢产物的合成与积累存在一定的相关性。康俊梅等[40]研究表明,过表达苜蓿(Medicagosativa)皂甙合成途径中的关键限速酶——苜蓿鲨烯环氧酶(MsSQE1)后,转基因株系中MsSQE1的表达量最高为对照的9.45倍,同时,总皂苷的含量相比对照提高14.26%~28.05%。Cui等[41]对丹参SmCPS1基因进行靶向沉默(RNAi),沉默株系与野生型(WT)相比,RNAi植株表现出明显的白色根表型,WT为红色,根中的次生代谢产物隐丹参酮、丹参酮I、丹参酮IIA的含量显著降低。已有的研究表明,地黄植株不同部位的毛蕊花糖苷含量有很大差异。地黄叶片中的毛蕊花糖苷含量远高于块根[42],须根中的毛蕊花糖苷含量明显高于块根韧皮部、木质部和周皮[43],展开叶和衰老叶中含有较多的毛蕊花糖苷[24]。本研究发现RgMYB10在须根中表达量最高,其次为茎,在块根中的表达量最低,随着叶片生育期的延长,由嫩叶、初展开叶到衰老叶,RgMYB10基因的表达量呈先升后降的趋势,说明RgMYB10基因在地黄不同器官的表达模式与毛蕊花糖苷的含量变化具有一定的正相关性。而且,在MeJA的诱导下,地黄毛状根中RgMYB10的表达量大幅度增加,而其他3种诱导子对RgMYB10的表达量没有促进作用,说明RgMYB10可以特异响应MeJA的诱导,可能是响应MeJA处理促进毛蕊花糖苷合成的关键转录因子,其分子调控机制仍需进一步的研究。

