猪瘟病毒和猪圆环病毒2型二重荧光LAMP检测方法的建立
谢志勤,张民秀,谢芝勋,范 晴,罗思思,谢丽基,黄娇玲,王 盛,曾婷婷,张艳芳,李 孟,李 丹,邓显文,刘加波
(广西壮族自治区兽医研究所/广西兽医生物技术重点实验室,广西南宁 530001)
猪瘟(Classical swine fever,CSF)是由猪瘟病毒(Classical swine fever virus,CSFV)引起猪的一种急性和高度接触传染性疾病,以稽留高热、皮下出血、脾梗死等为特征,病死率高。 我国对CSF采取了很多严格的防疫措施,有效地控制了猪瘟的广泛流行,但是该病在我国以及世界许多养猪国家依然存在[1]。猪圆环病毒病(Porcine circovirus disease,PCVD)是由猪圆环病毒2型(Porcine circovirus type 2,PCV2)引起的猪一种传染病,以早期淋巴结肿大,食欲不振,呼吸困难,腹泻,早产及死胎等为特征,发病率和病死率较高[2-4]。
近年由CSFV和PCV2共同感染引发猪病的报道较多[5-7]。原因是PCV2感染率高,导致一些猪场出现CSF免疫失败,从而引发PCV2感染的同时感染CSFV,临床表现为体温升高、急性死亡、怀孕母猪流产或死胎等,根据临床症状很难做出判断,需要借助实验室手段进行确诊。常用的实验室方法很多[8-14]。本研究分别在CSFV和PCV2特异性引物上标记不同的荧光基团和淬灭基团,经LAMP反应后,标识在CSFV和PCV2序列上的不同荧光基团断裂而游离,在特定的荧光通道下,游离的不同荧光基团发出不同的颜色,根据不同颜色一次反应能同时鉴别CSFV和PCV2。
1 材料与方法
1.1 材料
1.1.1 主要试剂 LAMP试剂盒(批号8Y007),荣研生物科技(中国)有限公司产品;Bst3.0 DNA/RNA聚合酶,NEB公司产品;RNA/DNA提取试剂盒、质粒小量提取试剂盒,北京全式金生物技术有限公司产品;全血RNA提取试剂盒(货号:51025),百代生物公司产品;premixTaqPCR试剂盒、PMD-20T载体,宝生物工程(大连)有限公司产品。
1.1.2 主要仪器 Loopamp实时浊度仪,日本荣研公司产品;核酸测定仪,美国Thermo Fisher Scientific公司产品;多色荧光成像分析系统,美国Bio-Rad公司产品。
1.1.3 试验用毒株 猪瘟病毒石门株(F114)购自中国兽医药品监察所,本实验室保存;猪瘟兔化弱毒株(C株),广西丽原生物股份有限公司提供;猪瘟病毒地方分离株:N 株/1986、B 株/1987、L 株/1988、 GXH-2/2000,广西兽医研究所分离鉴定并保存;猪圆环病毒2型BH5株,广西壮族自治区兽医研究所保存;猪口蹄疫O型灭活疫苗毒株,购自中国农业科学院自兰州兽医研究所;牛病毒性腹泻病毒Orevgon C24V株(BVDV Orevgon C24V),购自中国兽药监察所;猪呼吸与繁殖综合征病毒( CH-1R株,美洲型),购自哈尔滨维科生物技术开发公司;猪细小病毒 (PPV)、日本脑炎病毒(JEV)、猪伪狂犬病病毒(PRV)、猪布鲁氏菌2号(BS2)、猪链球菌2型(SS2),广西壮族自治区兽医研究所保存。
1.2 方法
1.2.1 引物和探针设计 根据GenBank中收录的猪瘟病毒毒株E2基因(登录号:MK124646.1)和猪圆环病毒2型ORF2基因(登录号:KY947578.1)序列保守区域,通过MEGA 5.0在线比对分析,然后用Primer premier 5.0和Primer explore V4软件分别设计了2套用于LAMP特异性扩增的引物及探针。特异性引物包括外引物F3和B3,内引物FIP(FIP=F1c+F2)和BIP(BIP=B1c+B2),探针1条。设计的探针序列介于F1c和B1c之间,在探针的两端分别标记荧光基团和淬灭基团。CSFV-Probe探针的5′端标记荧光基团FAM,3′端标记了淬灭基团BHQ1,该基团在520 nm波长下发绿色光。PCV-Probe 5′端标记荧光基团Cy5.5,3′端标记淬灭基团BHQ2,该基团在690 nm波长下发红色光。引物由宝生物工程(大连)有限公司合成,HPLC级纯化(表1),引物位置示意图见图1。
1.2.2 病原核酸提取 按照RNA/DNA提取试剂盒说明书要求步骤进行病原核酸的提取,首先吸取250 μL 病毒液或经处理的临床样品上清液放到1.5 mL离心管中,加入病毒裂解液200 μL混合,然后按步骤进行病原RNA/DNA提取,最后加TE洗脱缓冲液25 μL离心洗脱RNA/DNA,分装,置-80℃保存备用。

表1 二重LAMP的引物序列
1.2.3 标准模板的制备 将提取的CSFV C株RNA反转录成cDNA,用CSFV外引物(CSFV-B3,CSFV-F3)扩增反转录后的cDNA模板,扩增产物片断大小约为224 bp。同样,用PCV外引物(PCV-F3,PCV-B3)扩增PCV2 BH5的DNA模板,扩增产物片断大小约为324 bp。PCR产物经琼脂糖凝胶电泳切胶回收,与PMD-20T载体连接转化感受态细胞DH5α,经PCR和双酶切鉴定重组菌,用质粒小量试剂盒提取培养的阳性重组菌中的质粒。用Nano drop 2000测定提取质粒的浓度。按公式计算换为拷贝数:拷贝数(copies/μL)=6.02×1023/660×3 000×10-9×质粒浓度(g/μL)。将等量的2种模板按不同浓度进行配比或按梯度进行稀释,制备标准模板保存于-70℃备用或直接应用。
1.2.4 二重荧光LAMP反应的建立 将制备的CSFV C株和PCV2 BH5标准质粒,按不同的浓度进行配比混合,然后加入二重荧光LAMP反应体系,并对反应体系中引物浓度、探针浓度及退火延伸温度范围进行优化,优化的引物浓度、探针浓度及温度范围如下:内引物5 pmoL/μL~60 pmoL/μL,外引物1 pmoL/μL~20 pmoL/μL,探针0.1 pmoL/μL~1 pmoL/μL,退火和延伸温度范围60℃~68℃。
1.2.5 LAMP结果判定 将反应产物取出,置多色荧光成像分析系统中,选择520 nm和690 nm荧光通道下显色,在520 nm荧光通道下含有阳性对照的CSFV样品呈绿色,PCV2样品和对照样品为无色,在690 nm荧光通道下含有阳性对照的PCV2样品呈红色,CSFV和对照样品为无色,在520 nm和690 nm共同荧光通道下,有CSFV无PCV的样品呈绿色,有PCV无CSFV的样品呈红色,同时含有CSFV和PCV的样品呈黄色,对照样品为无色。在标准阳性和阴性样品成立的情况下,根据颜色判断样品检测结果,结果直观准确,容易判断。

图1 CSFV和PCV2 引物设计位置示意图
1.2.6 二重荧光LAMP特异性测试 提取CSFV F114、CSFV C、CSFV N/1986、CSFV B/1987、CSFV L/1988、CSFV GXH-2/2000的RNA和PCV2 BH5 的DNA。同时提取对照毒株PRRSV CH-1R、FMDV O型、BVDV Orevgon C24V、PPV、JEV、PRV、BS2、SS2的核酸,并测定其浓度,用建立的方法对这些病原核酸进行二重荧光LAMP扩增检测,验证本方法的特异性。
1.2.7 二重荧光LAMP敏感性和干扰性测试 将制备的CSFV C毒株和PCV2 BH5毒株的质粒标准模板测定浓度,根据浓度换算为拷贝数,然后作10倍梯度稀释,稀释范围为1×107~1拷贝/μL,将各梯度相同拷贝浓度的CSFV和PCV核酸等体积混合,利用本试验建立的二重荧光LAMP方法对CSFV和PCV混合模板进行测试,检验本方法的最低检出的拷贝数。同样,将不同拷贝浓度的CSFV和PCV核酸交叉两两等体积混合,利用本试验建立的二重荧光LAMP方法对CSFV和PCV混合模板进行测试,检验不同的模板浓度对本方法的干扰性。
1.2.8 临床样品检测验证 采集广西不同地区不同猪场患病猪的样品112份,包括猪全血59份、肺组织21份和淋巴结32份。
1.2.8.1 提取肺组织及淋巴结组织中病毒核酸 取适量的肺组织、淋巴结分别进行研磨,按1∶5加入灭菌的磷酸盐缓冲溶液(PBS)继续研磨匀浆,吸取1.5 mL匀浆放入到2 mL EP管中,置-70℃反复冻融 3次,8 000 r/min离心5 min,吸取上清液250 μL按RNA/DNA提取试剂盒提取核酸。
1.2.8.2 提取猪全血中病毒的核酸 取猪全血100 μL,按全血RNA提取试剂盒说明书中步骤提取核酸。将提取的核酸反转录成cDNA,然后用本试验建立的二重荧光LAMP进行扩增检测,同时用已建立的CSFV和PCV荧光定量PCR方法作为对比检测,对扩增阳性的产物送生物公司进行测序,以验证本方法建立的二重荧光LAMP的准确性。
2 结果
2.1 二重LAMP方法的建立
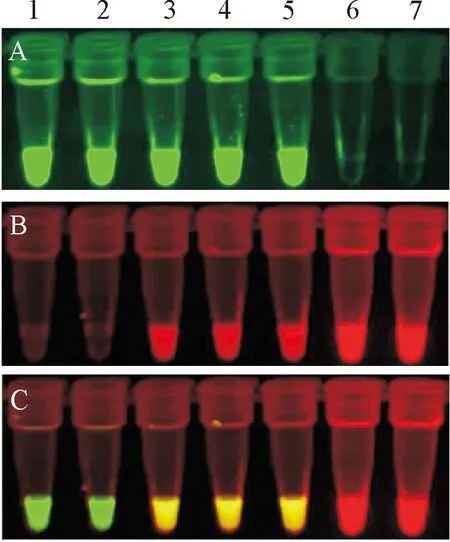
将制备的CSFV C和PCV2 BH5标准质粒加入到二重荧光LAMP反应,反应体系为25 μL,经优化后的最佳反应试剂如下:2×LAMP buffer 12.5 μL,Bst3.0 DNA/RNA 聚合酶320 U,40 pmol/μL内引物CSFV-FIP、CSFV-BIP、PCV-FIP和PCV-BIP各1 μL(工作终浓度1.6 pmol),5 pmol外引物CSFV-F3、CSFV-B3、PCV-B3和PCV-F3各1 μL(工作终浓度0.2 pmol),0.5 pmoL探针CSFV-Probe和PCV-Probe各1 μL(工作终浓度0.02 pmol),cDNA或DNA模板2 μL,用灭菌超纯水补足25 μL。将各试剂轻轻混合,置Loopamp实时浊度仪或恒温水浴锅。经优化后最佳的退火延伸温度为62℃ 90 min,85℃ 5 min结束反应,结果见图2。 图2中A中含有CSFV品的1、2、4管呈绿色,含PCV2、 对照水及PRRSV CH1R的3、5、6管无颜色。图2B中含有PCV2 BH5样品的3~4管呈红色,含CSFV、对照水及PRRSV的1、2、5、6管呈无颜色。图2C中含有CSFV样品的1~2管呈绿色,含有PCV2 BH5样品的3管呈红色,同时含有CSFV C和PCV2 BH5样品的4管呈黄色,含有对照水及PRRSV CH1R的5管和6管呈无颜色。

A.520 nm;B.690 nm;C.520 nm和690 nm;1.CSFV F114;2.CSFV C株;3.PCV2 BH5;4.CSFV C+PCV2 BH5;5.对照;6.PRRSV CH1R
2.2 特异性测试结果
用建立的方法对CSFV和PCV2及对照毒株进行扩增。本方法只能扩增CSFV F114、CSFV C、CSFV N/1986、CSFV B/1987、CSFV L/1988、CSFV GXH-2/2000和PCV2 BH5毒株并显色,对照毒株PRRSV CH-1R、FMDV O型、BVDV Orevgon C24V、PPV、JEV、PRV、B.sius没有呈现任何颜色,即对照毒株没有扩增,毒株间没有交叉颜色出现,特异性良好,结果见图3。图3A中含CSFV的2、4~8管呈绿色,含PCV2 BH5、水、FMDV O型、PPV、JEV、PRV、BS2、SS2的1、3、9~16管呈无颜色。图3B中含PCV2 BH5样品的1、4~8管呈红色,含CSFV、水、FMDV O型、PPV、JEV、PRV、BS2、SS2的2、3、9~16管呈无颜色。图3C中含PCV2 BH5样品的1呈红色,含CSFV样品的2管呈绿色,同时含有CSFV和PCV2 BH5样品的4~8管呈黄色,水、FMDV O型、PPV、JEV、PRV、BS2、SS2的3、9~16管呈无颜色。
2.3 敏感性测试结果
用本方法对制备的标准模板浓度分别为1×107~100拷贝/L进行检测,结果本方法最低检出100拷贝/L的CSFV和PCV2混合模板,结果见图4。图4中1~8管分别为107~100拷贝/L的CSFV和PCV2混合模板标准品。图4A中1~6管呈绿色,7~8管呈无色。图4B中1~6管呈红色,7~8管呈无色。图4C中1~6管呈黄色,7~8管呈无色。

A.520 nm;B.690 nm;C.520 nm和690 nm;1.PCV2 BH5;2.CSFV石门株;3.对照;4.CSFV C+PCV2 BH5;5.CSFV N+PCV2 BH5;6.CSFV B+PCV2 BH5;7.CSFV L+PCV2 BH5;8.CSFV GXH-2+PCV2 BH5;9.FMDV O型;10.BVDV Orevgon C24V;11.PPV;12.JEV;13.PRRSV CH1R;14.PRV;15.BS2;16.SS2
2.4 干扰性测试结果
将CSFV C和PCV2 BH5标准模板按不同浓度进行组合,制备不同模板浓度的混合样品,用建立的方法进行检测,不同模板浓度的混合样品如下:样品1(107CSFV+100PCV),样品2(106CSFV+101PCV),样品3(105CSFV+103PCV)样品4(104CSFV+104PCV),样品5(103CSFV+105PCV),样品6(101CSFV+106PCV),样品7(100CSFV+107PCV)。结果当两个模板浓度不同时,尤其是一个模板浓度高,另一个模板浓度低时,本方法仍然可鉴别检测到不同的两个模板,即不同的模板浓度对本方法干扰性小,结果见图5。图5A中1~5管呈绿色,6~7管无色。图5B中3~7管红色,1~2管无色。图5C中1~2管绿色,7~8管红色,3~5管黄色。

A.520 nm;B.690 nm;C.520 nm和690 nm;1~8.107~100拷贝/L CSFV和PCV混合模板标准品
A.520 nm;B.690 nm;C.520 nm、690 nm;1.107CSFV+100PCV;2.106CSFV+101PCV;3.105CSFV+103PCV;4.104CSFV+104PCV;5.103CSFV+105PCV;6.101CSFV+106PCV;7.100CSFV+107PCV
2.5 临床样品验证
用建立的二重荧光LAMP对临床样品112份进行检测,结果CSFV阳性的样品41份,检测阳性率36.6%,PCV2阳性样品8份,检测阳性率为7.14%。CSFV和PCV2同时为阳性的样品5份,混合感染率为4.46%,与荧光定量PCR方法检测结果一致。检测的所有阳性样品产物送生物公司测序,测序结果经序列比对分析均为对应病毒。
3 讨论
LAMP核酸扩增方法是在恒温下进行扩增,操作比较简便,成本低廉,被广泛应用于各种疾病的诊断[15-16]。在LAMP的基础上已成功开发出多种颜色的多重LAMP方法,能有效鉴别多种病原体[17]。本研究是在FIP与BIP引物之间设计了一条Taqman 探针,在探针的5′端标记不同的荧光基团,在3′标记有淬灭基因。探针本身并不会发光,当加入LAMP反应中,探针序列结合到模板序列上,随着内外引物特异性结合延伸,迫使与模板结合的探针断裂,荧光基团与淬灭基团断开,荧光基团成为游离基团,这样游离的荧光基团在没有淬灭基团淬灭的情况下发出荧光。本研究采用的FAM荧光基团,在波长520 nm荧光通道下,游离的FAM荧光基团激发绿色,在波长690 nm荧光通道下,游离的CY5.5荧光基团激发红色。本研究通过反应后颜色的不同来区分不同的病毒,并获得成功。
为了获得稳定的最佳的扩增效果,本研究对反应中的引物浓度、探针浓度及反应试剂程序进行了优化。在引物浓度和探针浓度的优化中,发现内引物浓度用量最高,其次为外引物浓度,探针浓度用量最低,它们之间的浓度应用比约为80∶10∶1。在反应程序的优化中,发现最佳反应程序为:退火延伸温度62℃ 90 min,85℃ 5 min结束反应。应用优化后的引物浓度、探针浓度及反应试剂程序,获得了最佳的LAMP扩增效率。
本研究采用Bst3.0 DNA/RNA聚合酶进行二重荧光LAMP扩增,与采用Bst2.0 DNA聚合酶和BstDNA聚合酶大片段的二重荧光LAMP相比,具有更佳的的延伸能力活性、更强的逆转录活性以及强烈的链置换活性。以研究的引物组、Bst3.0 DNA/RNA聚合酶及试剂进行扩增,一次加模板就能完成LAMP扩增,不需要预先对RNA模板单独进行逆转为cDNA,尤其是对DNA和RNA混合模板,特别是含有二级复杂结构的RNA模板检测特别方便,而采用Bst2.0 DNA聚合酶或BstDNA聚合酶大片段进行二重荧光LAMP时则无法对有二级复杂结构的RNA模板进行扩增。
本研究建立的荧光方法,反应结束后直接通过仪器读取或凭肉眼判定反应结果,不需要通过电泳或打开反应盖添加染料,这样极大地降低了LAMP的污染。有条件的实验室,建议在超净工作台中配制试剂,减少空气中的气溶胶对的污染,确保样品检测的准确性。
为了进一步验证建立方法的实用性,用优化后建立的方法对保存的临床样品的进行检测,同时采用比较成熟敏感的荧光定量PCR方法进行对比,结果发现,本研究获得的结果与荧光定量PCR方法获得的结果一致。为了防止假阳性的出现,阳性样品产物经序列测定,分析比对结果全为对应病毒,说明本研究建立的方法准确,适合于临床样品的检测。本研究建立的二重LAMP检测方法,一次反应能同时鉴别CSFV和PCV2,为区分CSFV或PCV2提供了技术支撑。

