基于电子鼻和GC-MS的酶解猕猴桃汁香气成分动态解析
周 元,傅虹飞,胡亚云
(西北农林科技大学 食品科学与工程学院, 陕西 杨凌 712100)
香气是水果果实及其相关制品品质的重要感官指标[1]。猕猴桃属(Actinidia)果实香气品质研究始于1982年[2],目前已从美味(A.deliciosa)、中华(A.chinensis)、软枣(A.arguta)、毛花(A.eriantha)等不同品种猕猴桃果实中鉴别出醇类、酯类、酸类、酮类、萜烯类等香气物质,其中以来源于脂肪酸途径的醛类、酸类和醇类等物质含量较高[3]。毛花猕猴桃香味比较清淡,挥发性物质组成与其他猕猴桃果实存在较大差异,推测其主要以结合态香气前体物质形式存在[4]。而目前的相关研究多关注的是猕猴桃果实成熟过程及采后储藏期游离态挥发性物质的变化[5-6],对于结合态香气前体物质的调控释放报道较少。
果实中结合态香气前体物质作为潜在的香气物质来源,其含量被认为是自由态的10倍[7]。结合态香气前体物质本身无香气且不挥发或难挥发,为使这些潜在香气前体分子发挥功能,就需要解开结合态糖苷键,从而释放出具有挥发性的糖苷配基。糖苷配基主要包括萜烯类化合物、脂肪醇类、芳香烃类衍生物等,可在果实成熟、加工和储藏过程中释放出来,或者经过酶解、酸解和热处理释放出来[8]。β-葡萄糖苷酶则是这些香气分子释放过程酶系中最重要的酶之一[9],是水解芳香物质前体、释放结合态糖苷配基的关键酶[10]。国内外对β-葡萄糖苷酶用于葡萄和葡萄酒芳香物质酶解调控研究较多[11]。郭慧女等[12]比较了黑曲霉、海藻曲霉和鲁氏毛霉来源的β-葡萄糖苷酶对玫瑰香葡萄结合态香气提取物质的酶解作用效果,认为以黑曲霉来源的β-葡萄糖苷酶的酶解效果最佳。桑苇等[13]采用黑曲霉β-葡萄糖苷酶对赤霞珠葡萄新酒进行增香调控,酶解处理后香气物质相对总量与对照相比增加24.59%,其中以4-萜品醇、α-松油醇和香叶醇等为代表的萜烯及C13-降异戊二烯类物质增加最为显著。
我国猕猴桃种植面积和产量均居世界第一[14],猕猴桃深加工技术的发展有益于其产业的进一步提升。β-葡萄糖苷酶是风味修饰中的关键酶,对果蔬制品品质提升具有十分重要的作用,但其对猕猴桃香气的酶解释放作用尚未见深入探讨。本研究利用电子鼻(E-nose)检测β-葡萄糖苷酶对猕猴桃汁香气物质的释放作用,并采用固相微萃取结合气相色谱质谱联用技术(SPME-GC-MS)分析酶解处理对猕猴桃汁香气物质组成和含量的影响,旨在为猕猴桃汁酶解增香技术的研究及应用提供理论依据。
1 材料与方法
1.1 材料与试剂
猕猴桃:2019年购于当地超市,品种为徐香。
化学试剂:β-葡萄糖苷酶(微生物来源),实验室自制;对硝基苯酚、对硝基苯基-β-D-吡喃葡萄糖苷、柠檬酸、磷酸氢二钠、碳酸钠、无水NaCl,均为分析纯,上海国药集团;环己酮(标品级),上海阿拉丁公司。
1.2 仪器与设备
榨汁机(MJ-WJS1221F),美的集团股份有限公司;手持数显水果硬度计(GY-4),艾普公司;电子鼻(PEN3),德国AIRSENSE公司;气相色谱质谱联用仪GCMS-QP2010,日本岛津公司;DB-1MS 色谱柱(60 m×0.25 mm×0.25 μm),美国安捷伦公司;SPME萃取头(30/50 μm DVB/CAR/PDMS),美国Supelco公司。
1.3 试验方法
1.3.1 β-葡萄糖苷酶酶活的确定 参考文献[9]的方法但略有修改。将100 mg酶与5 mL的40 mmol/L对硝基苯基-β-D-吡喃葡萄糖苷溶液和4 mL的1 mol/L柠檬酸-磷酸盐缓冲液(pH 4.0)混合,在40 ℃下孵育30 min,添加2 mL的3 mol/L碳酸钠溶液以终止反应,在405 nm下比色读数,酶活用U/mg表示。
1.3.2 β-葡萄糖苷酶酶解猕猴桃汁的制备 选取无机械损伤且品相良好的猕猴桃果实,测定硬度值。选择硬度为10.0~12.0 N的果实[5],削皮、榨汁、去渣后备用。预试验考察了酶解温度(25,35,45 ℃)、酶解时间(4,8,12 h)及加酶量(4,8,12 U/g)3 个因素,采用电子鼻测定酶解前后猕猴桃汁样品的香气成分,通过分析电子鼻传感器响应值的变化,确定后续酶解试验参数为:酶解温度35 ℃,酶解时间0~8 h,加酶量为8 U/g,进一步考察酶解猕猴桃汁香气物质的动态变化。
1.3.3 电子鼻分析条件 参考文献[15]方法但略有修改。本研究采用的电子鼻传感器阵列(含10个传感器)的特征见表1。取酶解后的猕猴桃汁样品1 g,用双蒸水稀释5倍,每组6个平行。设置电子鼻进气流速为300 mL/min,每秒采集1个数据,分别记录电子鼻10个传感器的响应值,即G/G0值(其中G为最终电阻,G0为初始电阻),当G/G0>2.0,可认为该传感器对待测样品敏感。每个样品的电子鼻采集时间为60 s,清洗时间为300 s。

表1 电子鼻传感器阵列的特征
1.3.4 香气物质的SPME-GC-MS分析 (1)SPME-GC-MS条件。参考文献[4]方法但略有修改。顶空固相微萃取条件:取5.0 g样品放入固相微萃取瓶中,加入2.5 mL饱和氯化钠溶液,10 μL环己酮内标(0.5 mg/mL),45 ℃预热2.5 min,萃取吸附45 min,GC 解析5 min,用于GC-MS 分析。GC 条件:进样口温度250 ℃;色谱柱初始温度40 ℃保持2 min后,以6 ℃/min升至120℃并保持5 min,再以8 ℃/min升至200 ℃并保持2 min,再以10 ℃/min升至250 ℃并保持8 min;载气为高纯氦气,柱流量1.5 mL/min。MS 条件:EI电离源,电子能量70 eV,离子源温度230 ℃,扫描范围30.00~500.00 m/z。
(2)香气物质定性与半定量方法。香气活性成分的定性通过与NIST质谱库中的标准谱图进行检索比对,并根据各物质保留指数(RI)进行确认[16]。半定量分析时,将待测物质峰面积与环己酮内标峰面积进行计算,计算公式为:
Xi=(Ai/As)×Cs。
式中:Xi为待测物质浓度;Ai为待测物质峰面积;As为内标物质峰面积;Cs为内标物质浓度。
1.4 数据分析
采用Origin 8.0软件和Excel软件绘图,采用Minitab 15.0软件进行多重比较分析(P<0.05)。采用SIMCA 14.1软件进行双向偏最小二乘(bidirectional orthogonal partial least squares,O2PLS)分析[17-19],得到O2PLS模型中的投影用于预测变量影响(variable influence on projection for predication,VIPpred)值,其中VIPpred值>1.0的变量被认为是重要的变量。
2 结果与分析
2.1 酶解猕猴桃汁香气物质的电子鼻分析
2.1.1 电子鼻传感器响应值变化 电子鼻模拟人的嗅闻方式获得样品整体信息,从而避免感官评价的主观误差,具有检测结果重复性好等特点[15]。电子鼻常用于识别、表征和分级水果香气在不同种类和品种之间的差异,能够快速、一致地评估复杂的挥发性气体混合物[20]。
电子鼻传感器阵列的10个传感器对酶解过程中猕猴桃汁香气物质的响应值见图1。由图1可知,当猕猴桃汁酶解0~8 h,电子鼻传感器阵列中S1、S3、S4、S5和S9 5个传感器对猕猴桃汁香气物质变化的响应值(G/G0)为1.0~2.0,可知其对猕猴桃汁香气物质的变化不敏感,而传感器S2、S6、S7、S8和S10对猕猴桃汁香气成分的响应值(G/G0)>2.0,表现为对猕猴桃汁香气成分的变化敏感。除S10外,其他传感器的敏感性与文献[21]一致;与文献[21]相比,S9传感器(对芳香类化合物、有机硫化物敏感)在此次分析中对猕猴桃汁香气成分的变化不敏感,这可能与试验原料成熟度相关,提示猕猴桃汁内无挥发性硫化物或未达到检出限。S2、S6、S7、S8和S10的响应值随着酶解时间的增加不断变化,在0~8 h酶解过程中,响应值在酶解6 h达到最高,随后略有下降,提示猕猴桃汁在酶解过程中表现出风味强度的变化,存在萜烯类、烷烃类、氮氧化合物、芳香化合物和醇类等传感器敏感类物质含量的变化,而这些物质含量的动态变化会影响猕猴桃汁整体风味。
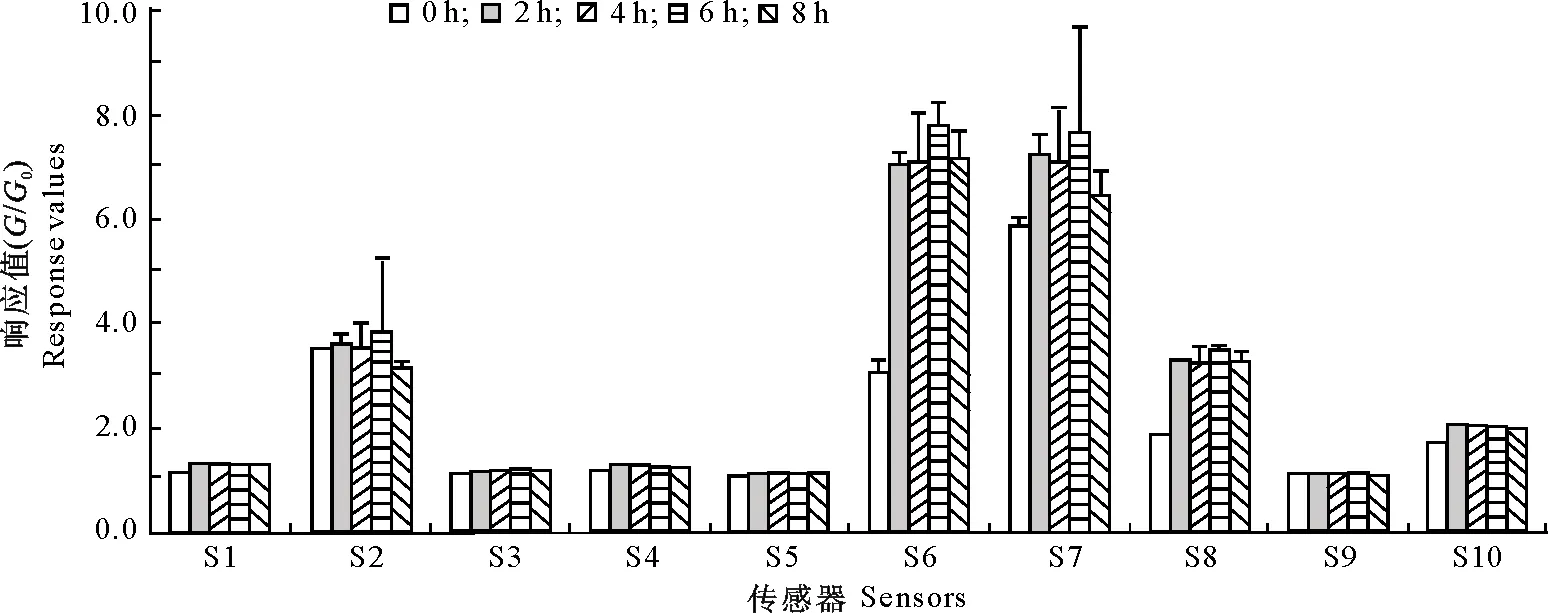
图1 电子鼻传感器对不同酶解时间猕猴桃汁香气物质的响应值
2.1.2 电子鼻传感器响应值变化的主成分分析 主成分分析(principal component analysis,PCA)是一种无监督的数据分析方法,常用于电子鼻检测结果分析,用以说明传感器识别效应和样品间的区分度等[16]。本研究将5个传感器(S7,S6,S2,S8和S10)对酶解0~8 h的猕猴桃汁香气成分的响应值进行PCA分析,其得分图和载荷图如图2所示。
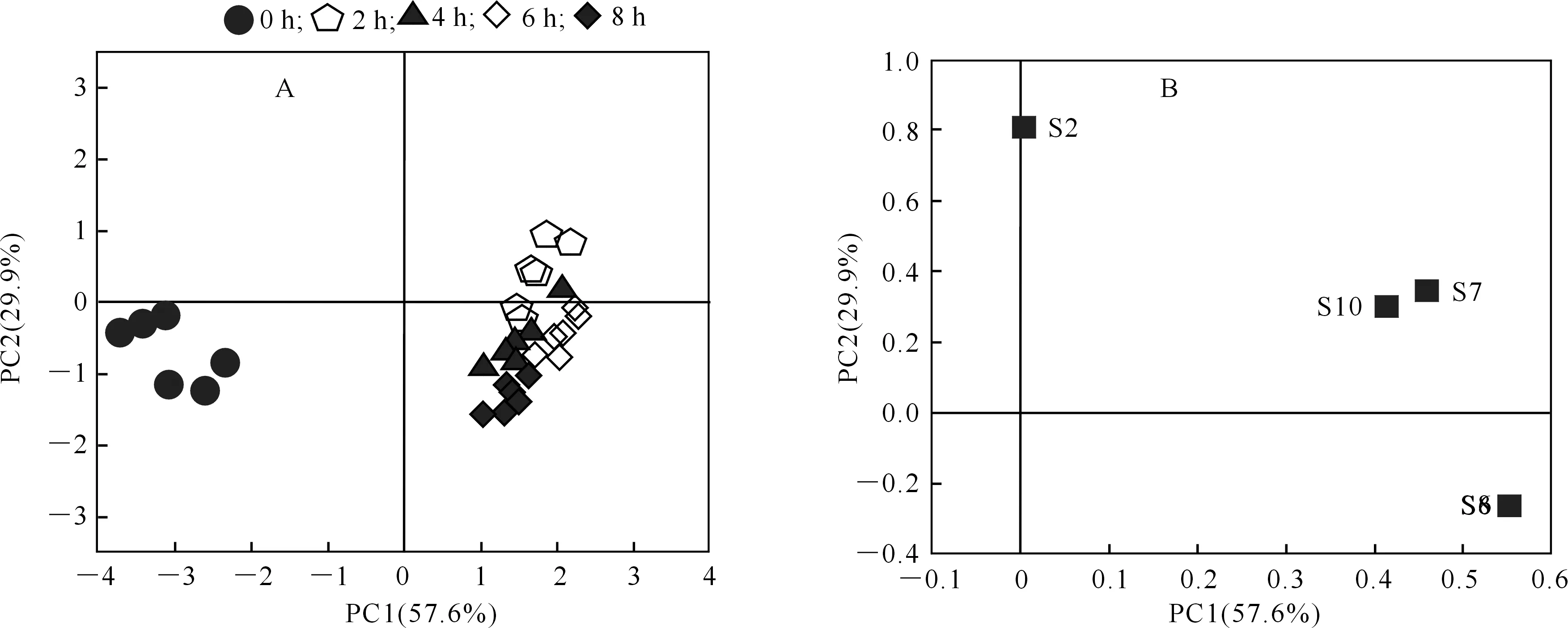
A.得分图;B.载荷图
图2-A表明,PC1贡献率为57.6 %,PC2贡献率为29.9 %,总贡献率为87.5 %,因此这2个主成分可代表样品的主要特征。另外,电子鼻可以很好区分酶解前(0 h)和酶解后(2~8 h)样品,从PC1角度看,酶解后组样本位于正向端,而酶解前组样本位于负向端,表明酶解产生的部分风味物质引起了猕猴桃汁整体风味的变化。对于酶解后组猕猴桃汁来说,酶解2,4,6 h组样本空间距离不大,表明经过酶解,猕猴桃汁风味成分存在一定变化,具体组成还需要进一步检测。图2-B显示,传感器S6和S8发生重合,与其传感器特征值一致,在第1主成分贡献率中占主要部分,S7、S10的贡献率较小。传感器S6和S8在识别和检测酶解猕猴桃汁样品中起着重要作用,说明酶解过程中萜烯类和烷类物质的动态变化对整体风味的变化有重要影响。此外,传感器S2在第2主成分中贡献率最大。上述结果表明,在本研究中电子鼻对猕猴桃汁的挥发性风味物质感应灵敏,能够检测其挥发性风味物质的变化,通过电子鼻的快速检测可以监测猕猴桃汁的酶解进程,控制酶解果汁的品质。
2.2 酶解猕猴桃汁中香气物质的GC-MS分析
依据酶解组样品的电子鼻检测分析结果,本研究采用SPME-GC-MS技术对猕猴桃汁酶解过程中香气成分的动态变化做进一步分析,结果见表2。
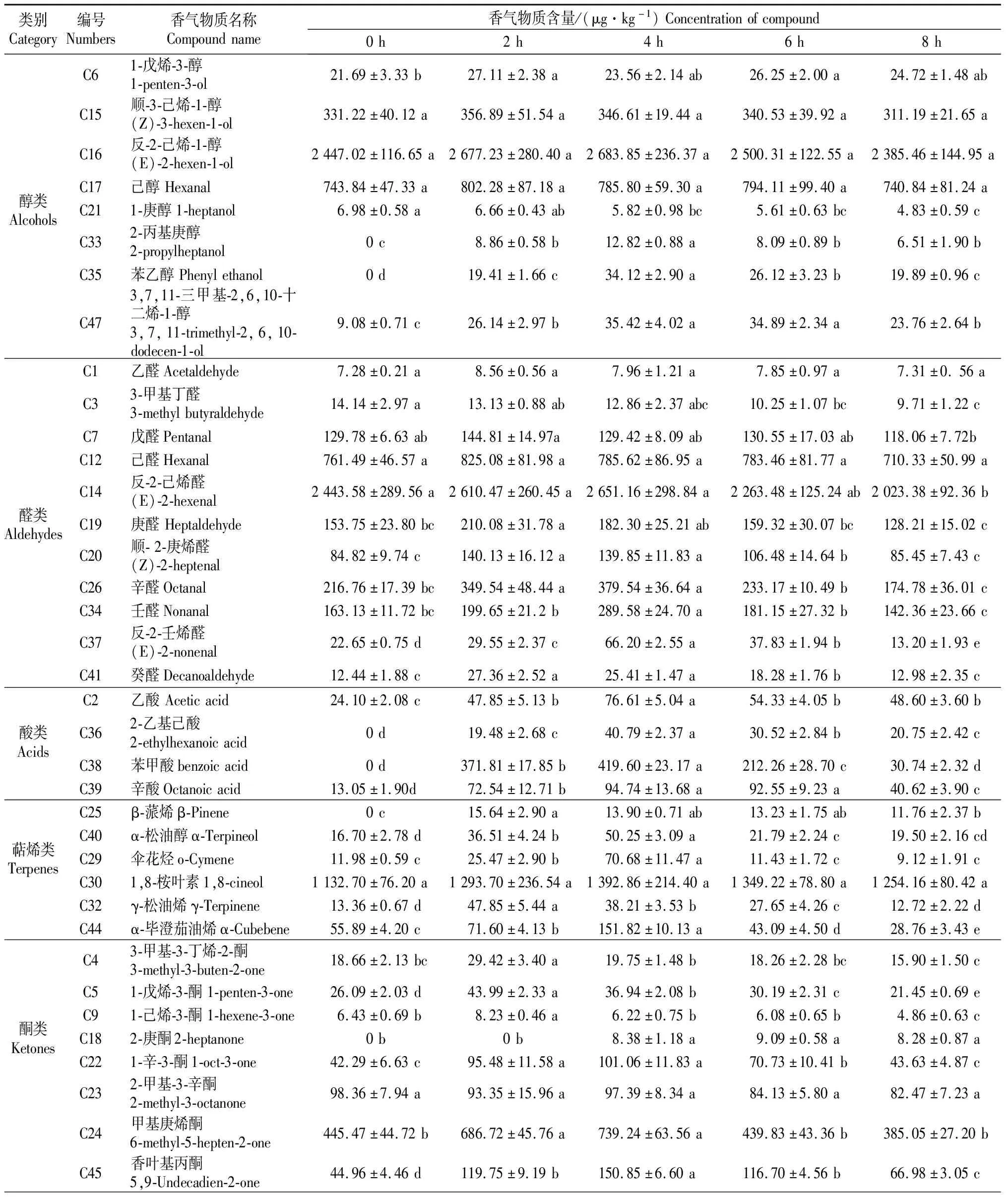
表2 GC-MS解析酶解猕猴桃汁中香气物质的动态变化
由表2可知,酶解增香后,徐香猕猴桃香气成分组成和含量十分丰富,从酶解的猕猴桃汁样品中共分析获得47种物质,包括醇类8种,醛类11种,酸类4种,萜烯类6种,酯类1种,酮类8种,呋喃类2种,烷烃类7种,主要包括顺-3-己烯-1-醇、反-2-己烯-1-醇、己醇、反-2-己烯醛、乙醛、1,8-桉叶素(又名桉叶油醇)和甲基庚烯酮等,上述挥发性化合物因其通常具有较低的感官阈值,可以认为是猕猴桃汁主要香气物质来源[22-23]。进一步分析显示:徐香猕猴桃汁中醛类物质总量为(3 978.23±438.04)μg/kg,醇类为(3 561.47±219.48)μg/kg,萜烯类为(1 326.56±92.75)μg/kg(其中1,8-桉叶素(1 132.7±76.4)μg/kg)。据文献[3]报道1,8-桉叶素在海沃德猕猴桃果实中未测得,黄金果猕猴桃果实中为30.1 μg/kg。此外,赵宁等[16]研究表明,徐香猕猴酒中1,8-桉叶素含量为(122.67±3.76)μg/L,显著高于黄金果猕猴桃酒((67.26±2.77)μg/L)和海沃德猕猴桃酒((2.40±0.39)μg/L)。与0 h相比,酶解处理4 h后,猕猴桃汁香气物质总量增加20.53%,其中酸类化合物含量增加1 523.10%,呋喃类化合物含量增加441.60%,酮类化合物含量增加23.84%,萜烯类化合物含量增加22.26%,烷烃类化合物增加20.75%,醇类化合物含量增加10.28%,醛类化合物含量增加6.71%。
Garcia等[24]采用柱层析纯化软枣猕猴桃糖苷键合态前体物质,用rapidase酶水解的方式进行结合态物质释放,认为糖苷键结合态前体物质经酶解后释放了呋喃醇(2,5-二甲基-4-羟基-3(2H)-呋喃酮)、反-2-己烯醛、己醛、1-辛烯-3-醇和苯甲酸等挥发性物质。随后采用相同方法对海沃德猕猴桃和黄金果猕猴桃进行了分析,结果表明,海沃德猕猴桃中的主要结合态挥发性化合物为苯甲醛、反-2-己烯醛、己醛、3-辛醇和2-甲基丁醛等,黄金果猕猴桃中则以呋喃醇(2,5-二甲基-4-羟基-3(2H)-呋喃酮)、苯乙醇、3-羟基-β-大马酮、己醛和顺-3-己烯-1-醇等为主[25]。与上述报道的其他品种猕猴桃经酶解释放的挥发性物质相比,本研究中徐香猕猴桃的挥发性化合物以反-2-己烯醛、己醛、顺-3-己烯-1-醇、反-2-己烯-1-醇、己醇等含量较高,与酶解前(0 h)相比较,酶解4 h上述物质分别增加了6.83%,3.17%,4.64%,10.71%和5.64%。此外,与酶解前(0 h)相比,经过4 h酶解后,猕猴桃汁挥发性物质中有30种物质含量显著增加(P<0.05),主要包括2-丙基庚醇、苯乙醇、2-乙基己酸、苯甲酸、β-蒎烯、2-庚酮、反-2-(2-戊烯基)呋喃等。在本研究中,仅得到一种酯类物质,即反-2-己烯醇乙酸酯,可能与此次研究中选用猕猴桃硬果作为原料有关,其含量在酶解后显著增加,推测与反-2-己烯醇及乙酸在酶解过程中含量增加有关。
萜烯类化合物呈现特殊的香气,是水果特征香气的主要贡献物质之一。萜烯类化合物多以无味的糖苷态形式存在,外源添加糖苷酶则是释放游离态萜烯化合物的有效方法[13]。由表2可知,徐香猕猴桃汁经过酶解后,相对含量增加最多的萜烯类化合物是β-蒎烯,在酶解过程从无到有;其次是伞花烃,其相对含量增加489.98%;另外,α-松油醇、γ-松油烯、α-毕澄茄油烯和1,8-桉叶素的相对含量也分别增加了200.89%,186.00%,171.64%和22.97%,其中1,8-桉叶素能够释放浓郁的薄荷香气。由以上结果可知,β-葡萄糖苷酶可以有效地酶解结合态前体物质,促使挥发性小分子释放,对提高猕猴桃汁中典型性香气具有积极影响。
与GC-MS分析方法相比,电子鼻技术具有分析速度快、灵敏度高和检测费用低等优点[18],但其无法对具体物质组成变化做出预测,GC-MS可以对物质组成进行分析,但耗时较长,对仪器要求高。将GC-MS测得的香气物质(X)与电子鼻传感器响应值(Y)进行O2PLS建模(2+1+1),结果如表3所示。由表3可知,模型中的累计R2Y和累计Q2分别为0.995(≈1.0)和0.762(> 0.5),表明O2PLS拟合效果较好[17],这说明猕猴桃汁中挥发性物质的动态变化与电子鼻响应值的变化之间存在较好的对应关系。
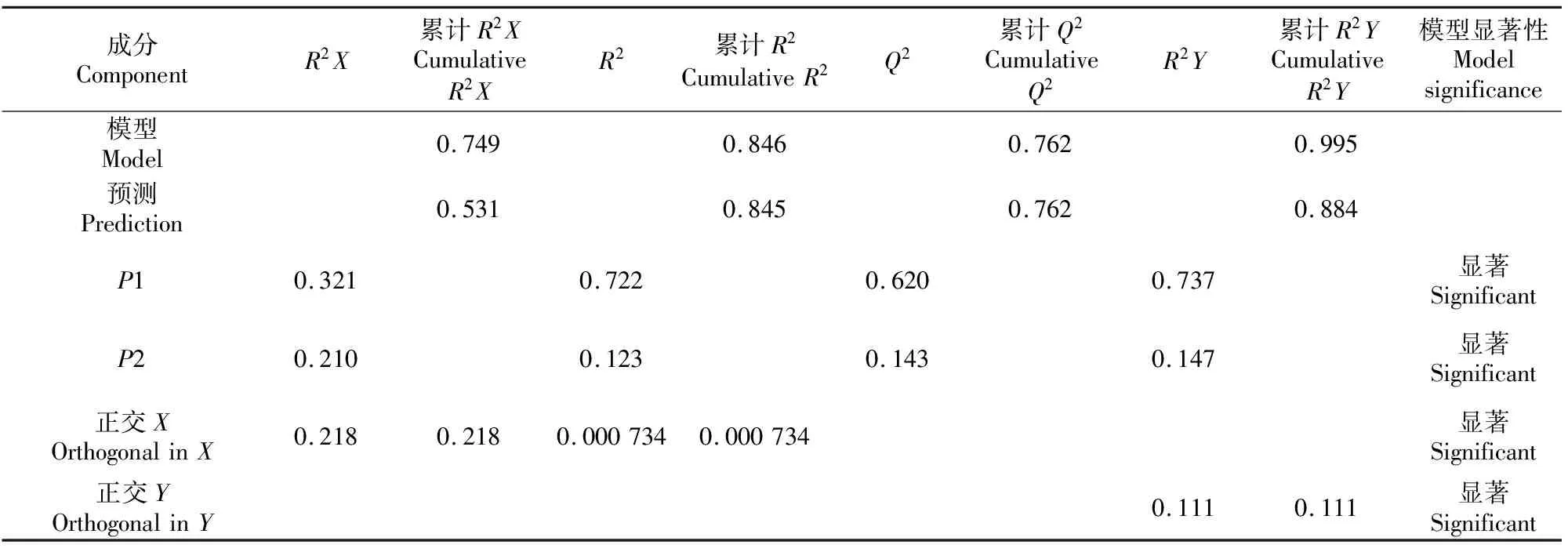
表3 GC-MS测定的香气物质(X)与电子鼻传感器响应值(Y)的O2PLS模型
图3表明,由O2PLS模型得到的47种挥发性物质的VIPpred值为0.34~1.44,其中有25种物质的VIPpred>1.0,表明这些香气物质的变化对电子鼻传感器响应值的变化贡献较大,具体分别为β-蒎烯(C25)、反-2-己烯醇乙酯(C28)、反-2-(2-戊烯基)呋喃(C27)、反-2-癸烯(C43)、2-乙基呋喃(C8)、3,7,11-三甲基-2,6,10-十二烯-1-醇(C47)、γ-松油烯(C32)、辛酸(C39)、2-丙基庚醇(C33)、苯乙醇(C35)、癸醛(C41)、香叶基丙酮(C45)、1-戊烯-3-酮(C5)、苯甲酸(C38)、十四烷(C46)、2-乙基己酸(C36)、3-甲基-3-丁烯-2-酮(C4)、1-辛-3-酮(C22)、2-庚酮(C18)、2,5,5-三甲基-1,6-七烯(C31)、乙酸(C2)、1-己烯-3-酮(C9)、3-甲基-2-己烯(C11)、顺-2-庚醛(C20)和1-戊烯-3-醇(C6)。
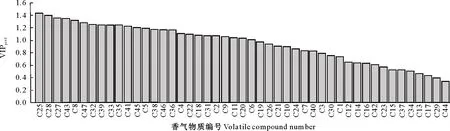
图3 GC-MS测定的香气物质(X)与电子鼻传感器响应值(Y)的O2PLS模型的VIPpred值
3 结 论
猕猴桃汁酶解过程中香气的动态变化可以采用电子鼻进行监测,其香气成分的电子鼻响应值变化主要体现在S2、S6、S7、S8和S10这5个传感器上。猕猴桃汁香气成分经电子鼻传感器检测的强度值随酶解时间增加,酶解6 h达到最高后略有下降。SPME-GC-MS分析结果表明,经酶解处理后,猕猴桃汁香气成分中有30种发生了显著性增加(P<0.05),其中顺-3-己烯-1-醇、反-2-己烯-1-醇、1,8-桉叶素、戊醛、己醛、反-2-己烯醛、庚醛、顺-2-庚烯醛、辛醛、壬醛、癸醛、2-庚酮和甲基庚烯酮是主要的香气物质。与未酶解猕猴桃汁相比,酶解处理4 h猕猴桃汁的挥发性物质总量增加20.53%。因此,酶解处理能作用于猕猴桃汁香气前体物质,释放挥发性香气物质,提高猕猴桃汁香气物质总量,该结果可为酶解猕猴桃汁香气品质控制提供理论依据。

