掺钐钛酸铋铁电纳米颗粒的制备与光学性能表征
邓永菊,勾 翰,鲁斌滔,李志琴,杜欣宇,唐 玉,祁红艳
(湖北第二师范学院 a.物理与机电工程学院;b.湖北省环境净化材料工程技术研究中心,武汉 430205)
1 引言
Bi4Ti3O12(BTO)作为典型的层状钙钛矿结构的铁电材料,具有优良的压电、铁电、热释电、电光等性能,其居里温度高达675℃,同时还具有较高的耐击穿强度和相对高的介电常数,可广泛用于动态存储器、铁电随机存储器、铁电场效应管等[1]。
由于纳米技术逐渐趋于成熟[2],以及其在材料合成的过程中表现出的优良的量子尺寸效应、小尺寸效应、表面效应等奇异的物理和化学现象,人们不断地探究在纳米技术合成条件下的材料所具有的铁电、光学性能等。
经过十多年的发展,纳米材料取得了重大的突破,使纳米材料走向器件微型化,虽然在纳米线(棒)[3]、纳米管、纳米带、芯壳结构纳米线及其组装体系等方面的纳米材料和纳米结构取得取得了重大的成就,但相对于现在对纳米材料的需求还是远远不够的。目前,铁电材料的研究主要集中在比较大型的器件上,例如薄膜、陶瓷,但是关于材料的微观结构,如纳米结构的合成研究仍然处于初级阶段。所以对具有几何规则外形关系的铁电纳米材料的结构研究还是具有重大意义的。
掺稀土元素Sm的BTO单晶纳米结构的合成及其铁电、光学性能的研究报道较少。在这一空白的领域,合成与表征Bi0.56Sm1.44Ti2O7(BSmT)纳米结构,研究其光学性能,不仅能丰富和完善纳米科学的研究体系,还将为制备性能优异的铁电纳米材料及其相关器件提供可靠的理论依据和实验数据。
制备纳米材料的方法很多,其中气相法、固相法和液相法最为常用。由于水热法合成温度低[4],工艺简单,本文通过改变反应时间,用水热法在碱性介质中合成多组BSmT单晶纳米结构,研究纳米结构的形貌、尺寸和性能,并探讨纳米结构的生长机制[5]。
2 实验
按摩尔比Bi ∶Sm ∶Ti=3.15 ∶0.85 ∶3称取一定量的Bi(NO3)35H2O、Sm2O3和Ti(C4H9O)4溶解于乙二醇甲醚中,将混合溶液搅拌均匀;加入一定浓度氢氧化钠溶液,调节溶液的pH值,将混合溶液倒入聚四氟乙烯内衬中,并用高压釜定容至80%后密封;将高压釜置于真空干燥箱中,在180 ℃下分别反应6 h、12 h和24 h,关掉干燥箱自然冷却至室温;用真空泵过滤产物,依次用蒸馏水和无水乙醇洗涤产物3次,至过滤液呈中性;将得到产物移至真空干燥箱中,温度设定为80 ℃恒温干燥8 h,将颗粒研磨10分钟得到最终纳米材料。
用日本岛津的XRD-6100型高分辨X射线衍射仪(CuKα,λ=0.15406 nm)对制备的样品进行物相分析,衍射角范围10°~70°,扫描速度0.02°/s。用日本精工SAP400原子力显微镜观察纳米结构的表面形貌。用日本电子JSM-6700型扫描电镜(SEM)测试样品的微观结构。用日本岛津公司生产的UV-2600型紫外-可见吸收光谱仪研究产物的紫外-可见光吸收性能。武汉光驰公司提供的GCSAP-B光谱学系统测试产物的拉曼光谱。
3 结果与分析
3.1 XRD分析
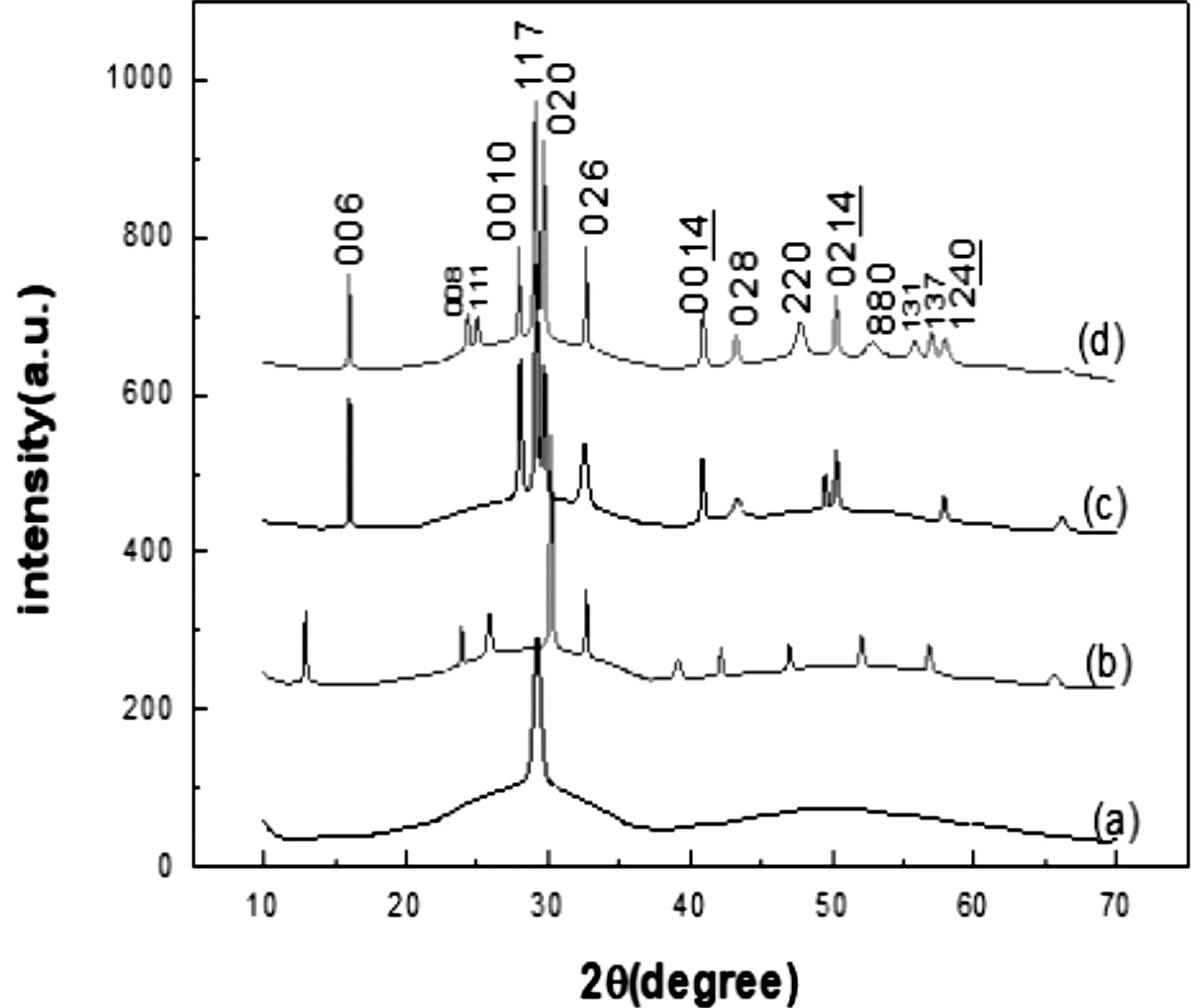
图1 (a) 纯BTO纳米结构反应12 h的XRD图谱,BSmT纳米结构反应(b)6 h、(c) 12 h和(d) 24 h的XRD图谱
图1是纯BTO纳米结构反应12 h和BSmT纳米结构在不同反应时间下的X射线衍射(XRD)图谱。通过与伪正交层状钙钛矿型Bi4Ti3O12标准衍射卡(JCPDS No.36-1484)对比,所制备的BSmT纳米结构为纯相。通过观察图谱可以看出随反应时间的增加,衍射峰的数量增加,这是由于随反应时间的增加,晶格畸变加剧,部分晶面呈现多样性,当被X射线照射在图谱中形成新的衍射峰。从图中还可以看出随反应时间的延长,衍射峰的相对强度增强,这是由于晶体的结晶度增大,颗粒体积增大导致的。
3.2 显微结构分析

图2 不同反应时间下水热合成BSmT纳米结构的AFM图(a)6 h、(b) 12 h和(c) 24 h
图2示出不同反应时间下BSmT纳米结构的原子力显微(AFM)图。从图中看出,随着反应时间的增加,纳米颗粒出现团聚并且逐渐加重,粒径逐渐增大,这与X射线衍射结果一致。由AFM图谱可得,反应12h、24h径粒尺寸分别为50~80 nm和100~160 nm,可以得出BSmT纳米颗粒的尺寸随反应时间的增加而增大。
图3所示为水热反应6h、12h和24h下BSmT纳米结构的SEM图。由扫描电子显微镜观察可看出反应在6h粒径分布约为7~14 nm,此时的BSmT纳米颗粒晶粒最为清晰,分布最为规整,同时团聚现象也最轻,反应12 h粒径分布约为20~30 nm,大部分纳米颗粒已经团聚,反应24 h粒径分布范围约为28~50 nm,团聚现象加重,这些现象说明随着反应时间的延长,纳米颗粒的粒径增加,团聚更加明显,这是由于纳米颗粒径粒的增大,使晶面间距减小,从而相邻面网间的引力就增大,团聚加重。

图3 不同反应时间下BSmT纳米结构的SEM图(a)6 h、(b) 12 h和(c) 24 h
3.3 BSmT纳米结构的光学分析
(1)Uv-Vis吸收光谱
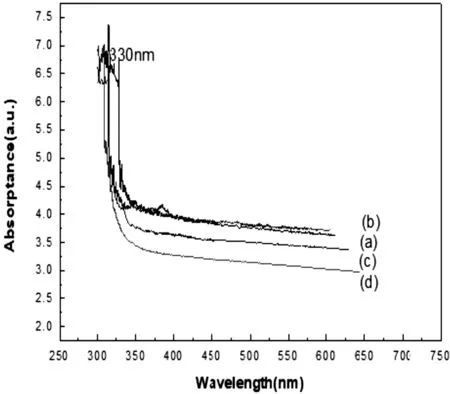
图4 (a)纯BTO纳米结构反应12 h的Uv-Vis光谱,BSmT纳米结构反应(b) 6 h、(c)12 h和(d) 24 h的Uv-Vis光谱
所制备样品的紫外可见吸收光谱如图4所示,(a)为纯BTO纳米结构反应12h的Uv-Vis光谱,(b)、(c)和(d)分别为BSmT纳米结构反应6h、12h和24h的Uv-Vis光谱。从图中可看出每种粉末在300~330 nm波长范围有明显的吸收,这是Bi4Ti3O12纳米结构的对可见光的吸收所致。Bi4Ti3O12纳米颗粒在350~600 nm吸收率平稳下降,无任何特征峰。随着反应时间的增加,谱线下移,吸收率降低,这是由于BSmT纳米材料的尺寸变化所致。纯BTO纳米结构反应12h(a)、BSmT纳米结构反应6h(b)、12h(c)和24h(d)的(Ahv)2与hv关系如图5所示,根据下面的Tauc关系可得出吸收系数与能隙的关系[6]:
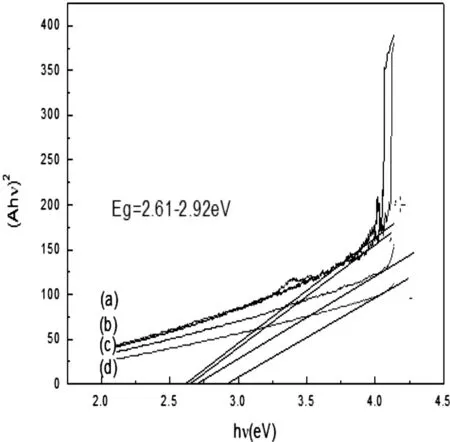
图5 BTO纳米结构反应12 h(a)、BSmT纳米结构反应6 h(b)、12 h(c)和24 h(d)的(Ahv)2与hv关系
αhυ=C(hυ-Eg)n
这里Eg是能隙,C是一常数,n是由电子跃迁决定的吸收级数。当n=1/2时,是直接光子跃迁;当n=2时,是间接光子跃迁。BSmT是直接能隙半导体,因而n=1/2。因吸收(A)与吸收率(α)成正比[7],用A代替α,得到(Ahυ)2与hυ关系,取Ah=0,拟合可得Eg的值。图5的曲线显示在不同的反应时间下吸收边处(αhυ)2与hυ有较好的线性关系,拟合可得反应时间为6 h、12 h和24 h的BSmT纳米颗粒的光学能隙Eg分别为2.61 eV、2.74 eV和2.92 eV,这比我们所制备的掺钕BTO微米球的光学带隙(3.33 eV)小[8],这可能是由于纳米颗粒的晶粒尺寸比微米片小所致。
(2)拉曼光谱

图6 不同反应时间BSmT纳米结构的拉曼光谱
拉曼光谱分析法是对和入射光频率不同的散射光谱进行分析,得到分子结构相关信息的一种方法。由分子振动、固体中光学声子等激发与激光相互作用产生的非弹性散射称为拉曼散射[9]。
如图6所示,横坐标是波数差,纵坐标是散射光的强度。从图6可看出,随反应时间的不同,散射光的强度也不同,且散射光的强度随反应时间的增加逐渐增强,而在400 cm-1、600 cm-1和1400 cm-1处有较明显的峰出现。400 cm-1处的拉曼峰是由Ti-O八面体的扭曲所致,600 cm-1处的拉曼峰是氧八面体的伸缩振动和弯曲振动的共同作用。而1400 cm-1拉曼峰则是由于位于氧八面体顶点的氧原子反向偏移造成的[10]。
3.4 生长机制分析
水热反应前,在配制好的混合溶液中加入少量碱溶液,混合溶液中出现浑浊沉淀物,这种沉淀物是不定形的蓬松絮状物,由混合溶液中一系列的物质经过缩聚和水解形成。当向溶液中滴加适量的烧溶液,其中碱的OH-会在溶液中形成“沉淀核”,这种“沉淀核”会使周围的离子向它靠拢发生聚合现象,且随着时间的延长聚合物逐渐增大。这种聚合物会受周围温度压强的影响,在一般的常温常压下,聚合物的溶解度非常小,但在高温高压条件下,聚合物的溶解度会显著增加,溶解进入水溶液中,使溶液中离子浓度增大,出现浓度不一的结晶相,溶解度低的结晶相当趋进饱和状态,就会从溶液中析出[11]。
在水热反应初始,Sm、Bi和Ti元素以无定形沉淀物的形式平均分散在碱溶液中,随着温度升高,无定形沉淀物逐渐溶解,向“沉淀核”移动形成三者相互聚集而成的团聚体,以降低本身的自由表面能。随反应时间的增加,经过不断的溶解,最终形成了表面自由能更低的BSmT晶核。由于刚开始形成的一部分细小的晶粒在溶液中不稳定,会再次溶解到溶液中,由于无定形沉淀物的不断溶解,就会使溶液中的Ti4+、Bi3+、Sm3+、OH-离子团和非桥接结构的OH-基团大量存在,从而阻碍还没有完全溶解的小晶粒溶解,使小晶粒不断增大形成颗粒较大的BSmT晶核,同时还改善了BSmT的结晶性能和粒径分布[12]。
4 结论
用水热反应法在不同反应时间下合成了BSmT纳米结构,并对这些纳米结构进行了显微结构分析和光学性能研究。随水热反应时间的延长,BSmT纳米颗粒的团聚程度逐渐加重,反应6 h、12 h和24 h纳米颗粒的粒径分布范围分别为7~14 nm、20~30 nm和28~50 nm。UV-Vis吸收光谱显示纳米颗粒在波长范围为300~330 nm有明显的吸收。拟合得到反应时间为6 h、12 h和24 h的BSmT纳米颗粒的光学能隙Eg分别为2.61 eV、2.74 eV和2.92 eV。拉曼光谱分析得到在400 cm-1、600 cm-1和1400 cm-1模式均有明显的峰出现,400 cm-1模式源于Ti-O八面体的扭曲,600 cm-1模式是伸缩振动和弯曲振动共同作用的结果,1400 cm-1的Raman模式是氧八面体中位于顶点的氧原子反向偏移造成的。

