多功能地衣真菌的筛选及其复合菌剂的研制
吴晓华,张晓坤,曲玉森,张耀昆,司红丽
(山东师范大学生命科学学院,山东 济南 250014)
随着时代的发展,微生物肥料已成为新型生物肥料发展的重要方向之一,在提高土壤肥力、改善农产品质量、低碳环保、维持生物多样性、可自行增殖等方面有显著优势[1]。但目前微生物肥料使用总量仍然偏小,且市场上使用的菌种性状不好,选育投入少,达不到大面积推广的要求[2]。因此,加强对微生物肥料的研制及促进植物生长机理方面的研究就显得尤为重要。
近年来,地衣作为一种重要的生物资源,其内生真菌的潜在药物价值及重要生物活性资源价值被不断挖掘[3-4]。利用真菌生物修复技术来改善土壤品质的研究取得很多成果[5],对地衣资源的有效开发和利用显得尤为重要。纤维素作为一类重要的可再生资源,对纤维素的广泛利用将有效缓解粮食的不足、垃圾处理、工业燃料资源短缺等一系列问题[6]。土壤是植物所需磷素的主要来源,但土壤中大部分的磷元素不可转移,不能被植物直接吸收利用,难以满足植物生长需要[7]。地衣真菌具有与地衣相同或相似的次生代谢产物,这些产物大多具有一定的抗菌活性,从地衣真菌中筛选出抑菌菌株,通过抑菌实验研究其对植物病原菌的抑菌效果,为微生物肥料的进一步开发应用提供理论基础。如今报道的功能真菌在生物活性上明显高于细菌[8],但真菌的数量及其种类要远小于细菌[9],因此,对功能真菌的筛选和研究具有更重要的意义。
本研究以实验室已分离纯化的120株地衣真菌为实验材料,筛选出具有高效降解纤维素、溶解无机磷、抑制病原菌的菌株,以不同的菌株组合研制微生物菌剂,探究其在黄瓜苗生长中的促生作用,最终筛选出具有较高应用价值的复合菌剂,以期为微生物肥料产业链的发展奠定基础。
1 材料与方法
1.1 材料
1.1.1 实验样品
地衣真菌:山东师范大学微生物实验室保存的120株地衣真菌。
供试病原菌:尖孢镰刀菌(Fusarium oxysporum),花生茎点霉(Phoma arachidicola),苹果轮纹菌(Botryospuaeria berengeriana)。
1.1.2 仪器
DL-CL-2N超净工作台(哈尔滨),LDZX-75KBS立式压力蒸汽灭菌锅(上海),V-5100可见分光光度计(上海),PL 303电子天平(上海),全自动新型生化培养箱(上海),WH-1微型旋涡混合仪(上海),DYY-6C电泳仪(北京),ZWY-2102C恒温培养振荡器(上海),BG 32干式恒温器(杭州)。
1.1.3 培养基及试剂
刚果红培养基:K2HPO40.50 g,MgSO4·7H2O 0.25 g,CMC-Na 1.88 g,刚果红0.20 g,明胶2.00 g,琼脂20.00 g,蒸馏水1000 mL。PKO培养基:NaCl 0.30 g,MgSO40.30 g,KCl 0.30 g,(NH4)2SO40.50 g,FeSO40.03 g,MnSO4·4H2O 0.03 g,Ca3(PO4)25.00 g,葡萄糖10.00 g,琼脂20.00 g,蒸馏水1000 mL,pH 7.0~7.5。NBRIP培养基:葡萄糖10.00 g,(NH4)2SO40.50 g,NaCl 0.30 g,KCl 0.30 g,MgSO4·7H2O 0.30 g,FeSO4·7H2O 0.03 g,MnSO40.03 g,Ca3(PO4)25.00 g,蒸 馏 水1000 mL,pH 7.0~7.5。发酵培养基:CMC-Na 2.00 g,KH2PO40.20 g,(NH4)2SO41.40 g,蒸馏水1000 mL。载体为泥炭∶木炭∶花土(2∶2∶1),每袋载体分别装250 g,连续灭菌2次(121℃,30 min)。
1.2 方法
1.2.1 降解纤维素、溶解无机磷真菌的初筛
以点接的方式将120株地衣真菌菌株分别接种到刚果红培养基和PKO培养基上,在25℃恒温培养箱中培养3~4 d,观察结果。根据水解圈直径与菌落直径的比值(D/d)大小初步确定该菌株降解纤维素能力和溶磷能力的强弱,筛选出比值较大的菌株作为后期复筛的菌株。
1.2.2 降解纤维素、溶解无机磷真菌的复筛
绘制标准工作曲线:配制葡萄糖标准液,以DNS法[10]测定还原糖含量。以吸光度值为横坐标,葡萄糖含量(mg/mL)为纵坐标,绘制葡萄糖标准曲线。使用已配置好的磷标准液,测定吸光值绘制磷标准溶液曲线,具体操作参见文献[11]。
功能活性的测定:菌株液体培养发酵得到粗酶液。采用滤纸酶活测定法[12],测定降解纤维素真菌的滤纸酶活力;采用钼锑抗比色法[13]测定溶磷真菌的酶活力;用紫外可见分光光度计测定吸光值,由吸光值在标准曲线中找到对应的葡萄糖和磷含量,根据公式计算出酶活力。
1.2.3 抗病原菌真菌的筛选
采用平板对峙法测定抑菌活性[14]。将前期初筛获得的溶解无机磷、降解纤维素的地衣真菌发酵液采用打孔法接在PDA平板中央,四周接上少量供试病原菌尖孢镰刀菌、花生茎点霉、苹果轮纹菌。设置空白对照,每个真菌做3个重复。25℃恒温培养3~4 d,观察病原菌生长状况。
1.2.4 确定最佳组合
挑选高效降解纤维素菌株、溶磷菌株、抑菌菌株,结合菌株生长曲线[15]确定菌种比例,进行滤纸崩解实验[16],筛选最佳降解纤维素组合,采用钼锑抗比色法筛选最佳溶磷组合。
1.2.5 菌株鉴定
将复筛的功能性菌株分别接种于PDA培养基以插片培养法[17]培养,观察菌落形态。挑取玻片显微观察,观察菌丝和孢子等结构特点。以改良CTAB法[18]提取供试真菌DNA。利用真菌通用引物ITS1(5’-TCCGTAGGTGAACCTGCGG-3’)和ITS4(5’-TCCTCCGCTTATTGATATGC-3’)扩增菌株的ITS rDNA序列,扩增产物由生工生物工程(上海)股份有限公司测序,将测定的序列在GenBank中进行BLAST相似性比对(Available at:http://blast.ncbi.nlm.nih.gov/Blast.cgi)并进行系统发育分析,鉴定种属。
1.2.6 地衣真菌多功能复合菌剂的研制
将筛选出的优秀组合菌株按比例混合制成复合菌种孢子悬液,在分光光度计上测定波长600 nm下的吸光度值,并使用无菌水调节孢子悬液浓度为108CFU/mL(OD≥0.5)。以泥炭∶木炭∶花土(2∶2∶1)作为菌肥载体,每份250 g分装至保鲜袋,于灭菌锅中连续灭菌2次(121℃,30 min)。量取复合菌悬液50 mL与菌肥载体完全混匀。混匀后袋口密封,用无菌牙签在袋子两侧扎3~5个孔,外套一保鲜袋,口密封,放置于25℃培养箱中培养7 d左右。不定时查看载体湿度,确保载体松散不结块,如混匀后载体较干燥可补加25 mL无菌水确保载体的湿度,便于菌株定殖。制成后以载体湿度适宜、菌种活性较高、安全性好、对植物促生作用明显作为指标。
1.2.7 复合菌剂对黄瓜苗生长的影响
选择种子饱满且大小一致的黄瓜种子,用1%的NaClO灭菌10 min左右,种植于一次性塑料盆(规格:外径9.5 cm×内径8.5 cm×高12 cm)中,每盆中装有100 g灭菌的沙子,每盆中种植黄瓜种子3粒。施加菌剂的黄瓜苗作为实验组,不施加菌剂的作为空白对照组,每组重复3盆;实验组中每盆添加250 g载体,内含有50 mL菌剂,对照组中每盆添加250 g灭菌沙子。每2 d浇200 mL无菌水。待植物生长到适宜高度后,同步测定黄瓜苗的茎长、根长、湿重、干重等各项生长指标。
1.2.8 数据计算与分析
采用SPSS 22.0进行统计分析和作图(实验数据均以平均值或平均值加标准误表示)。
2 结果与分析
2.1 功能性真菌的初筛
以点接的方式将120株地衣真菌菌株分别接种到刚果红培养基和PKO培养基上,25℃恒温培养箱中培养3~4 d后,部分真菌出现了水解圈(图1),测得的各菌株溶解结果见表1。在降解纤维素真菌中,菌株1915-2水解圈比值最大,为1.86,菌株1915-2、1913-1、1909-7、1908-3、1915-1、1913-6、1909-3、1912-6、1905-2、1913-2水解圈比值均大于1.30,因此选择这10株地衣真菌作为复筛解纤维素的菌株。溶磷真菌中菌株1905-6溶磷圈比值最大,为1.71,菌株1905-6、1901-5、1905-4、1909-3溶磷圈比值均大于1.45,因此选择这4株地衣真菌作为复筛溶磷菌株。
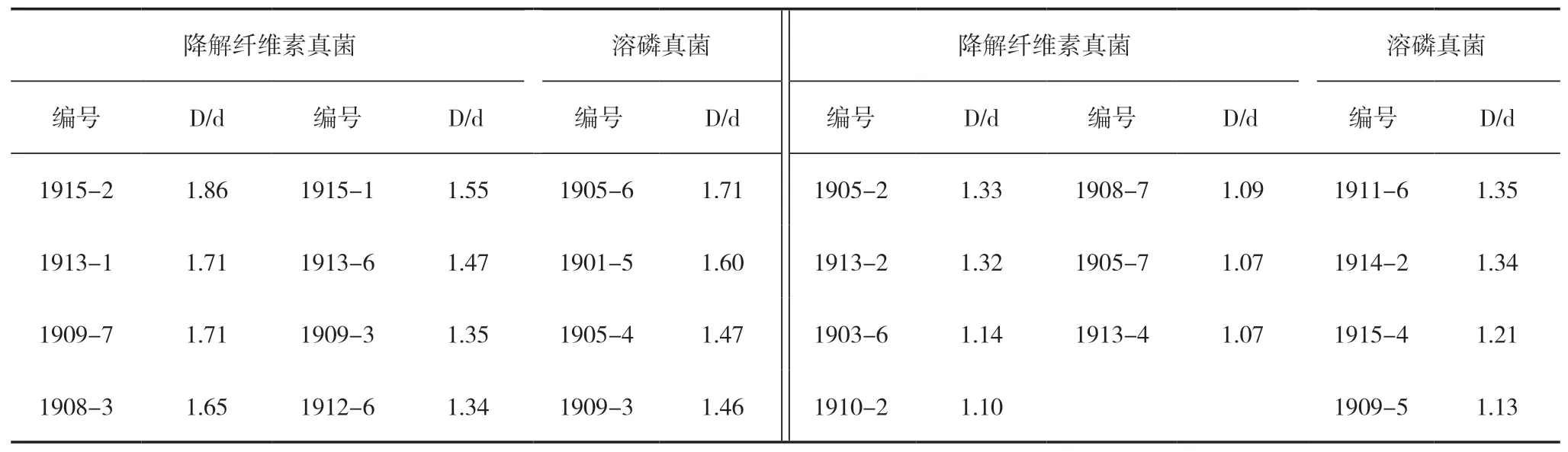
表1 地衣真菌降解纤维素和溶磷的水解圈结果
2.2 功能性真菌的复筛
初筛获得的菌株进行发酵产酶培养,以DNS法测定降解纤维素的滤纸酶活力,以钼锑抗比色法测定溶磷菌株酶活力,数据统计见图2、图3、图4。
如图2和图3所示,在产孢子真菌中,菌株1909-7降解纤维素能力最强,最大酶活力为1450 U/mL,菌株1913-6降解能力次之,为1070 U/mL,菌株1909-7和1913-6的最大酶活力均高于其他菌株最大酶活力500~700 U/mL;不产孢子真菌中,菌株1915-2降解纤维素能力最强,最大酶活力为1462 U/mL;菌株1905-2能力次之,为406.6 U/mL;菌株1915-2和1905-2的最大酶活力均高于其他菌株最大酶活力230~380 U/mL。因此选择菌株1909-7、1913-6、1915-2、1905-2为复筛后最终确定的菌株。
由图4可知,菌株1905-4溶解效果最强,溶液中磷酸根浓度可达到1387.20 mg/L;总体上,在0~96 h内,溶磷菌的溶磷能力是随着时间的变化而增大,在培养96 h后,由于培养液营养成分的消耗而基本保持稳定。因此,本研究选择菌株1905-4作为复筛后最终确定的菌株。
2.3 抗病原菌真菌的筛选
将前期初筛获得的溶解无机磷、降解纤维素的内生真菌取发酵液接在PDA平板,以平板对峙法测定初筛菌株的抑菌活性,测定结果见表2。在进行抑菌活性测定的所有菌株中,约24%的功能性地衣真菌对病原菌有较为明显的拮抗作用,尤其是对尖孢镰刀菌的抑菌效果。其中菌株1905-2对苹果轮纹菌的抑制效果最明显,在PDA平板中产生了较为明显的抑菌圈,且病原菌菌丝生长到一定程度时停止生长;菌株1915-2对尖孢镰刀菌、花生茎点霉、苹果轮纹菌都有抑制效果,因此对病原菌具有广谱性和较好的抑制性;菌株1905-4在抑制尖孢镰刀菌上效果最显著。因此本研究选用菌株1905-2、1915-2、1905-4作为筛选得到抗病原菌真菌。
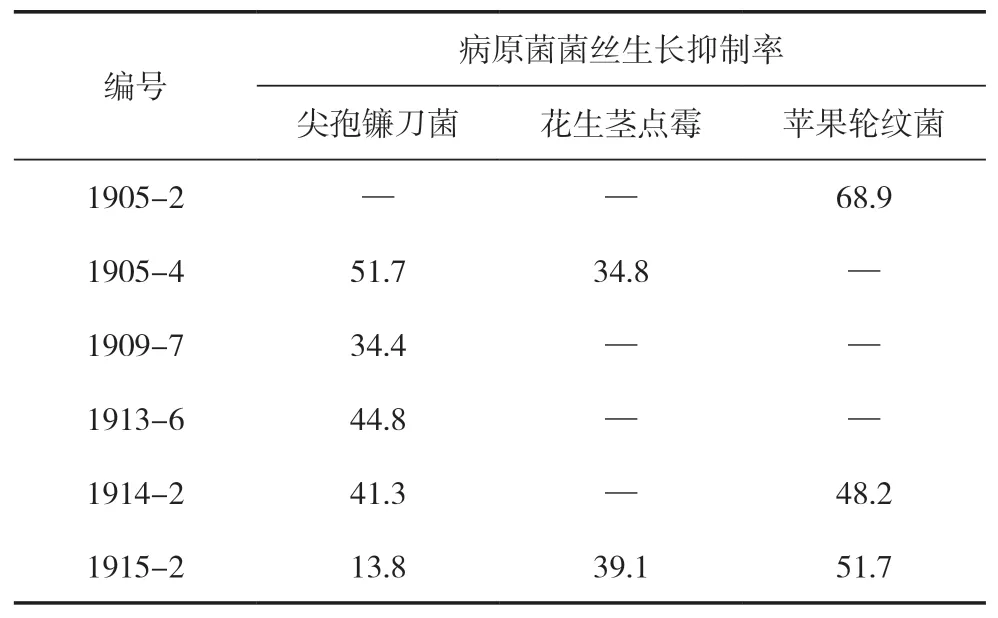
表2 地衣真菌抑菌活性结果 (%)
2.4 功能菌株的组合筛选
以复筛出的高效溶磷菌株1905-4与高效降解纤维素菌株1913-6、1909-7、1905-2、1915-2分别组合,由于溶磷菌株1905-4生长较快,因此以溶磷菌株∶纤维素菌株=1∶4作为菌液比例,组合编号分别标为2、3、4、5、6,空白对照标为编号1。通过滤纸降解效率和钼锑抗比色法分别测定组合降解纤维素能力与溶磷能力。发酵培养6 d后的滤纸降解效率见表3,根据实验结果得出组合5的崩解效果最好,其次为组合4和组合6。钼锑抗比色法测定溶磷率(图5),由实验结果得出组合5磷酸根离子溶度最高,其次为组合4和组合6。所以选取组合4、组合5和组合6作为菌剂研制的实验组,探究其对黄瓜苗的促生作用。

表3 功能性真菌组合培养6 d的滤纸降解效率
2.5 地衣真菌多功能复合菌剂的研制
按照前期筛选的高效复合多功能作用的真菌组合4、5和6作为实验组,不加菌为空白对照组,分别测量其对黄瓜苗的促生作用。将黄瓜种子种在加入含有菌株的生物肥料和沙土中,测量15 d后黄瓜苗根长、茎长、鲜重、干重等生长指标。
从表4中可以看出,4个处理下黄瓜苗根长表现为组合4>对照组>组合5>组合6,但无显著性差异(P>0.05)。黄瓜苗茎长表现为组合5>组合6>组合4>对照组,不同菌肥组合处理黄瓜苗茎长有显著性差异(P<0.05)。不同菌肥处理对黄瓜苗生物量干重总体表现为组合6>组合5>组合4>对照组,鲜重总体表现为组合5>组合6>组合4>对照组,且生物菌肥对增加黄瓜苗生物量干鲜重具有显著效果(P<0.05)。组合5在茎长和鲜重上占有优势(图6),且组合5的溶磷效果及降解纤维素效果最好,因此综合选取组合5研制的生物菌剂作为最终的微生物菌剂。
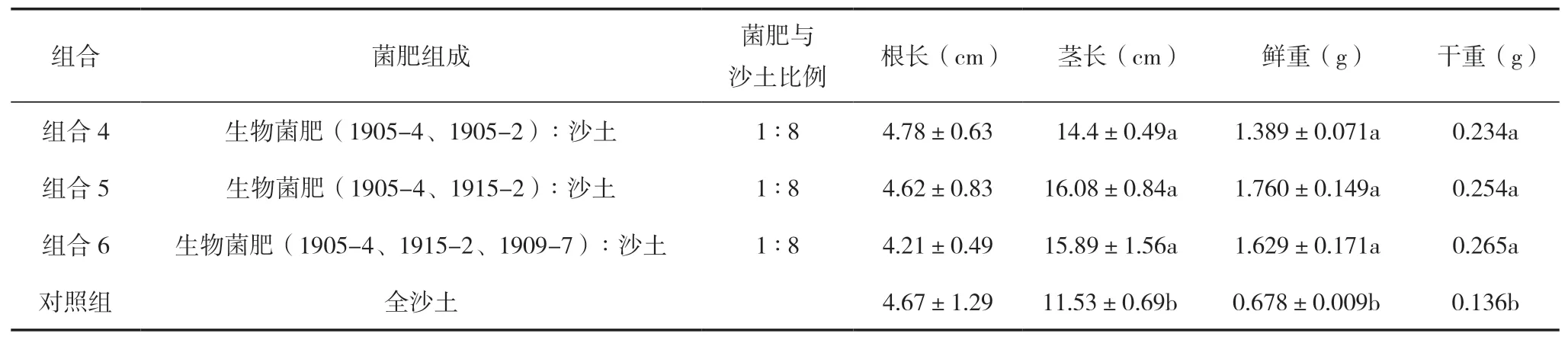
表4 菌肥盆栽实验结果
2.6 功能菌株的鉴定
2.6.1 功能菌株形态特征
本实验筛选得到的高效降解纤维素菌株为1905-2、1909-7、1913-6、1915-2,其中菌株1905-2和1915-2具有抑制病原菌的活性。高效溶磷菌株为1905-4,也具有抑制病原菌的活性。将功能菌株接种到PDA培养基中,在25℃恒温培养箱中培养5 d,用光学体式显微镜观察地衣真菌的外部形态。分别记录真菌菌株的形态学特征。根据真菌的形态学特征,参照《真菌鉴定手册》[19]和《中国真菌志》[20]进行比对分析,菌株1905-2在培养基上生长形成瓶梗及瓶梗孢子,瓶梗基部呈球形或椭圆形膨大,瓶颈细长而弯曲,瓶梗孢子球形至卵形。菌株1905-4分生孢子穗黑色,大而呈球形;分生孢子梗光滑,无色;顶囊稍膨大,产小梗,小梗双层,分生孢子粗糙,具褐黑色条纹。菌株1909-7菌落淡黄绿色,分生孢子梗粗糙,分生孢子穗半圆形、圆筒形,颜色如菌落。菌株1913-6菌落青绿色,分生孢子梗从菌丝垂直生出,无足细胞,有横隔膜,粗糙,顶层为小梗菌株1915-2白色菌落,产孢后逐渐变成浅粉红色,分生孢子梗末端膨大。分生孢子为单细胞,椭圆形至纺锤形,呈链状、平滑、无色至黄色,孢梗上具有瓶颈状不规则的分枝或轮生分枝,瓶梗基部较宽。轮生分枝由圆柱形的部分组成,有时分枝向远离主轴方向弯曲。
2.6.2 ITS rDNA序列分析
改良CTAB法提取功能地衣真菌的DNA,PCR扩增和测序获得ITS rDNA片段,在GenBank上进行BLAST比对,结合形态学特征与分子系统学分析确定菌株1905-2为高山弯颈霉(Tolypocladium tropicale),1905-4为塔宾曲霉(Aspergillus tubingensis),1909-7为黄曲霉(Aspergillus aflatoxiformans),1913-6为产黄青霉(Penicillium chrysogenum),1915-2为淡紫拟青霉菌(Purpureocillium lilacinum)。
3 讨论与结论
本实验筛选得到的高效降解纤维素菌株为1905-2、1909-7、1913-6、1915-2,其中1905-2和1915-2具有抑制病原菌的活性。高效溶磷菌株为1905-4,也具有抑制病原菌的活性。菌株1905-2为高山弯颈霉(T.tropicale),1905-4为塔宾曲霉(A.tubingensis),1909-7为黄曲霉(A.aflatoxiformans),1913-6为产黄青霉(P.chrysogenum),1915-2为淡紫拟青霉菌(P.lilacinum)。目前,曲霉属、青霉属和拟青霉属菌株是在降解纤维素菌株的研究与应用中产酶量大、酶系组成比较齐全的霉属[21]。对于颈霉属(Tolypocladium)的研究国内主要集中在新种的发现及鉴定上,颈霉属是Gams于1971年建立的新属,截至目前,国际真菌名录数据库中记录了弯颈霉属有43种[22]。在颈霉属中得到了具有高效降解纤维素效果的菌株,为颈霉属生物活性的开发和利用奠定了基础。溶磷真菌具有比溶磷细菌更高的生物活性,但目前还存在着溶磷真菌菌种少的问题[23],从地衣真菌中筛选得到了具有高效溶磷效果的菌株,为溶磷真菌的有效开发奠定了基础。
本研究通过筛选得到功能菌株,进行复合后研制菌剂,以组合4(1905-4、1905-2)、组合5(1905-4、1915-2)和组合6(1905-4、1915-2、1909-7)作为菌剂研制的实验组,探究其对黄瓜苗的促生作用。组合5在茎长和鲜重上占有优势,且组合5的溶磷效果及降解纤维素效果最好,因此综合选取以组合5所研制的生物菌剂作为最终的微生物菌剂,为微生物菌肥的工业化生产奠定了基础,具有广阔的应用研究前景。
综上,从地衣真菌中筛选出高效功能真菌,同时以不同菌株组合研制生物菌肥探究其对黄瓜苗的促生作用,找到促生效果最好的组合菌剂,后续将在此基础上对筛选出的高效真菌进行产酶条件的探索及优化,以期大幅度提高功能菌株生物活性,同时对高效菌株生物活性的分子机制进行深入研究,对生物菌剂将探究其组合条件的优化,以期获得工业化的生产。

