混施微生物菌剂和有机肥对‘新红星’苹果解袋后果实品质的影响
刘洋洋,束怀瑞,陈 伟*
(1.山东农业大学食品科学与工程学院,山东省高校食品加工技术与质量控制重点试验室,山东 泰安 271000;2.山东农业大学园艺科学与工程学院,山东 泰安 271018)
苹果是世界性果品,由于其生态适应性强、果品营养价值高、耐贮性好及供应周期长,世界上相当多的国家都将其列为主要消费果品而大力推荐[1]。苹果果实含有较多易被人体吸收的游离多酚,在抗氧化、预防心脑血管疾病及抗肿瘤等方面均具有较好的作用[2]。然而我国果园土壤多数瘠薄,有机质含量低(国外果园土壤有机质含量在3%以上,我国多在0.5%~2%之间),果树根系生活环境因素的稳定性差,严重制约了地上部树体正常生长发育,是果实品质差的主要原因之一。有计划地增施有机肥是增加土壤有机质含量的重要手段[3]。彭先云[4]研究了有机肥在农产品应用中的作用,表明了有机肥的施加不仅可以改善土壤的状况,促进微生物的转化,而且能有效提高农作物的品质。近年来,随着可持续农业的发展,微生物肥料作为一种新型肥料,对保护环境、促进“绿色和生态农业”的发展有很大帮助,通过所含微生物的生命活动来活化土壤中的养分,促进植物养分吸收及植株生长,提升农产品品质[5],在改良土壤、抑制病菌、促进作物生长方面具有显著作用[6]。
近年来,采前套袋技术在果业生产中已广泛应用。很多研究表明,果实套袋在改善果实外观品质[7],减少病虫害发生的同时,对果实内在品质也产生一定影响[8-11]。Sharma等[12]发现苹果套袋后果实硬度降低;Amarante等[13]研究表明‘考密斯梨’在贮藏过程中套袋果实更容易软化;Liu等[14]研究结果也显示,套袋能影响苹果果实中糖、酸及其它内含物的含量。‘新红星’(Malus domesticaBorkh cv.Starkrimson)原产于美国,1952年由Bisbee发现,1956年正式命名[15],其果实果面浓红,色泽艳丽,果形高桩,五棱突出,外形美观,香甜可口,综合品质极佳,推出后各国竞相引种试栽,中国从1964年引入,并逐步推广[16]。‘新红星’喜光照强、日照时间长、温差大、气候相对干燥的环境[17-18],果实成熟早,树体强壮、直立,果枝粗壮,易形成短果枝,在山东地区种植适宜采前套袋。
以往套袋栽培的研究多集中于套袋对果皮结构[19]、色泽变化[20]和芳香物质的影响[21]以及套袋时期、方法[22]等方面,而解袋后随着天数的增长含微生物菌剂的有机肥对苹果果实品质的影响研究报道较少。故本试验以山东地区‘新红星’苹果果树为试材,研究含微生物菌剂的有机肥对苹果解袋后0~15 d内果实内在品质、呼吸速率、乙烯释放速率、果实细胞显微结构、硬脆性及关键酶和基因表达的影响,从而为科学有效地提高苹果品质及果实耐储性提供理论依据。
1 材料与方法
1.1 试验设计
试验于2018年在山东省招远市金岭镇苹果基地进行,试验材料为5年生‘新红星’苹果树,试验于2018年3月进行,选取树势一致、生长旺盛的果树40棵,共设4个处理:T1,5000 g有机肥;T2,5000 g有机肥+10 g微生物菌剂,T3,10 g微生物菌剂;CK,对照。每个处理10棵果树,施肥用量见表1。除了施肥种类不同,其余种植管理水平均相同。2018年3月5日将肥料均匀撒在树盘下,2018年9月15日测定供试土壤基本理化指标,结果见表2。2018年9月16日果实解袋,分别在解袋后第0、3、6、9、12、15 d取苹果样品,每次取样时选取树冠外围同一高度同一部位的果实,选取大小均一、果面整洁、无病虫害、无机械损伤的果实,每个处理每次采摘30个苹果,套网袋后装入纸箱立即带回实验室进行测定。
表1 不同处理施肥用量
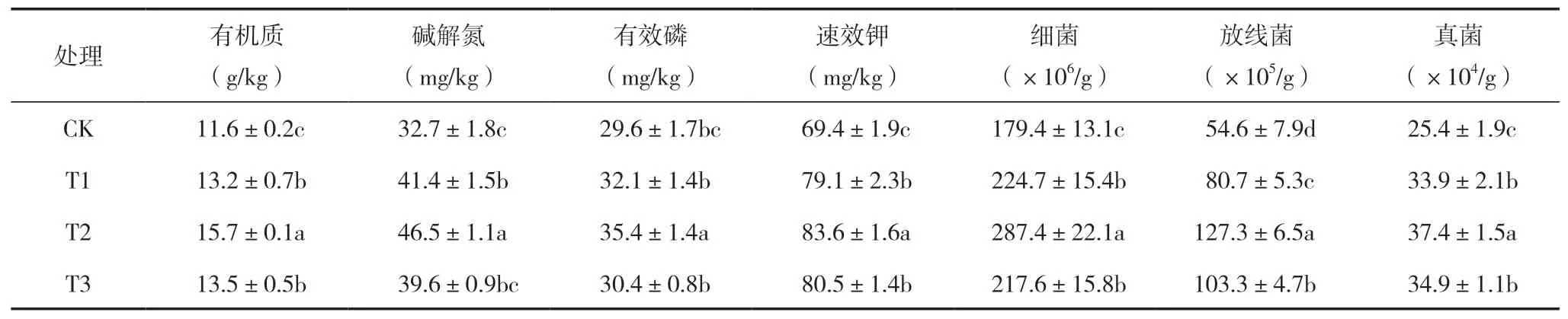
表2 土壤基本理化指标
1.2 测定方法
1.2.1 苹果表皮细胞形态观察
观察苹果表皮细胞形态时用镊子轻轻将苹果赤道周围的表皮撕下并制成玻片,在AXIO荧光显微镜下观察并拍照[23]。
1.2.2 苹果内在品质测定
可溶性固形物含量用WYT手持糖量计测定;可溶性糖含量采用蒽酮法测定[24];可滴定酸用酸碱中和滴定法测定[25]。
1.2.3 果实呼吸速率及乙烯释放速率
用SY-1022果蔬呼吸仪测定呼吸强度;参考Gwanpua等[26]的测定方法,略有改动,采用GC-9A气相色谱仪测定乙烯含量,利用N2000色谱软件进行数据处理[27]。
1.2.4 挥发性物质测定
顶空固相萃取:将苹果样品洗净,5点均匀取样,称取切碎的新鲜果实40.0 g,加入100 mL的锥形瓶中,加入内标物3-壬酮(0.4 mg/mL)10 µL,加盖封口后于加热板上平衡10 min。将萃取头于进样口250℃老化20 min,取出插入平衡好的样品瓶中进行吸附,吸附45 min后将萃取头插入气相色谱质谱进样口解析3 min。
气相色谱质谱分析条件:参照王传增等[28]方法,利用Shimadzu GC/MS-QP2010气相色谱-质谱联用仪。色谱条件:色谱柱Rtx-1MS(30 m×0.25 mm×0.25 µm)柱;升温程序:35℃保持2 min,以6℃/min的频率升温至120℃,保持1 min;以10℃/min的频率升温至180℃,再以20℃/min的频率升温至230℃,保持5 min。质谱条件:载气为He气,流量1.03 mL/min,电离方式EI,电子能量70eV。离子源温度200℃,扫描质量范围:45~450 amu。进样:不分流进样。
1.2.5 果实硬脆度
用TA.XT Express型质构仪测定苹果硬脆度,每个处理选择5个苹果,每个苹果选取赤道位置的4个点,结果取20个点的平均值。每次测定要调节参数一致,并且保持苹果跟探头垂直接触[29]。
1.2.6 细胞壁酶活性及其相关基因表达量
根据Wei等[30]描述的方法稍作修改测定细胞壁酶活性;通过QRT-PCR测定参与细胞壁代谢基因的表达[30],用快速通用植物RNA提取试剂盒3.0(北京)从果实中提取总RNA。基因特异性引物如表3,每个基因第0 d的表达水平设定为1.0。除特殊说明,以上所有试验均设3次生物学重复。
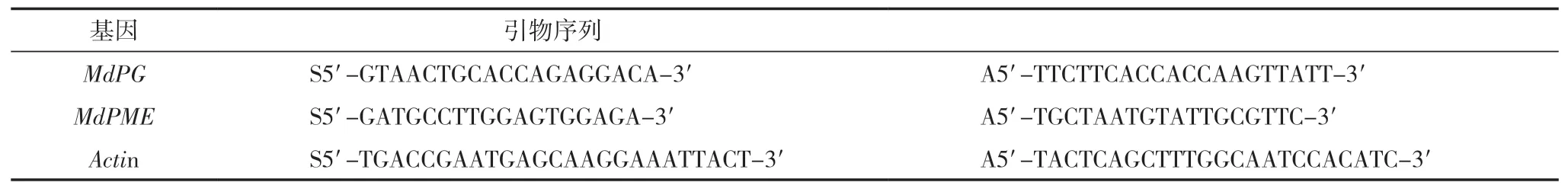
表3 用于QRT-PCR扩增细胞壁酶相关基因表达的引物
1.3 数据处理
所有统计数据通过SPSS 20.0软件进行显著性差异分析和相关性分析,并采用Origin 9.4软件作图。
2 结果与分析
2.1 苹果果皮细胞形态的变化
由图1可以看出,果实成熟时(第15 d)CK组果实细胞排列不紧密,细胞较小不饱满,着色差;T1组果实细胞大小较均匀,排列较紧密,着色较好;T2组果实细胞较大,细胞间空隙较小,细胞排列紧密,着色较好;T3组果实细胞偏小,细胞间隙较大,着色较好。成熟饱满、排列紧密的细胞使T2组苹果能够更好保持水分,从而更好保持硬脆度,延长货架期。
2.2 不同肥料处理对苹果内在品质的影响
由表4看出,果实解袋后可溶性糖和可溶性固形物含量变化趋势基本一致,呈先上升后趋于平稳的趋势。T2组果实可溶性糖和可溶性固形物含量在解袋后第6~15 d均显著高于其他组,果实成熟时(第15 d)两者含量相对于CK组分别提高了12.86%和8.78%。
果实可滴定酸含量逐渐降低,T2组果实可滴定酸含量在3~15 d均低于其他组,果实成熟时(第15 d)其含量相对于CK组降低了11.86%。
果实糖酸比一直处于上升趋势,其中在第9~12 d上升速率最为明显,第12~15 d趋于平稳,果实成熟时(第15 d),T2组果实糖酸比比CK组高出17.08%,果实风味达到最佳。说明添加微生物菌剂的有机肥有利于果实可溶性糖和可溶性固形物的积累,可以降低可滴定酸含量,从而提高果实糖酸比,有利于果实风味的形成。
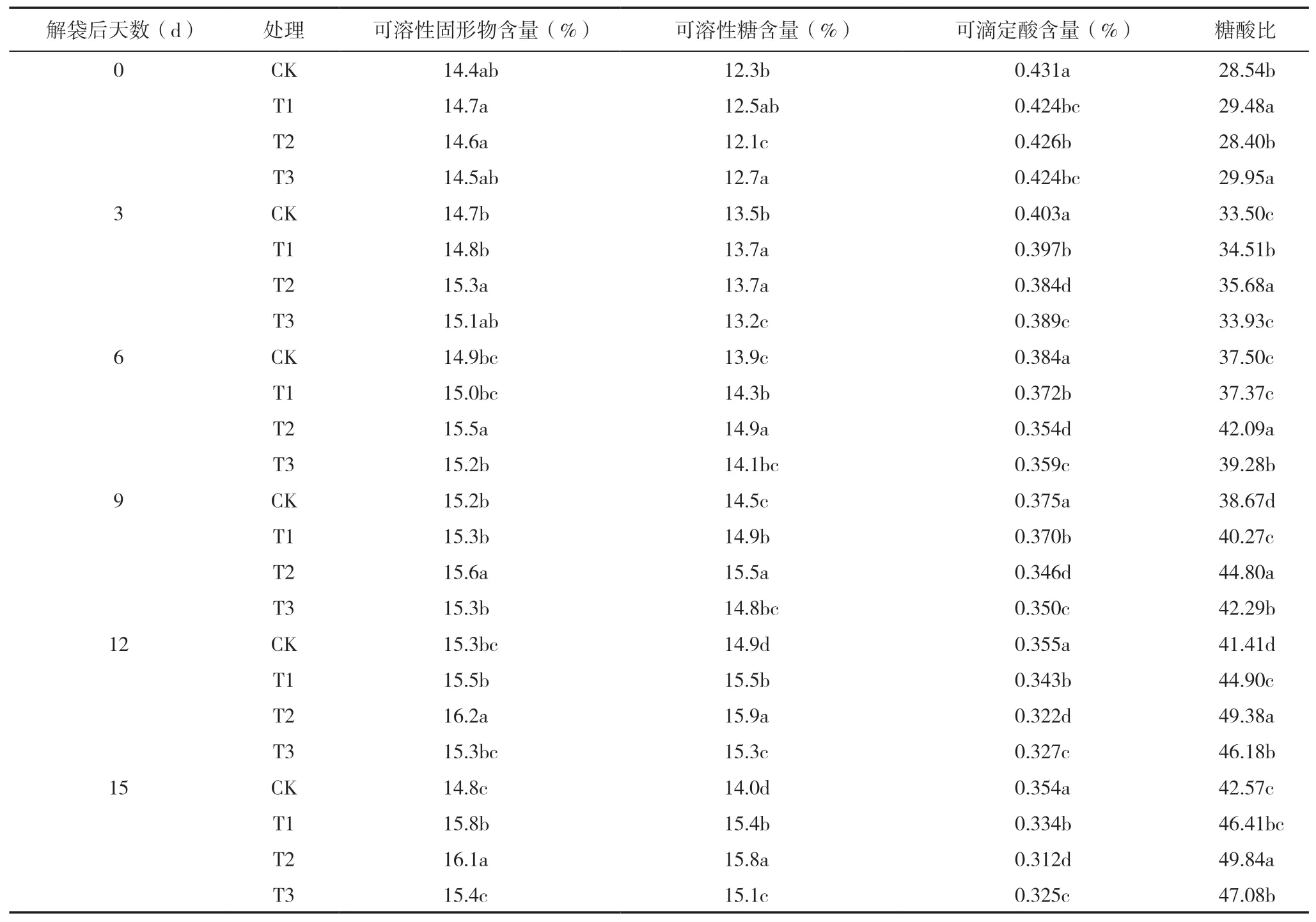
表4 解袋后果实内在品质的变化
2.3 不同肥料处理对果实呼吸速率和乙烯释放速率的影响
由图2A可知,果实呼吸速率在解袋后均逐渐上升,T1、T2、T3组果实在成熟过程中呼吸速率一直高于CK组。其中T1、T2组相对于CK组差异显著,T1组在0~6 d呼吸速率显著上升,在6~15 d上升幅度减缓,在第3、9、15 d较CK组分别高出27.4%、40.9%、18.6%。T2组在0~12 d呼吸速率显著提高,12~15 d呼吸增幅减缓,在第3、9、15 d较CK组分别高出13.8%、35.6%、15.9%。
由图2B可知,苹果在解袋后果实乙烯释放速率均呈上升趋势,0~12 d乙烯释放速率上升较快,12~15 d趋于稳定。T3组果实乙烯释放速率超过其他组,CK组果实乙烯释放速率一直处于最低。T1、T2两组在9~15 d差异不明显,其中T2组在第0、6、12 d较CK组分别高出81.2%、120.4%、23.8%。说明添加微生物菌剂的有机肥可提高果实呼吸速率和乙烯释放速率,但是作用不明显。
2.4 不同肥料处理对果实挥发性物质的影响
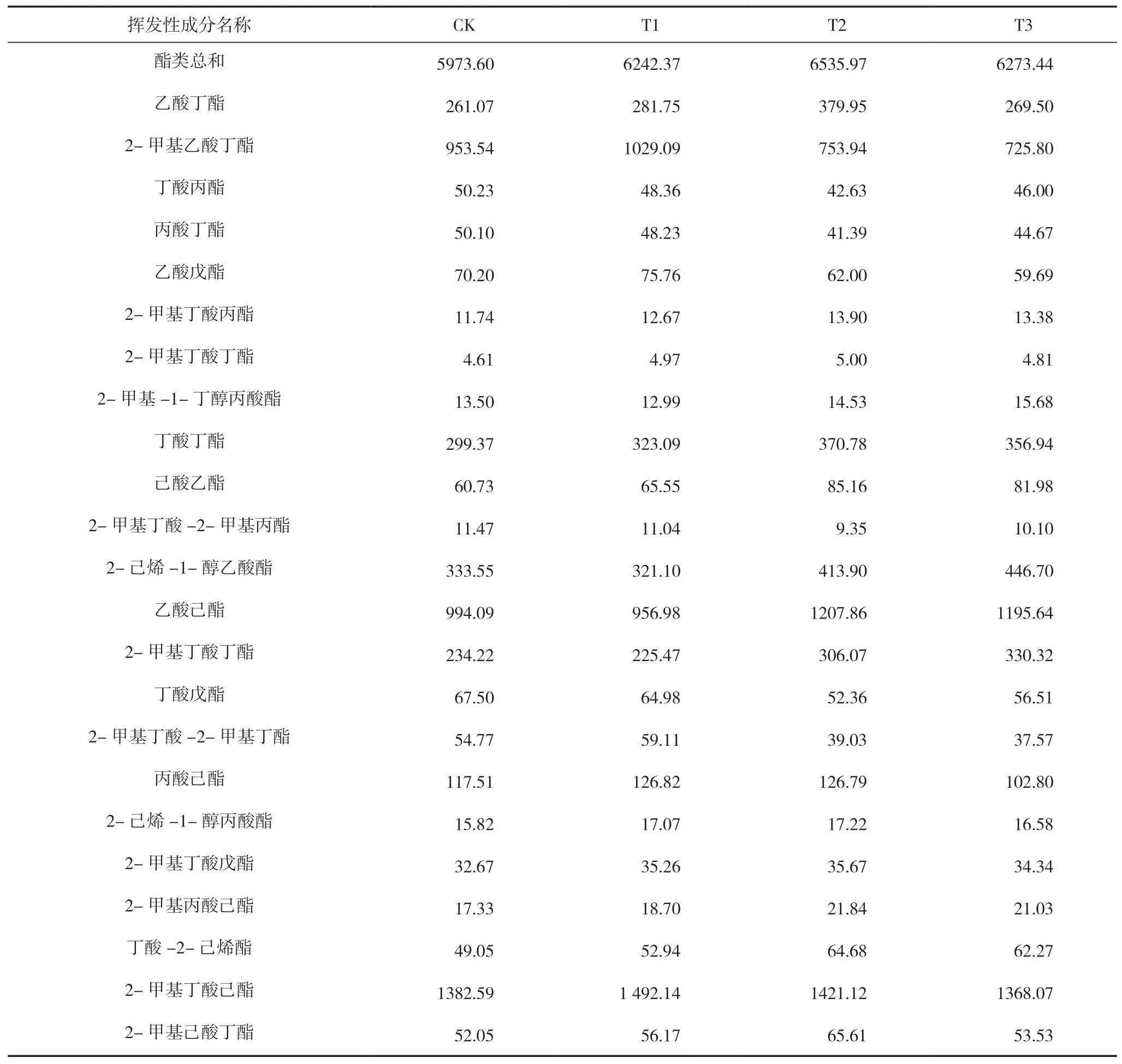
表5 不同肥料处理对果实挥发性成分的影响
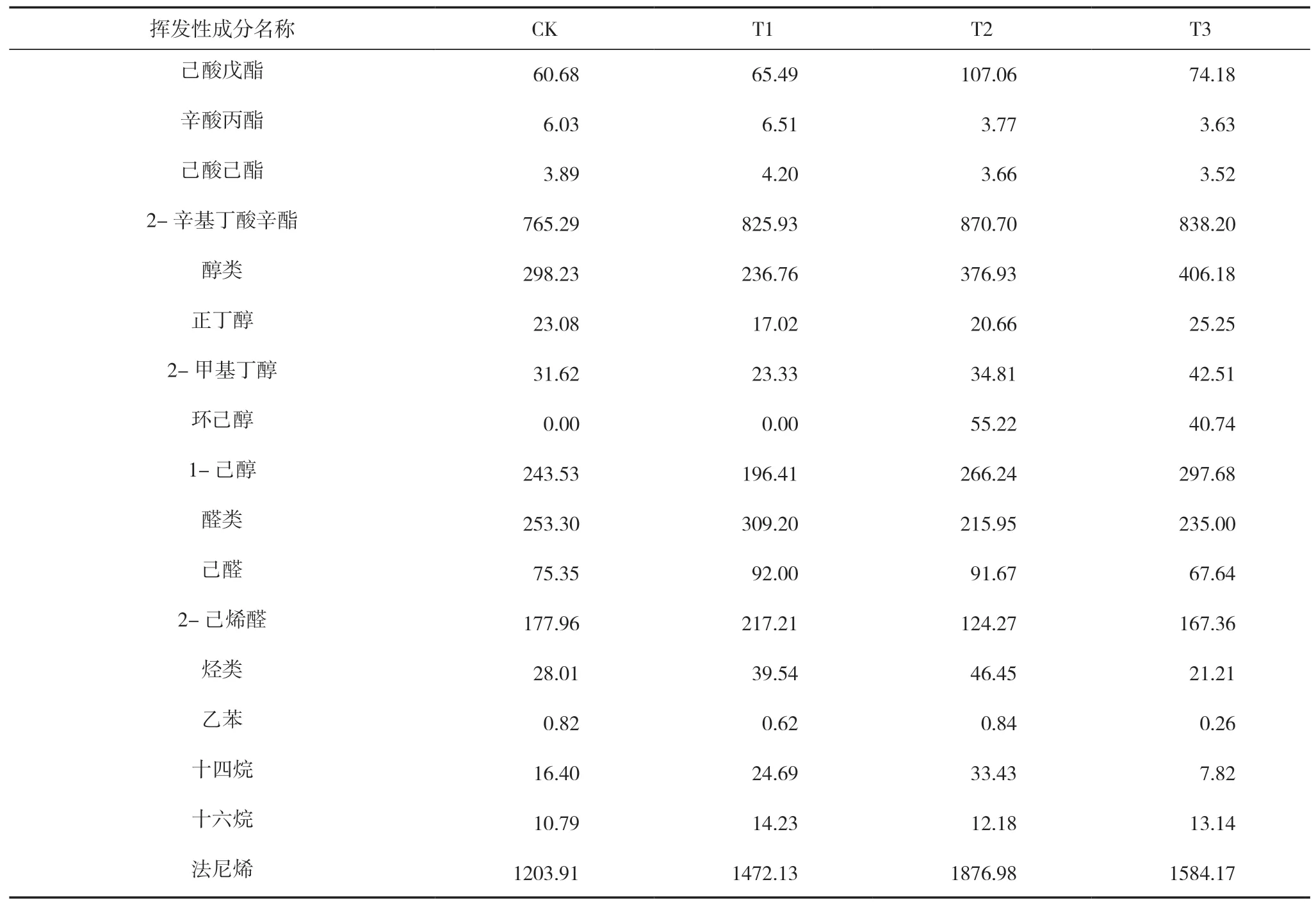
续表
由表5可知,在‘新红星’苹果样品中共检测到37种香气物质,酯类是苹果香气的重要贡献者,其中主要的酯类物质是2-甲基乙酸丁酯、乙酸己酯、2-甲基丁酸己酯、2-辛基丁酸辛酯。醇类以1-己醇为主,醛类以2-己烯醛为主,烃类中以十四烷为主。果实成熟时(第15 d),T1、T2、T3组果实香气总含量相对于CK组分别高出8.55%、21.3%、8.2%,其中T2组果实总香气含量明显高于其他组,T2组酯类含量相对于CK组高出9.41%,其中丁酸丁酯、乙酸己酯、2-甲基丁酸己酯、己酸戊酯相对于CK组分别高出23.85%、21.5%、30.68%、76.43%;醇类物质T1、T2组显著高于CK组;T2组醛类物质显著低于CK组;烃类及法尼烯均高于CK组。说明有机肥与微生物菌剂均可以提升果实中的香气,其中添加微生物菌剂的有机肥(T2)对果实总香气物质的提升效果最显著。
2.5 不同肥料处理对果实脆度的影响
‘新红星’苹果解袋后果实脆度均呈上升趋势,脆度在0~9 d变化不明显,在9~15 d变化显著(图3)。T2组对苹果脆度的改善效果最好,果实成熟时(第15 d),T2组较CK、T1、T3组分别提高34.5%、20.6%、6.6%。说明添加了微生物菌剂的有机肥(T2)对苹果脆度改善效果最佳,提高了果实的口感。
2.6 不同肥料处理对果实硬度的影响
由图4可知,苹果在解袋后果实硬度呈下降趋势,解袋后第0~6 d果实硬度变化不明显,第6~12 d下降速度较快,第15 d时T2组较CK组高出12.8%,果实硬度仍然保持较高水平,由此可知,添加了微生物菌剂的有机肥(T2)对果实硬度的保持具有积极作用,有利于延长果实货架期。
2.7 不同肥料处理对细胞壁酶活性及相关基因表达的影响
果实硬度主要与果胶甲酯酶(PME)、多聚半乳糖醛酸酶(PG)两种细胞壁酶有关,其酶活性与硬度呈负相关。由图5A、B可知,各组PME、PG的活性在苹果解袋后均呈上升趋势,最后趋于稳定。PME活性在解袋后第3~12 d活性增加较快,第12~15 d趋于稳定。其中CK组果实PME活性较高,而T1、T2组PME活性较低。T1组果实在解袋后第3、9、15 d相对于CK组分别减少了7.8%、11.8%、16.8%,T2组在解袋后3、9、15 d相对于CK组分别减少了15.6%、30.2%、35.7%。PG活性在解袋后第0~9 d逐渐增加,第9~15 d趋于稳定。其中CK组PG活性较高,T1、T2组PG活性较低。T1组果实在第3、9、15 d相对于CK组分别减少了27.3%、12.7%、14.1%,T2组在解袋后第3、9、15 d相对于CK组分别减少了21.2%、24.5%、15.3%。
由图5C、D可以看出,MdPME相对表达量在解袋后先上升后下降,T2组果实在解袋后第3、6、12 d相对于CK组减少了38%、25.7%、19.4%;T3组果实在解袋后第3、6、12 d相对于CK组分别降低了30.4%、20.2%、11.2%。其中0~15 d CK组果实MdPG相对表达量最高,T2组最低,T2组果实在解袋后第6、12、15 d相对于CK组分别减少了15.3%、21.9%、25.4%。说明添加微生物菌剂的有机肥(T2)可以降低果实MdPME和MdPG表达量,从而降低果实PME、PG活性,使得果实保持较高的硬度。
3 讨论
科学的肥水管理是苹果健壮生长和早果丰产的前提条件。每年9月份施基肥,主要以有机肥为主。适量施入有机肥,不仅为果树生长提供多种营养,而且还能起到改善土壤理化性状、促进果树生长的效果[31]。‘新红星’苹果对土壤肥力的要求较高,其产量和品质不高,一直是生产中的主要限制因素,除立地条件以外,肥料的施用对红富士产量和质量影响较大。因此在施肥种类上选择以有机肥为主,以少施微生物菌剂为辅,改善土壤结构,提高土壤有机质含量和增加土壤通透性,更利于微生物活动,以发挥有机肥营养成分齐全、肥效缓慢持久及改良土壤等优点。增施含有微生物菌剂的有机肥,可以提供给果树所需要的各种营养元素,使土壤肥力不断提高,对果树的根系生长和分布起到一定的促进作用,增加果树的吸收根量,增强树体的营养积累,促壮树势,这是果树丰产稳产的前提和关键。
在当前苹果园密植的前提下,为加强地下管理,国内外果树工作者对苹果果皮的解剖结构进行了一些研究,邓继光等[32]报道了苹果品种果实组织结构的差异;果皮是果实抵御外界不良环境的天然屏障,果皮细胞的紧密性不仅与果表面光洁度具有最直接的关系,而且与果实贮藏性能密切相关[33];宫美英[34]研究发现苹果果皮结构与耐贮性密切相关。本研究表明,添加了微生物菌剂的有机肥(T2)处理果实着色好,果皮结构紧密,且细胞小、胞壁厚,排列紧密,并有厚角蜡层或木栓层保护,对果实有更好的保护作用,大大提高了解袋后苹果的商品价值及耐储性。
果实所积累糖的种类、含量及比率对果实风味、色泽和其它营养成分有重要影响,是决定果实品质和商品价值的主要因素[35-36]。在果实成长成熟过程中,酸含量在幼果中较高[37],随着果实发育,一部分酸作为呼吸底物而被消耗,一部分酸转变为糖,果实中糖酸比得到迅速提高,使果实风味更加浓郁。以往的研究表明,富士系苹果的酯类物质,尤其是乙酸乙酯等大量酯类物质组分的变化,与果实的风味质量密切相关[38]。本研究表明,在‘新红星’苹果解袋后随着时间的延长各处理可溶性固形物、可溶性糖含量均呈上升趋势,可滴定酸处于下降趋势,在第12~15 d糖酸比值达到最大,其中添加了微生物菌剂的有机肥(T2)处理对提升果实糖酸比效果最明显,可能是微生物菌剂中微生物的活动促进了有机肥中养分的分解,使土壤中碱解氮、有效磷、速效钾等已被植株吸收的养分含量增加,从而对果实糖酸比的提升起到关键性作用。
有研究表明苹果果实是一种呼吸跃变型果实,其成熟的特征是乙烯释放速率和呼吸速率呈指数增长[39],乙烯在苹果果实成熟过程中起着关键的调节作用,例如挥发性物质合成[40]和花青素积累[41]。据报道[42-43],构成苹果香气的化合物达250种以上,分别为碳水化合物、酯类、醇类、烃类、醛类及环氧化合物,其中对苹果芳香起主要作用的是前3类物质。研究认为[44-45]有20~40种挥发性成分直接与苹果香气特征产生相关,如乙酸丁酯、丁酸丁酯、乙酸己酯、2-甲基丁酸丁酯、2-甲基丁酸己酯以及乙基、丙基的丁酸酯类。本研究结果表明,果实解袋后,随着果实的成熟,果实呼吸速率及乙烯释放率都处于上升趋势,通过对果实香气的检测发现酯类总和T2>T1>T3>CK,添加了微生物菌剂的有机肥(T2)处理酯类总量最高,有机肥(T1)其次,可能是果实成熟过程中添加了微生物菌剂的有机肥为果实提供了更多微量元素,对果实成熟过程中酯类化合物的积累起到了关键作用。
苹果在成熟期间,硬度逐渐降低,而脆度逐渐升高,期间发生许多生理和生化变化,是影响果实保质期和商业价值的决定性因素[46]。果实硬脆度是多种细胞结构变化的结果,主要是细胞壁结构的改变。细胞壁结构和组成的变化及细胞壁修饰酶的作用是苹果成熟期间硬度下降的主要原因[46-48]。细胞壁酶在细胞壁分解的过程中起主要作用,减少细胞间紧密程度,在果实发育的不同阶段发挥不同作用[49-50]。PME、PG是作用于细胞壁果胶部分的两种主要酶,Phan等[51]研究表明成熟期间PME活性降低,果实能保持较好的硬度。本研究表明,不同施肥处理对PME活性及MdPME表达量的影响明显不同。相对于CK组,T1、T2组显著降低了PME活性及其基因表达量,其中T2处理效果更显著。还有研究表明硅酸钠通过抑制PG的活性来延缓苹果果实的软化[52]。PG是另一种细胞壁修饰酶。它将果胶酸与多聚半乳糖醛酸的主链一起水解,导致果胶降解,细胞壁溶解,最终果实软化[53]。本研究表明PG及其基因表达量在解袋后第0~12 d处于上升趋势,第12~15 d趋于平稳,其中T2组效果较明显。说明添加微生物菌剂的有机肥(T2)可以降低果实MdPME和MdPG表达量,从而降低果实PME、PG活性,使得果实保持较高的硬度,有利于提高果实的保质期及其商业价值。
4 结论
本研究表明,添加了微生物菌剂的有机肥处理可以显著提高解袋后苹果果实内在品质,使果皮细胞排列整齐紧密,减少果实呼吸速率及乙烯释放速率、提高果实硬脆度、降低细胞壁修饰酶的活性及相关基因的表达水平,从而为科学有效地提高苹果品质及果实耐储性提供理论依据。

