魔芋软腐病致病菌Pectobacterium aroidearum的特征及贝莱斯芽孢杆菌的生防效果
崔 双陈昌龙冯佳豪曹 颖寇晓敏付 璐张荣萍谢 华*
(1 海南大学热带作物学院,海南海口 570228;2 北京市农林科学院北京农业生物技术研究中心,北京 100097;3 西南科技大学生命科学与工程学院,四川绵阳 621000)
魔芋(Amorphophallus konjac)属天南星科(Araceae)魔芋属(Amorphophallus)多年生草本植物,在中国、日本和东南亚地区长期作为食物来源和药材(Chua et al.,2010)。魔芋地下块茎富含葡甘聚糖,这种天然的高分子优质膳食纤维具有可溶性、凝胶性、增稠性和成膜性等独特理化特性,近年来被广泛应用于食品、医药、化工和农业等生产领域(赵培城 等,2015;Devaraj et al.,2019)。魔芋在我国主要分布于云南、贵州、四川、重庆及陕南、鄂西、湘西、豫西南地区(刘佩瑛,2004)。近30 年,我国魔芋产业发展迅速,种植面积常年稳定在10 万hm2(150 万亩)左右,是世界魔芋原料生产与供给中心(周燚 等,2013)。由于其较高的产量和经济价值,近年来魔芋产业已成为我国中西部地区农民扶贫攻坚的支柱产业(卢美欢等,2019)。细菌性软腐病是魔芋生产上危害最严重且防控极为困难的病害,在整个生长期及贮藏期均可发病,可为害叶片、叶柄及块茎,一般引起产量损失20%~30%,病情严重地块可导致产量损失达80%以上,甚至造成绝收(王红岩 等,2019),严重制约和威胁我国魔芋产业的可持续发展。
植物细菌性软腐病主要致病菌包括Pectobacterium和Dickyeya属,均可引发多种植物腐烂病害,涉及到蔬菜、花卉、果树及大田作物(Ma et al.,2007)。其中,Pectobacterium是一个高度异质化的类群,目前被报道有十几个种(Portier et al.,2019)。早期我国科研人员利用表型及rRNA操纵子16S~23S rDNA 转录间隔区(intergenic transcribed spacer,ITS)进行PCR 扩增,将引起云南省魔芋软腐病的致病菌鉴定为Pectobacterium carotovorumsubsp.carotovorum(原Erwinia carotovorasubsp.carotovora)(Gardan et al.,2003;修建华 等,2006)。2013 年,Nabhan 等(2013)基于表型、DNA-DNA 杂交、16S rDNA 和多位点序列分析(multilocus sequence analysis,MLSA),将P.aroidearum确立为一个新种,而包含在P.aroidearum类群中的P.carotovorumPC1 被归为P.aroidearumPC1。2018 年,该种首次在中国报道为大白菜软腐病新致病菌,并初步描述了其生物学特征(李晓颖 等,2018;Xie et al.,2018)。而此前从陕西岚皋县魔芋上分离到的软腐病致病菌M8 的16S rDNA 序列与P.carotovorumPC1 菌株关系最近(徐炜 等,2011),暗示其可能为P.aroidearum。孙苗苗(2019)通过形态学观察、生理生化测定以及分子生物学鉴定,将在我国鄂西地区收集的魔芋软腐病致病菌鉴定为2 个种,其中约66.7%为P.aroidearum,33.3%为Dickeya;魏环宇等(2020)基于形态学观察、生理生化测试及16S rDNA 序列,将从云南西双版纳州和德宏珠芽魔芋分离到的软腐病致病菌鉴定为P.aroidearum。然而,目前对云南富源、楚雄及四川宜宾等魔芋主要种植区最为严重的软腐病害的致病菌种类和分类地位尚不清楚。
魔芋软腐病的防治较为困难,通过合理密植和施肥、轮作、间套作等栽培措施,可在一定程度上降低发病率(古洪辉 等,2018)。在魔芋种植前使用70%甲基硫菌灵可湿性粉剂处理种芋,软腐病发病初期使用20%噻菌铜悬浮剂等药剂对软腐病有明显的防效(钟刚琼 等,2004;王红岩等,2019),但长期使用化学药剂易使病原菌产生抗药性,且对环境和人畜的安全构成潜在威胁。有研究表明,枯草芽孢杆菌(Bacillus subtilis)和乳酸杆菌(Lactobacillus plantarum)分别对马铃薯软腐病和大白菜软腐病致病菌P.atrosepticum和P.carotovorum具有良好的抑制效果(Sharga &Lyon,1998;Kosaka et al.,2016)。最新研究发现,贝莱斯芽孢杆菌(Bacillus velezensis)对生菜软腐病致病菌P.carotovorum具有良好的拮抗效果(孙旺旺 等,2020)。
本试验从云南富源、楚雄和四川宜宾3 个主要魔芋种植区的软腐病病样中分离、纯化得到3 株魔芋软腐病菌菌株,并对其形态、生理生化、致病力和寄主范围等特征进行分析,明确了软腐病致病菌的种类和生物学特性。同时,利用平板对峙法和盆栽试验开展了贝莱斯芽孢杆菌对魔芋软腐病的防效分析,以期明确贝莱斯芽孢杆菌在防控魔芋软腐病中的应用潜力。
1 材料与方法
1.1 试验材料
供试菌株:2019 年从云南富源、楚雄及四川宜宾的魔芋种植区采集软腐病病样组织,分离、纯化获得魔芋软腐病病原菌。对照菌株P.aroidearumKC20(李晓颖 等,2018)、P.brasilienseBC1(Li et al.,2018)、P.odoriferumBCS7(Li et al.,2018)和P.versatileECC71(原P.carotovorumsubsp.carotovorum)(Portier et al.,2019)为北京市农林科学院北京农业生物技术研究中心保存;7株贝莱斯芽孢杆菌(编号分别为BPC6、BPC16、W1-1、W2-3、W2-4、W2-7 和E2-4)分离自植物根际土壤,为北京市农林科学院北京农业生物技术研究中心保存。
供试药剂:3%中生菌素可湿性粉剂,购自福建凯立生物制品有限公司。
培养基:LB(Luria-Bertani)培养基和营养肉汤(nutrient broth,NB)培养基的配制参考《微生物学实验》(沈萍和陈向东,2007);结晶紫果胶酸盐(crystal violet pectate,CVP)选择性培养基:蛋白胨2 g·L-1、氯化钙2 g·L-1、柠檬酸钠10 g·L-1、硝酸钠4 g·L-1、琼脂粉8 g·L-1,1%结晶紫水溶液3 mL,5 mmol·L-1氢氧化钠溶液4 mL,聚果胶酸钠36 g·L-1,pH=7.0;金氏B(King’s B,KB)固体培养基:胰蛋白胨20 g·L-1、磷酸氢二钾1.5 g·L-1、硫酸镁1.5 g·L-1,甘油15 mL,琼脂粉15 g·L-1,pH=7.2。
1.2 试验方法
1.2.1 病原菌分离、纯化与形态特征分析 采用常规平板划线分离法,从魔芋软腐病病样组织分离细菌单菌落,通过显微镜下菌株形态观察、革兰氏染色和CVP 选择性培养基培养,初步筛选魔芋软腐病菌菌株。取各待测菌株单菌落分别接种于10 mL的LB 液体培养基,180 r·min-1、28 ℃振荡培养16 h,用灭菌水洗涤3 次,配制成OD600=0.2 的菌悬液(即2 × 108CFU·mL-1),回接到魔芋组织上。具体方法:用灭菌小刀在健康魔芋块茎中心和盆栽植株的茎基部划4 mm × 4 mm 的十字型伤口,深度为2 mm,分别取10 μL 菌悬液加入其中,置于28℃温箱中培养24 h,然后从人工接种的魔芋发病组织处重新分离、纯化病原菌,保存于-80 ℃冰箱备用。菌株在LB 培养基和CVP 选择性培养基上的形态、扫描电镜下菌株形态观察、革兰氏染色及鞭毛染色参考《植病研究方法》(方中达,1998)。
1.2.2 特异PCR 产物分析 将分离、纯化后的魔芋软腐病菌菌株于LB 液体培养基中28 ℃过夜振荡培养,使用Bacterial genomic DNA Kit〔天根生化科技(北京)有限公司〕提取细菌基因组DNA,分别利用Pectobacterium果胶酸盐裂解酶基因(pelY)特异性引物Y1/Y2(Darrasse et al.,1994)和16S~23S rDNA ITS 引 物G1/L1(Toth et al.,2001)对其进行PCR 扩增;分别采用限制性内切酶RsaI 和HhaI 对G1/L1 扩增产物进行酶切(Toth et al.,2001),取7 μL PCR 产物和酶切产物分别进行1%、3%和2%琼脂糖凝胶电泳检测。
1.2.3 菌株16S rDNA 和pmrA基因序列分析 分别用细菌16S rDNA 通用引物27F/1492R(Osborne et al.,2005)和pmrA基因引 物F0145/E2477(Kettani-Halabi et al.,2013)对供试菌株基因组DNA 进行PCR 扩增及测序。基于所测菌株序列及GenBank 中相关菌株基因序列,使用软件MEGA6.0的邻接法(neighbor-joining,NJ)分别构建16S rDNA 和pmrA基因序列系统发育树,对菌株间的遗传关系进行分析。
1.2.4 全基因组平均核苷酸同源性(ANI)分析将分离、纯化的3 株魔芋软腐病菌菌株及对照菌株P.aroidearumKC20 进行全基因组测序,利用二代测序DNA 快速建库试剂盒(Illumina 平台),构建插入片段长度为500 bp 的文库,于Illumina HiSeq 测序平台进行双末端150 bp(PE150)测序,测序深度至少100×。测序数据经软件Trimmomatic处理后(Bolger et al.,2014),应用SPAdesV3.11.0进行组装(Bankevich et al.,2012)。利用MUMmer软件进行序列比对,获得供试菌株间、供试菌株与P.aroidearumKC20 间以及供试菌株与NCBI 数据库中Pectobacterium内17 个种的菌株间的基因组平均核苷酸同源性(average nucleotide identity,ANI)值。
1.2.5 生理生化特性分析 将分离、纯化的3 株魔芋软腐病菌菌株接种于KB 培养基上,参考《植物病原细菌鉴定实验指导》(Schaad et al.,2011)进行生理生化特性分析。参照田宇等(2016)的方法,利用Biolog 全自动微生物鉴定仪GEN Ⅲ OmniLog Plus(BiologTM)对菌株的种类进行系统鉴定。
1.2.6 致病力及寄主范围测定 将健康魔芋块茎切开用75%酒精擦拭消毒后,置于下衬2 层无菌滤纸的培养皿中,加入7 mL 无菌水保持湿度,用灭菌小刀在其中心划4 mm × 4 mm 的十字型伤口,接种10 μL 菌悬液(2 × 108CFU·mL-1),封口后在28 ℃下培养24 h,然后称量魔芋块茎腐烂组织质量。将魔芋茎段切成8 cm 左右,在茎段中间接种10 μL 菌悬液(2 × 108CFU·mL-1),在28 ℃下培养12 h,然后观察发病情况并记录病斑长度。选取健康且长势相近的魔芋盆栽植株,用灭菌注射器在魔芋茎基部下1 cm 位置注射1 mL 菌液,在28℃下培养24 h,然后观察发病情况并记录病斑长度。以无菌水为对照,每处理3 个重复,试验重复3 次。
人工接种12 种易受细菌侵染而引发软腐病的植物,包括大白菜(Brassica rapa)、芹菜(Apium graveolens)、叶用莴苣(Lactuca sativa)、胡萝卜(Daucus carota)、马铃薯(Solanum tuberosum)、辣 椒(Capsicum annuum)、西葫芦(Cucurbita pepo)、鳄梨(Persea americana)等8 种 双子叶植物和虎眼万年青(Ornithogalum dubium)、大蒜(Allium sativum)、洋葱(Allium cepa)、大葱(Allium ampeloprasum)等4 种单子 叶植物(Ma et al.,2007;李晓颖 等,2018)。其中,大白菜、芹菜、叶用莴苣和虎眼万年青采用活体植株接种方法(李晓颖 等,2018),辣椒、胡萝卜、马铃薯、大蒜、洋葱、大葱、西葫芦和鳄梨采用离体接种方法(王茜 等,2015)。
1.2.7 贝莱斯芽孢杆菌对魔芋软腐病的平板对峙效果 将魔芋软腐病致病菌菌株和贝莱斯芽孢杆菌分别置于LB 和NB 培养基中,28 ℃、200 r·min-1分别振荡培养18 h 和48 h,吸取100 μL 病原菌菌悬液(OD600=0.20)涂布于LB 培养基,然后在平板中心用直径7 mm 的打孔器打孔,加入100 μL 贝莱斯芽孢杆菌菌悬液(OD600=5.00)。28 ℃恒温培养2 d,测量抑菌带大小。每处理3 个重复,试验重复3 次。
1.2.8 贝莱斯芽孢杆菌对魔芋软腐病的盆栽防效将魔芋种球种于装有草炭、营养土和蛭石(2V∶2V∶1V)的聚乙烯花盆中(直径13 cm,高12 cm),分别采用贝莱斯芽孢杆菌菌悬液稀释50 倍及3%中生菌素可湿性粉剂8 000 倍液,对发芽期魔芋进行灌根处理,每株苗每次20 mL,每隔10 d 灌1 次,共3 次。展叶期用一次性医用注射器刺伤魔芋植株茎基部1~2 次,刺伤但不穿透,之后向伤口处加入1 mL 病原菌菌悬液(2 × 108CFU·mL-1)。以清水为空白对照,每个处理20 盆,试验重复3 次。在温度30~35 ℃、相对湿度85%~90%条件下培养2 d,然后测量病斑长度。分级标准参考孙旺旺等(2020)的方法并结合魔芋生长情况稍作修改:0 级,接种位点无侵染病症;1 级,病斑开始形成,病斑长L≤0.5 cm;3 级,0.5 cm <L≤1.0 cm;5 级,1.0 cm <L≤3.0 cm;7 级,L>3.0 cm;9 级,茎大部分腐烂或倒伏。
病情指数=∑(各级病株数×相应级别)/(调查总株数×最大级数)× 100
防效=(空白对照病情指数-处理病情指数)/空白对照病情指数× 100%
1.3 数据分析
采用SPSS 20 软件进行试验数据统计分析,应用Duncan 氏新复极差法进行差异显著性检验。
2 结果与分析
2.1 病原菌的分离与形态特征
从采集的魔芋软腐病病样组织(图1-A)中分离软腐病菌菌株,回接到魔芋块茎上,24 h 后均发生腐烂(图1-B),产生黏稠状液体并伴有恶臭气味;将菌株接种至魔芋盆栽植株茎基部,24 h 后接种部位发生腐烂且有恶臭气味,产生半透明的水浸状病斑并逐渐向两端蔓延(图1-C),与田间软腐病发病症状表现一致。从人工接种的魔芋发病组织处重新分离、纯化病原菌,获得3 株致病菌菌株,分别命名为MY7、MY11 和MY18。这3 株菌株在LB固体培养基上28 ℃培养24 h 后单菌落形态一致,均呈乳白色、半透明圆形、中央稍隆起、表面光滑且边缘整齐(图1-D),在CVP 选择性培养基上28℃培养48 h,均产生杯状凹陷(图1-E),扫描电镜观察其形态呈短杆状,两头稍钝圆(图1-F),革兰氏染色呈阴性(图1-G),具有周生鞭毛(图1-H)。
2.2 特异PCR 产物分析
利用Pectobacterium特异性引物Y1/Y2 的PCR扩增结果显示,MY7、MY11 和MY18 与对照菌株P.aroidearumKC20、P.brasilienseBC1、P.odoriferumBCS7 和P.versatileECC71 均能扩增出预期片段大小约为434 bp 的PCR 产物(图2-A)。16S~23S rDNA ITS 引物L1/G1 扩增结果显示,MY7、MY11和MY18 与P.aroidearumKC20 扩增片段大小一致,而与P.brasilienseBC1、P.odoriferumBCS7 和P.versatileECC71 不同(图2-B);将扩增产物分别用限制性内切酶RsaI 和HhaI 酶切,结果显示,MY7、MY11 和MY18 与P.aroidearumKC20 条带大小相同,而与其他对照菌株均不同(图2-C 和2-D)。
2.3 基于16S rDNA 和pmrA 基因序列系统发育树分析
分别用细菌16S rDNA 通用引物27F/1492R和pmrA基因引物F0145/E2477 对供试菌株基因组DNA 进行PCR 扩增及测序,获得了MY7、MY11 和MY18 的16S rDNA 序列,GenBank 登录号分别 为MT834964、MT834965 和MT 834966;获得了3 株菌株的pmrA基因序列,GenBank 登录号分别 为MT834967、MT834968 和MT834969。同源性比对结果显示,MY7、MY11 和MY18 的16S rDNA 基因序列与已报道的P.aroidearumPC1(CP001657.1)同源性分别为98.09%、99.56%和99.86%,pmrA基因序列与P.aroidearumPC1 同源性分别为97.74%、98.50%和97.71%。基于16S rDNA 和pmrA基因序列系统发育树显示,这3 株菌株与已发表的P.aroidearum菌株聚在一个分支群(图3-A 和3-B)。
2.4 全基因组ANI 值分析
对菌株MY7、MY11、MY18 及 对照P.aroidearumKC20 进行基 因组测 序,并登录在GenBank:3 株菌株的登录号分别为JACERJ000000000、JACERL000000000 和JACERM000 000000;P.aroidearumKC20 基因组序列的GenBank 登录号为JACFXZ000000000。全基因组ANI 分析结果显示,3 株菌株之间的ANI 值介于98.35%~98.46% 之 间,平均值 为98.39%;3 株菌株 与P.aroidearumKC20 菌株之间的ANI 值变化范围为98.19%~98.27%,平均值为98.22%;3 株菌株与NCBI 中P.aroidearumPC1(NC_012 917.1)之间的ANI 值变化范围为98.05%~98.08%,平均值为98.06%,均高于建议的Pectobacterium同 种ANI 阈 值(95%~96%)(Pritchard et al.,2015),而 与Pectobacterium其他16 个成员标准菌株之间的ANI 值均低于该阈值(表1),因此进一步确认本试验分离、纯化得到的MY7、MY11 和MY18 为P.aroidearum。这3 株菌株与P.brasiliense、P.polaris、P.carotovorum、P.aquaticum、P.versatile和P.odoriferum的平均ANI值范围在90.15%~90.76%之间,显示出较近的遗传关系(表1)。
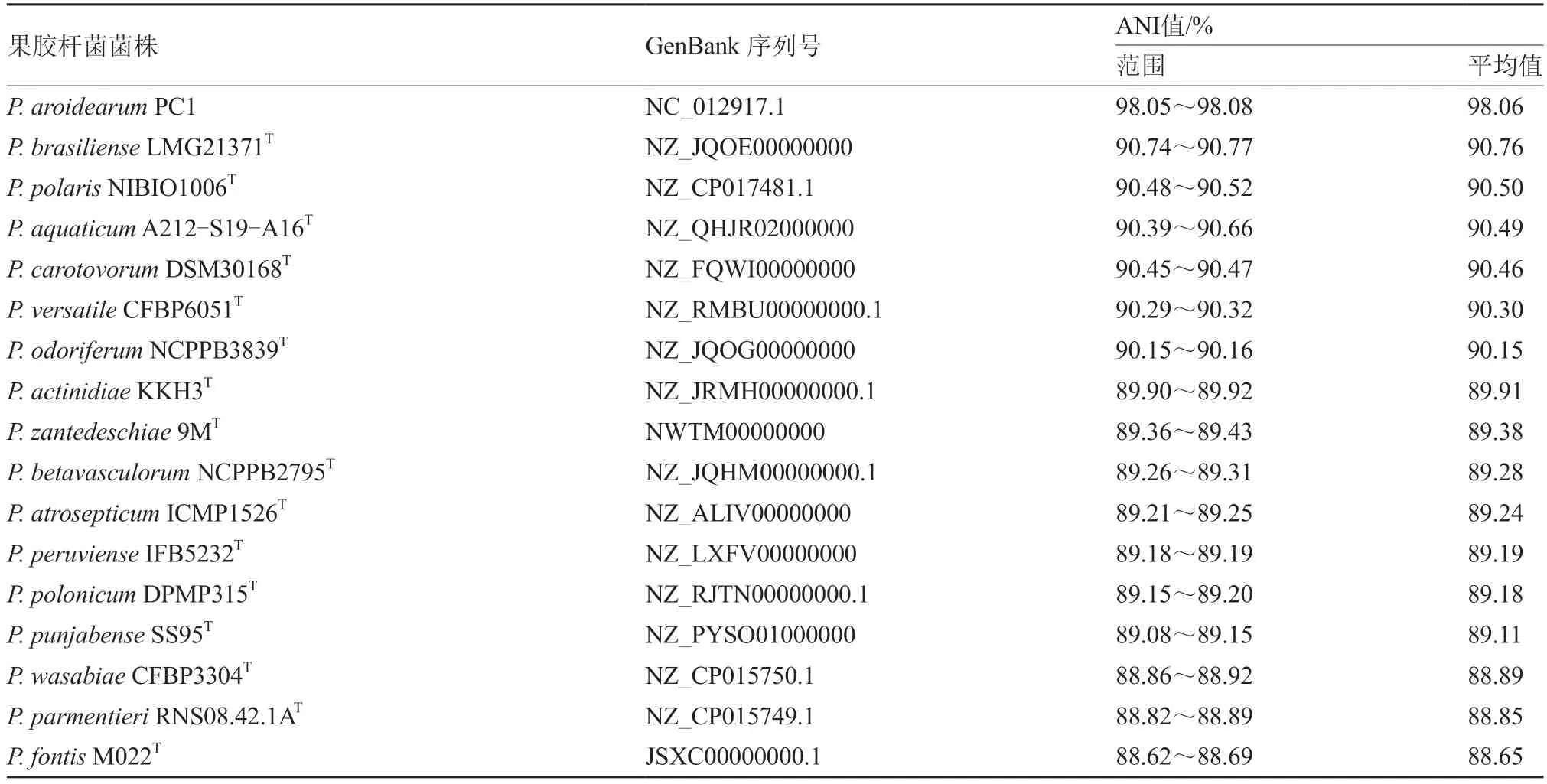
表1 MY7、MY11 和MY18 与17 个Pectobacterium 种菌株全基因组平均核苷酸同源性(ANI)值
2.5 生理生化特性分析
菌株MY7、MY11 和MY18 的生理生化特性表现一致:在5%和7% NaCl 及37 ℃条件下均能正常生长,均可液化明胶,在KB 培养基上均不能产生荧光色素,过氧化氢酶、硝酸盐还原反应呈阳性,磷酸酶、氧化酶和蔗糖还原反应呈阴性,与已报道的P.aroidearumKC20(李晓颖 等,2018)表现一致。Biolog 碳源利用结果表明,MY7、MY11和MY18 均能利用D-纤维二糖、龙胆二糖、蔗糖、β-甲基-D-半乳糖苷、N-乙酰-D-葡萄糖胺、α-D-葡萄糖、D-鼠李糖、D-果糖、D-半乳糖、D-甘露醇、甘油、L-天门冬氨酸、D-葡萄糖二酸、丙酮酸甲酯和溴代丁二酸,均不能利用D-阿糖醇、L-组氨酸、L-焦谷氨酸、奎宁酸、丙酸等作为唯一的碳源。这些特征均与参考菌株P.aroidearumSCRI 109T(Nabhan et al.,2013)、P.aroidearumKC20 及P.aroidearumBYPT3 和WF-2(孙苗苗,2019)表现一致。MY7、MY11 和MY18 均不能利用D-麦芽糖、D-丝氨酸、α-酮戊二酸,不同于参考菌株P.aroidearumSCRI 109T,但与已报道的P.aroidearumKC20、BYPT3 和WF-2 一致。此外,菌株MY11 不能利用L-鼠李糖、M-肌醇,菌株MY18 不能利用D-棉子糖、D-蜜二糖和L-鼠李糖,与参考菌株不同,显示出菌株特异性利用特性(表2)。
2.6 致病力及寄主范围测定
将魔芋软腐病菌菌株MY7、MY11 和MY18分别接种在魔芋块茎和离体、活体的魔芋茎秆上,从表3 可以看出,接种MY18 对魔芋块茎和离体茎段致病力最强,块茎腐烂质量与病斑长度均显著高于MY7 和MY11;MY18 和MY11 对活体植株茎致病力较强,病斑长度显著高于MY7。
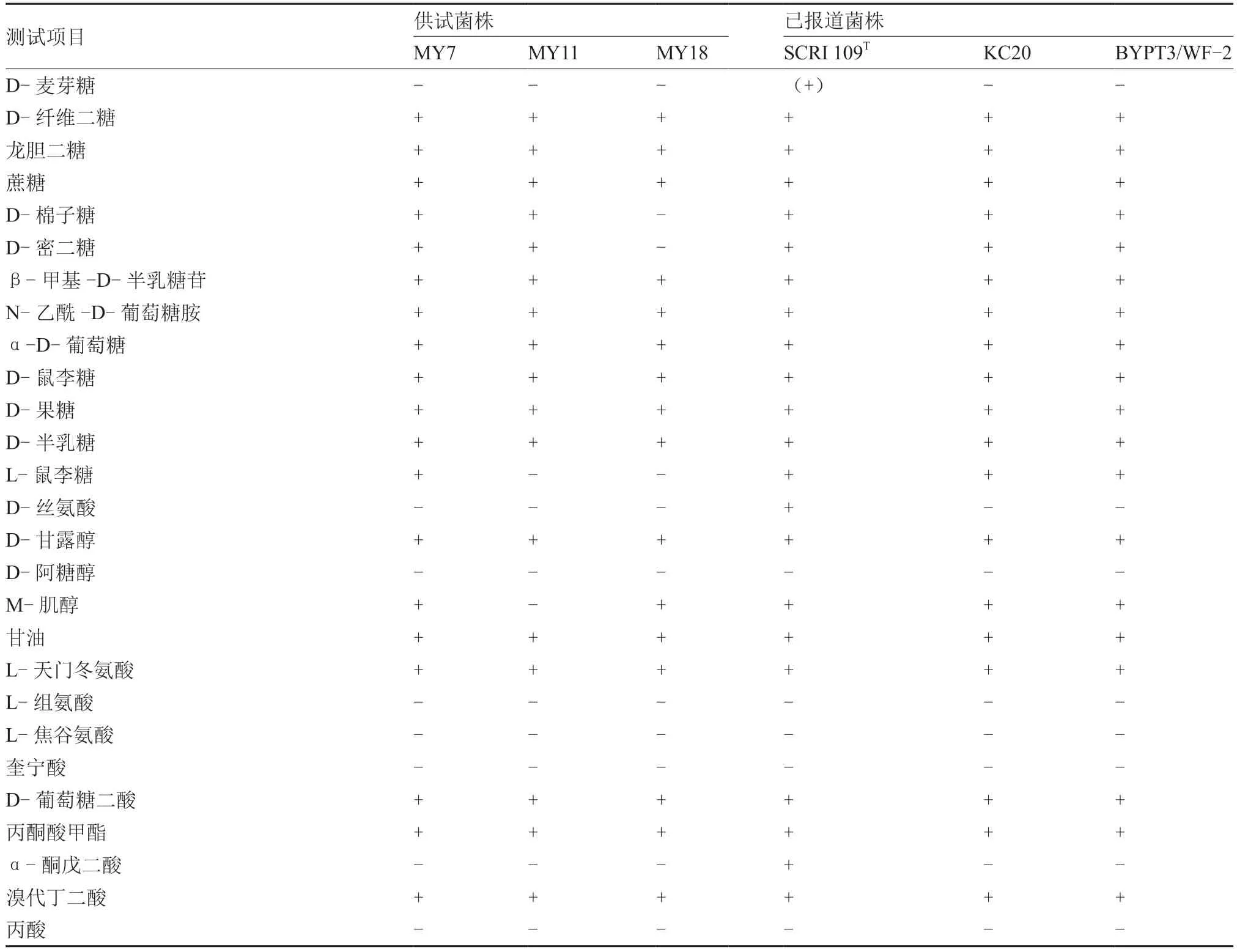
表2 MY7、MY11 和MY18 与报道的P.aroidearum SCRI 109T、KC20、BYPT3 和WF-2 Biolog 生化特性比较
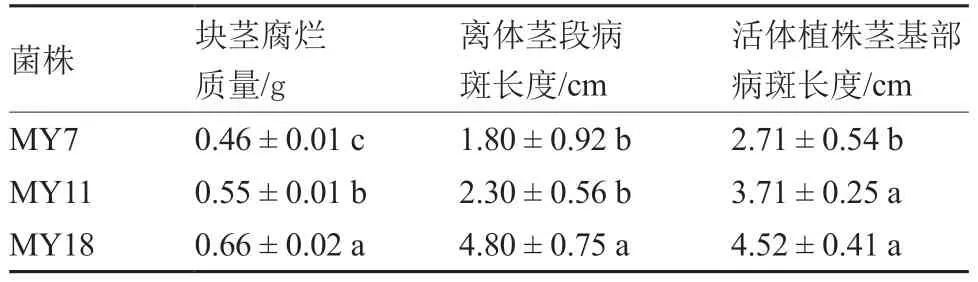
表3 MY7、MY11 和MY18 致病力分析
将MY18 接种胡萝卜、鳄梨、辣椒、马铃薯、西葫芦、大蒜、洋葱、大葱、大白菜、芹菜、叶用莴苣和虎眼万年青,24 h 后均产生明显的软腐症状(图4),其中胡萝卜、鳄梨、辣椒、马铃薯、洋葱、大葱均出现明显的水渍状病斑并散发恶臭气味,西葫芦、大蒜出现浅黄色软腐病斑,大白菜、芹菜、叶用莴苣、虎眼万年青茎基部腐烂软化,表明魔芋软腐病菌菌株没有寄主特异性,能侵染多种植物。
2.7 贝莱斯芽孢杆菌对魔芋软腐病的防治效果
将7 株B.velezensis菌 株(BPC6、BPC16、W1-1、W2-3、W2-4、W2-7 和E2-4)与魔芋软腐病菌菌株MY18 进行平板对峙试验。结果显示,7 株B.velezensis菌株对MY18 均有抑菌效果,其中B.velezensisBPC16、W2-7、W1-1 和E2-4 抑菌带宽度大于BPC6、W2-3 和W2-4(表4)。选择B.velezensisBPC16 和W2-7 菌悬液对盆栽魔芋植株进行灌根处理。结果显示,在茎秆上接种MY18 后,清水(CK)处理的魔芋植株发病率高达78.33%,病情指数达50.46;而经B.velezensisBPC16 和W2-7 处理过的魔芋植株发病率(56.67%和63.33%)及病情指数(28.52 和34.45)均明显降低,与药剂对照3%中生菌素可湿性粉剂8 000倍液差异不显著。B.velezensisBPC16 和W2-7 对魔芋软腐病的防效分别为43.01%和31.99%,其中B.velezensisBPC16 的防效较中生菌素处理提高了9.26百分点(表5),但差异不显著。

表4 贝莱斯芽孢杆菌对MY18 的拮抗效果
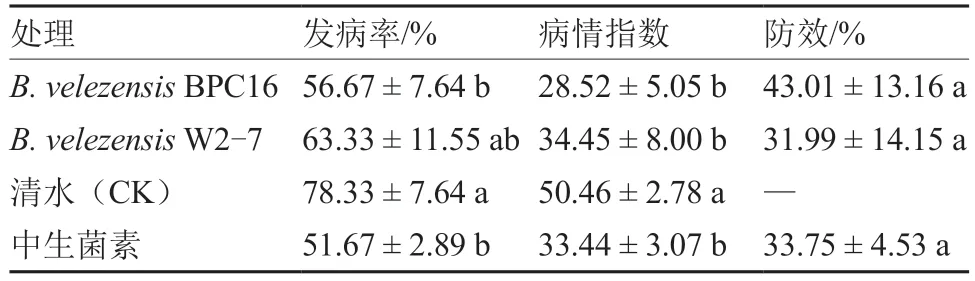
表5 贝莱斯芽孢杆菌BPC16 和W2-7 对魔芋软腐病的盆栽防效
3 结论与讨论
结合形态学、特异引物PCR、16S rDNA 和pmrA基因序列以及全基因组ANI 分析,本试验将2019 年从云南富源、楚雄和四川宜宾3 个主要魔芋种植区软腐病样中分离的软腐病致病菌MY7、MY11 和MY18 鉴定为P.aroidearum。MY7、MY11 和MY18 形态特征符合Pectobacterium的描述(Schaad et al.,2011),包括在LB 固体培养基上为半透明圆形,表面光滑且边缘整齐,能产生果胶酶特性,有鞭毛能运动,属革兰氏阴性杆菌。ITSRFLP 带型分析可用于鉴定果胶杆菌种或亚种,是一种较为准确且快速的分子鉴定方法(Toth et al.,2001)。本试验在Pectobacterium属特异性引物Y1/Y2 均能扩增出预期片段大小产物的基础上,利用ITS-RFLP 在MY7、MY11、MY18 及P.aroidearumKC20 中均获得到条带大小相同的产物,不同于菌 株P.brasilienseBC1、P.odoriferumBCS7 和P.versatileECC71 扩增结果。鉴于采用pmrA基因序列分析区分果胶杆菌种和亚种更加有效(Kettani-Halabi et al.,2013),在16S rDNA 序列分析基础上,基于pmrA基因序列系统发育树分析也将MY7、MY11 和MY18 与其他P.aroidearum菌株聚在一个分支群。全基因组ANI 分析能够快速便捷地比较出不同基因组之间的相似性,且ANI 值达到95%~96%以上定义为一个种(Pritchard et al.,2015)。为进一步确认3 株菌株的分类地位,本试验 将MY7、MY11、MY18 与P.aroidearumKC20及已报道的Pectobacterium17 个成员菌株的基因组序列进行了ANI 分析,结果显示MY7、MY11、MY18 与P.aroidearumK20 和P.aroidearumPC1 之间的ANI 平均值分别为98.22%和98.06%,而与其他Pectobacterium菌株的ANI 值均小于95%。因P.aroidearum标准菌株SCRI 109T尚未报道pmrA基因和全基因组序列,故未能与之进行比较。基于与其他P.aroidearum菌株的pmrA基因序列和全基因组ANI 值比较分析,结合形态学和分子生物学鉴定结果,将MY7、MY11 和MY18 确定为P.aroidearum。
为明确MY7、MY11 和MY18 的生物学特性,几个常规生理生化特性分析表明这3 株菌株都具备在5%和7% NaCl 及37 ℃条件下生长的能力,均可液化明胶,在KB 培养基上均不能产生荧光色素,过氧化氢酶反应呈阳性,磷酸酶、氧化酶和蔗糖还原反应表现为阴性,与已报道的P.aroidearumKC20 表现一致(李晓颖 等,2018)。MY7、MY11和MY18 均能利用D-纤维二糖、龙胆二糖、蔗糖、β-甲基-D-半乳糖苷、N-乙酰-D-葡萄糖胺、α-D-葡萄糖、D-鼠李糖、D-果糖、D-半乳糖、D-甘露醇、甘油、L-天门冬氨酸、D-葡萄糖二酸、丙酮酸甲酯和溴代丁二酸,均不能利用D-阿糖醇、L-组氨酸、L-焦谷氨酸、奎宁酸、丙酸等作为唯一的碳源,这些特征均与P.aroidearumSCRI 109T(Nabhan et al.,2013)、P.aroidearumKC20(李晓颖 等,2018)和P.aroidearumBYPT3及WF-2 表现一致(孙苗苗,2019)。MY7、MY11和MY18 均不能利用D-麦芽糖、D-丝氨酸、α-酮戊二酸的特性,不同于分离自南非的马蹄莲P.aroidearumSCRI 109T,但与已报道的P.aroidearumKC20、BYPT3 和WF-2 一致,可见分离自我国的P.aroidearum菌株表现出较高的一致性。此外,与P.aroidearum菌株不同,菌株MY11 不能利用L-鼠李糖、M-肌醇,菌株MY18 不能利用D-棉子糖、D-蜜二糖和L-鼠李糖,表现出菌株个体间的多样性。
鉴于P.aroidearum在云南富源、楚雄和四川宜宾魔芋主要种植区,以及湖北宜昌(孙苗苗,2019),云南西双版纳和德宏(魏环宇 等,2020)等地引发软腐病,对魔芋的生产带来很大的威胁,本试验开展了贝莱斯芽孢杆菌生物防效分析。贝莱斯芽孢杆菌在植物病害,包括细菌性病害致病菌的生物防治方面显示出良好的防治效果,如梨火疫病菌Erwinia amylovora和胡萝卜果胶杆菌P.carotovorum(Liu et al.,2017)、生菜软腐病菌P.carotovorum(孙旺旺 等,2020)等。但鲜见贝莱斯芽孢杆菌对魔芋软腐病菌P.aroidearum的防治效果研究。本试验利用7 株贝莱斯芽孢杆菌(BPC6、BPC16、W1-1、W2-3、W2-4、W2-7 和E2-4)对峙P.aroidearumMY18 均有抑制效果;在盆栽防效试验中,B.velezensisBPC16 和W2-7 处理过的魔芋植株软腐病发病率及病情指数均明显降低,防效分别为43.01%和31.99%,显示出B.velezensis在有效防治魔芋软腐病方面的应用潜力。

