用于黄曲霉素B1检测的表面增强型荧光光学传感器
陈海虹,张 玲
(上海理工大学 光电信息与计算机工程学院,上海 200093)
引 言
在湿热的环境中,农副产品及动物饲料的表面极其容易产生霉菌。霉菌的次生代谢产物是真菌毒素,黄曲霉素B1(aflatoxin B1,AFB1)作为真菌毒素的一种,它的毒性最强且具有强致癌性,严重影响人体健康[1-4]。为了防止对动物和人体产生负面影响,许多国家规定了饲料和农副产品中AFB1的含量。欧盟规定直接供人类食用的食物中AFB1含量不得超过2 μg/kg,日本规定不得超过10 μg/kg,中国规定不得超过20 μg/kg。因此,针对微量AFB1的检测对于公共卫生及食品安全至关重要。
目前,常规的AFB1检测方法主要有高效液相色谱法(high-performance liquid chromatography,HPLC)[5],液相色谱/质谱法(liquid chromatography/mass spectrometry, LC/MS)[6],酶联免疫吸附法(enzyme-linked immunosorbent assay, ELISA)[7]和电化学法(electrochemical method, EM)[8]等。以上几种检测分析方法,灵敏度较高,重复性较好,但是处理样品的手段相对较繁琐,并且需要昂贵的仪器和专业的检测人员操作,因此需要开发一种便捷、灵敏、经济的检测方式。表面增强荧光(surface-enhance fluorescence, SEF)是利用金属纳米颗粒和纳米结构金属薄膜等纳米金属材料在光的激发下产生局域表面等离子体共振来提高荧光团的发光效率。它被广泛应用于生物传感[9]、医学成像[10]及光电子器件[11]等领域。纳米多孔金(nanoporous gold, NPG)是一种新型的纳米金属材料,在三维结构上具有双连续贯通无序的纳米网状孔结构。与其他金属纳米结构比较,它具有高比表面积,高活性位点,结构尺寸连续可调并且稳定性较好[12-13]。正是由于它的特殊结构,使得其在受到光激发时可以产生比较强的局域电磁场,从而提高荧光团发光效率。
利用纳米多孔金作为荧光增强基底进行AFB1检测,将标记有花氰素(Cy5)的核酸适体DNA1与另一条与DNA1互补的核酸适体DNA2共同组装在NPG表面,形成功能化的检测芯片。通过AFB1与DNA1竞争结合导致的Cy5荧光信号强度的变化实现对黄曲霉素B1的痕量检测,检测极限高达10-7μg/L,并且基底表现出4个量级的动态响应范围,可用于AFB1的定性定量检测。
1 实验原理
利用Cy5标记的AFB1适配体即在3′端修饰一个 Cy5分子(5′-GTTGG GCA CGT GTT GTC TCT CTG TGT CTC GTG CCC TTC GCT AGG CCC-3′-cy5, Cy5-DNA1)和在 5′端修饰硫醇键的(SH-5′-CAGAGAGACAACACGTGCCCAA C-3′, SH-DNA2)[14]AFB1 互补适配体,开发了一种新型的基于NPG的表面增强荧光传感器用于AFB1检测(见图1)。金和硫醇间存在特殊的化学键,因而在NPG表面可以固定大量的SH-DNA2。根据碱基配对原则,Cy5标记的DNA1将与DNA2形成核酸双链,依附在NPG表面。未加入AFB1状态下,基于NPG局域电磁场增强特性,可得到来自荧光标记分子Cy5较强的荧光信号;加入AFB1分子后,由于AFB1与DNA1序列存在竞争结合DNA2的特性,导致DNA1与DNA2之间的键合断裂,而AFB1与DNA2键合留于NPG表面,随着AFB1量的增加,位于NPG表面的Cy5标记的DNA1逐渐减少,导致来自Cy5的荧光信号减弱。因此,通过测量Cy5的荧光强度可间接判断溶液中AFB1的质量浓度。
2 实验步骤
2.1 多孔金基底制备

图 1 AFB1 光学检测芯片原理图Fig. 1 The schematic diagram of the optical sensor of AFB1
实验所用的多孔金基底采用一步脱合金法制备。根据金属在酸中的活泼性差异,将金银合金浸泡在浓硝酸溶液中,Ag原子被选择性腐蚀后以离子形式融入硝酸,残留的Au原子经过自由扩散组装成具有连续韧带和孔洞的纳米网状结构。其韧带和孔洞大小可通过控制前躯体合金成分、 腐蚀电位、脱合金时间及后期退火进行调控。实验采用100 nm厚的Ag65Au35(原子百分比为Ag65%,Au35%)薄膜为前躯体,在室温下使用65%浓硝酸进行自由脱合金反应,通过控制脱合金时间得到不同孔径的NPG薄膜,然后将NPG薄膜反复浸泡在超纯水中清洗多次以去除残留的酸液。最后将NPG固定在塑料基板(polymer)上干燥备用。
2.2 多孔金基底表面功能化
制作用于AFB1检测的生物传感器通过在4℃环境中,将NPG薄膜先后浸泡在10 mol/L SHDNA2 磷酸缓冲溶液(phosphate buffer solution,PBS)和20 mol/L Cy5-DNA1 PBS中各12 h进行功能化处理(见图1)。利用硫醇键将DNA2固定在NPG表面,然后通过浸泡使DNA1与DNA2之间形成双螺旋结构,共同组装在多孔金表面,形成功能化的基底。将已经修饰好的基底取出,在去离子水中反复浸泡,清洗掉游离态的核酸适配子,放在PBS中4℃保存待测。
2.3 荧光光谱采集
采用 Nikon显微镜和上海复享NOVA制冷型光谱仪进行荧光光谱检测,测试系统及测试方法如图2所示。在荧光光谱检测过程中,将光学基底置于磷酸缓冲溶液(PBS,pH=7.4)中保持DNA的活性。通过滴加不同质量浓度的AFB1溶液来改变测试环境中的AFB1浓度。由于荧光标记分子Cy5在可见光波段的吸收峰值位于650 nm左右[12],基于共振效应,使用红色激光可以得到更好的增强效果。因此,以632 nm激光作为激发波长,激发功率为0.03 mW,采集时间为120 s,每条谱线为基底表面5个不同位点的平均光谱。
3 结果和讨论
由于NPG的荧光增强特性与孔径相关,为了使荧光信号尽可能放大,制备了不同孔径的NPG薄膜,并对其荧光增强特性进行比较。图3(a)~(c)分别为腐蚀时间为 1,5,10 min所得NPG的扫描电镜图(scanning electron microscope, SEM)。腐蚀1 min的NPG孔径约为5 nm,腐蚀10 min的NPG孔径约为13 nm,并且孔状结构均匀。图3(d)为固定在不同孔径多孔金表面的Cy5荧光光谱,由图可见,Cy5荧光信号强度随着多孔金孔径的增大而增强。当NPG孔径约为13 nm时,多孔金基底表现出更好的荧光增强特性。

图 2 黄曲霉素B1的荧光光谱测试系统及方法Fig. 2 Fluorescence spectrum system and method of testing aflatoxin B1

图 3 不同腐蚀时间的NPG基底扫描电镜图及其荧光增强特性谱线Fig. 3 The SEM of NPG with different corrosion time and its fluorescence enhancement spectra
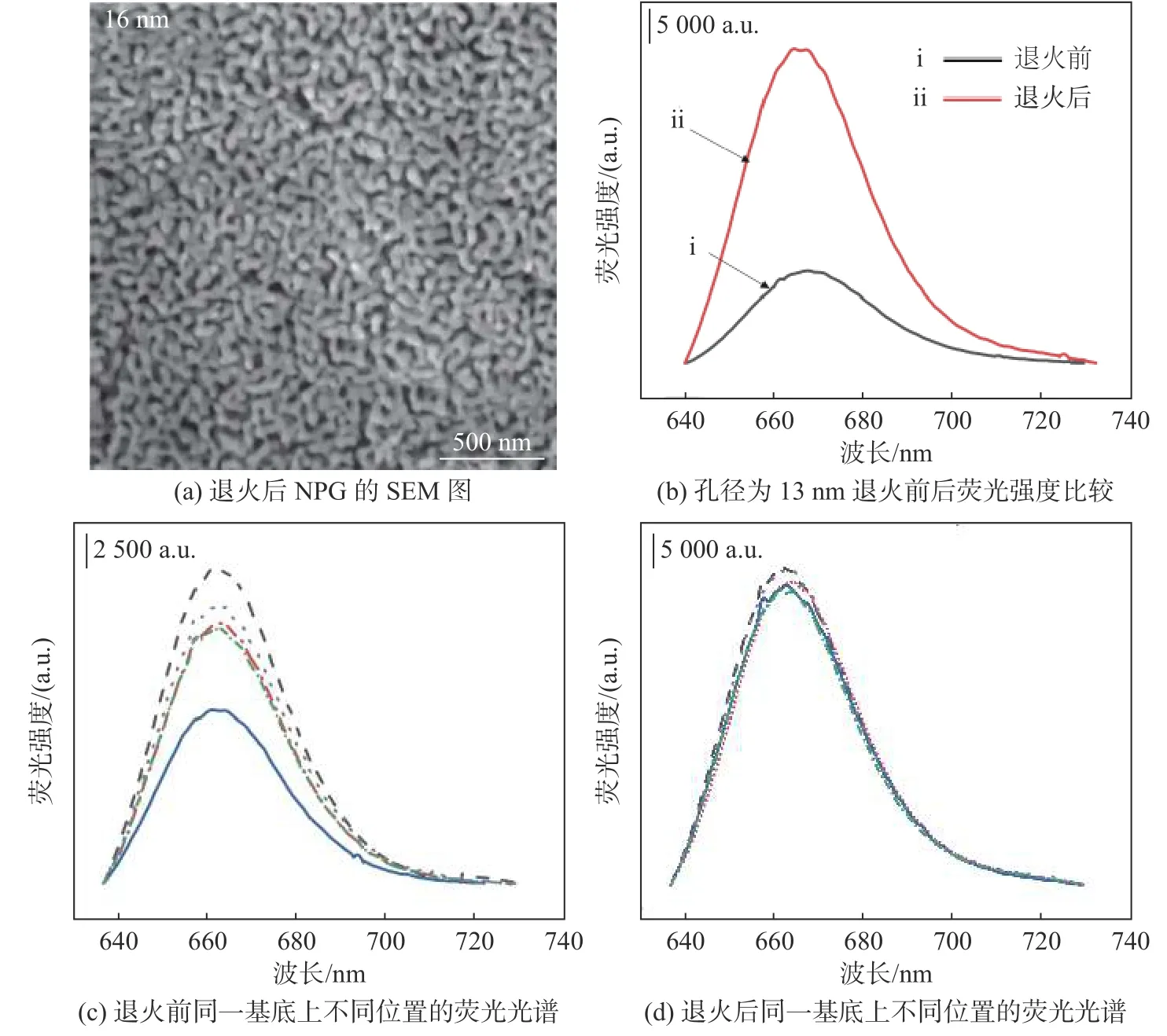
图 4 退火对基底结构及荧光增强特性的影响Fig. 4 Annealing influnce on the microstructure and SEF property of substrate
为了增强100 nm厚的NPG薄膜与支撑基板polymer之间的结合力,提高芯片整体的稳定性和可操作性,采用低温退火的方式适度软化polymer增强附着力,进而实现NPG薄膜与polymer一体化。图4(a)为将固定在polymer上的13 nm NPG(NPG13) 置于真空干燥箱中,在100 ℃退火2 h之后所得基底的扫描电镜图。通过比较图3(c)和图4(a)发现,退火后的 NPG孔径轻度粗化,从13 nm(NPG13)扩大到了16 nm(NPG16)。为了确认退火是否影响NPG的荧光增强特性,对退火后的NPG16表面进行核酸适体功能化处理。组装了SH-DNA2和Cy5-DNA1序列之后的NPG16表面的荧光光谱显示在图4(b)中,比较退火前后来自Cy5的荧光信号可见,退火在一定程度上可以进一步提高芯片的荧光增强特性。同时比较图3(c)和图4(a)可以发现,退火之后的NPG表面比退火前更加均匀。这一点通过在同一样品上不同位置Cy5的荧光光谱(见图 4(c)和图 4(d))可以得到进一步的印证。在后续实验中,为了保证光学芯片的均匀性以及耐用性,选择退火后的NPG16作为光学芯片的基底材料。
以NPG16为增强基底,通过核酸适体进行表面功能化,随后浸泡在不同浓度的AFB1中进行荧光光谱检测,观察荧光强度变化与AFB1之间的关系。当检测环境中没有AFB1时,Cy5-DNA1通过碱基配对原则与固定在NPG表面的SH-DNA2形成稳定的核酸双螺旋结构,测得荧光光谱强度为I0。当加入AFB1后,由于AFB1和Cy5-DNA1产生竞争性结合,SH-DNA2和Cy5-DNA1中的配对碱基发生解离,游离态Cy5-DNA1远离NPG表面,导致Cy5的荧光强度减弱,此时测得荧光光谱强度为I。因此,Cy5的荧光强度变化与环境中AFB1的浓度相关。图5(a)为浸泡在PBS及不同浓度的AFB1溶液中芯片表面检测到的来自于Cy5的荧光光谱。由图可见,随着AFB1的质量浓度的增加,来自于Cy5的荧光信号越来越弱,表明越来越多的Cy5-DNA1与DNA2解离,游离到溶液中,导致基底对其失去增强特性,引发基底表面整体荧光信号的衰减。为了清楚的显示荧光强度与AFB1浓度之间的关系,我们对不同环境下基底表面的荧光强度进行了归一化处理(见图5(b)),以PBS中来自Cy5的665 nm峰为参照。由图5(b)可见,当溶液中存在质量浓度为10-7μg/L的AFB1时,荧光强度衰减了近10%;当溶液中AFB1质量浓度提高到10-6μg/L时,荧光强度衰减了20%;随着AFB1质量浓度的增加,荧光强度逐渐衰减,当AFB1质量浓度为10-2μg/L时,荧光强度基本变为初始强度的一半。同时发现,在AFBI质量浓度低时,芯片表现出更好的灵敏度,而随着AFBI质量浓度的增加,荧光强度衰减比例有所减小,分析主要原因是,基底表面组装的核酸适体数量有限,随着AFB1质量浓度的提高,Cy5-DNA1与AFB1的数量差异在扩大,基底本身在向饱和状态转化,因此衰减速率有所下降。基于目前多孔金基底表面功能化条件,在10-6μg/L到10-2μg/L动态范围内,荧光信号强度与AFB1质量浓度表现出较好的线性关系,检测极限可达10-7μg/L,远小于传统检测技术的检测极限3.3×10-4μg/L[8]和同类荧光检测技术的检测极限3×10-4μg/L[15]。可以预见,通过控制多孔金表面组装核酸适体的数量,可进一步提高检测灵敏度和扩大检测动态响应范围。
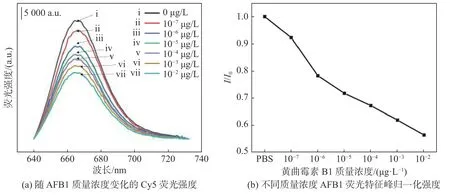
图 5 Cy5 荧光强度与 AFB1 质量浓度关系图Fig. 5 Relationshio between Cy5 fluorescence intensity and AFB1 mass concentration
4 结 论
本文利用AFB1和Cy5-DNA1之间的竞争结合关系,成功研制了一种新型表面增强荧光基底,实现了对AFB1的痕量检测。基于这个新型光学基底,检测极限达到10-7μg/L,远低于直接供人类食用的食品中AFB1标准,同时,基底表现出4个量级的线性动态响应范围,为实现不同浓度的AFB1检测提供了可能性。该方法可通过改变特异性核酸适体拓展到其他真菌毒素的检测,具有潜在的应用价值。

