基于体重指数分类的三酰甘油/高密度脂蛋白胆固醇比值与非酒精性脂肪肝发病风险的剂量反应关系
康晓平 何件根 郭秀花 武 亮 张雪松
1.北京小汤山医院院办,北京 102211;2.北京小汤山医院运动康复科,北京 102211;3.首都医科大学公共卫生学院,北京 100069
非酒精性脂肪肝(nonalcoholic fatty liver disease,NAFLD)是一种与胰岛素抵抗(insulin resistance,IR)和遗传易感密切相关的代谢应激性肝损伤,其疾病谱包含单纯脂肪肝、非酒精性脂肪性肝炎、肝硬化和肝细胞癌[1]。NAFLD 已经成为我国第一大慢性肝病,全国患病率高达20.09%[2]。NAFLD 不仅可以导致肝病残疾或死亡,还与慢性肾病、代谢综合征、2 型糖尿病、动脉硬化性心血管等疾病的发病率增高密切相关[3-7]。但是,NAFLD 发病隐匿,无明显的临床症状。而且非超重人群因缺乏肥胖的体征更容易被忽视NAFLD 发病的可能,是隐源性肝病的常见病因[8]。
IR 在NAFLD 发病过程中发挥重要作用,且三酰甘油/高密度脂蛋白胆固醇(TG/HDL-C)比值已经被证实是IR 的血清学标志物和预测指标之一[9]。但是,有关TG/HDL-C 比值与NAFLD 的发病风险研究为数不多,且两者的剂量反应关系目前尚未见报道。此外,现有的研究未考虑超重和非超重人群临床特征的不同对两者关系的影响。因此,本研究基于大型前瞻性队列研究,在超重和非超重人群中分别探索TG/HDL-C 比值与NAFLD 的发病风险的剂量反应关系。从而为NAFLD 的早期预防和早期发现提供依据。
1 对象与方法
1.1 研究对象
本研究采用前瞻性队列研究,研究对象为“北京健康管理队列”(北京小汤山医院、北京市体检中心等)在2012 年1 月的体检者。随访至2016 年12 月观察NAFLD 的发病情况。本研究纳入标准:①年龄≥18 岁;②乙醇摄入量男性<140 g/周,女性<70 g/周;③基线和随访时相关分析指标信息齐全。排除标准:①基线时患有NAFLD;②失访或信息缺失;③患有病毒性肝炎、慢性肝炎、肝硬化、药物性肝病、肝豆状核变性等肝肾疾病。研究对象的筛选流程图如图1 所示,最终纳入6495 名研究对象,根据体重指数(body mass index,BMI)将其分为非超重人群和超重人群。本研究经过首都医科大学医学伦理委员会的批准,所有研究对象都签署了书面知情同意书。
1.2 资料收集
采用问卷调查收集研究对象的基本情况、行为生活习惯和既往用药史。使用立柱式身高体重测量仪测量受检的身高和体重,并计算BMI,BMI=体重/身高2(kg/m2),超重的定义为BMI≥24.0 kg/m2[10]。由体检中心影像学专业的医师进行超声检查。依据《中国非酒精性脂肪性肝病防治指南(2018 年更新版)》[1],有弥漫性肝细胞脂肪变的影像特征,并且要排除乙醇(酒精)滥用等可以导致肝脂肪变的其他病因,即可诊断为NAFLD。
图1 研究对象筛选流程图
收集清晨空腹外周静脉血,使用贝克曼LX20(Beckman LX 20,America)全自动免疫分析系统检测TG、HDL-C、谷丙转氨酶等指标。计算TG/HDL-C 值。
1.3 统计学方法
采用SAS 9.4 统计学软件对所得数据进行分析,计量资料符合正态分布采用均数±标准差()表示,组间比较采用t 检验,计量资料不符合正态分布以中位数(四分位数)[M(P25,P75)]表示,比较采用Kruskal-Wallis 秩和检验,计数资料采用例数或百分率表示,组间比较采用χ2检验。按照整体人群、非超重和非超重人群分别采用非条件logistic 回归模型分析TG/HDL-C与NAFLD 发病风险之间的关系。采用限制性立方样条分析TG/HDL-C 与NAFLD 发病风险之间的剂量反应关系。以P <0.05 为差异有统计学意义。
2 结果
2.1 不同体重指数分层的研究对象基线特征比较
在随访4 年间,NAFLD 发病率为18.37%。其中非超重人群NAFLD 发病率为10.08%,超重人群的NAFLD 发病率为36.70%,两者NAFLD 发病率比较,差异有统计学意义(χ2=657.79,P <0.01)。基线时研究对象的一般情况如表1 所示。与非超重人群比较,超重人群TG/HDL-C 比值较大,差异有统计学意义(H=23.38,P <0.01)。
2.2 不同体重指数分层的TG/HDL-C 比值与NAFLD发病风险的关系
在整体人群中,模型3 的结果显示TG/HDL-C 比值与NAFLD 发病风险之间存在统计学关联(OR=1.84,95%CI:1.64~2.06)。在非超重人群中,单因素模型(模型1)的结果显示TG/HDL-C 比值与NAFLD 发病风险之间也存在统计学关联(OR=2.25,95%CI:1.89~2.67);校正协变量后(模型3),TG/HDL-C 比值每增加1 个单位,NAFLD 发病风险增加1.25 倍。在超重人群中,单因素分析结果显示TG/HDL-C 比值与NAFLD 发病风险之间存在统计学关联(OR=1.85,95%CI:1.63~2.10)。校正协变量后,TG/HDL-C 比值每增加1 个单位,NAFLD 发病风险增加50%。见表2。
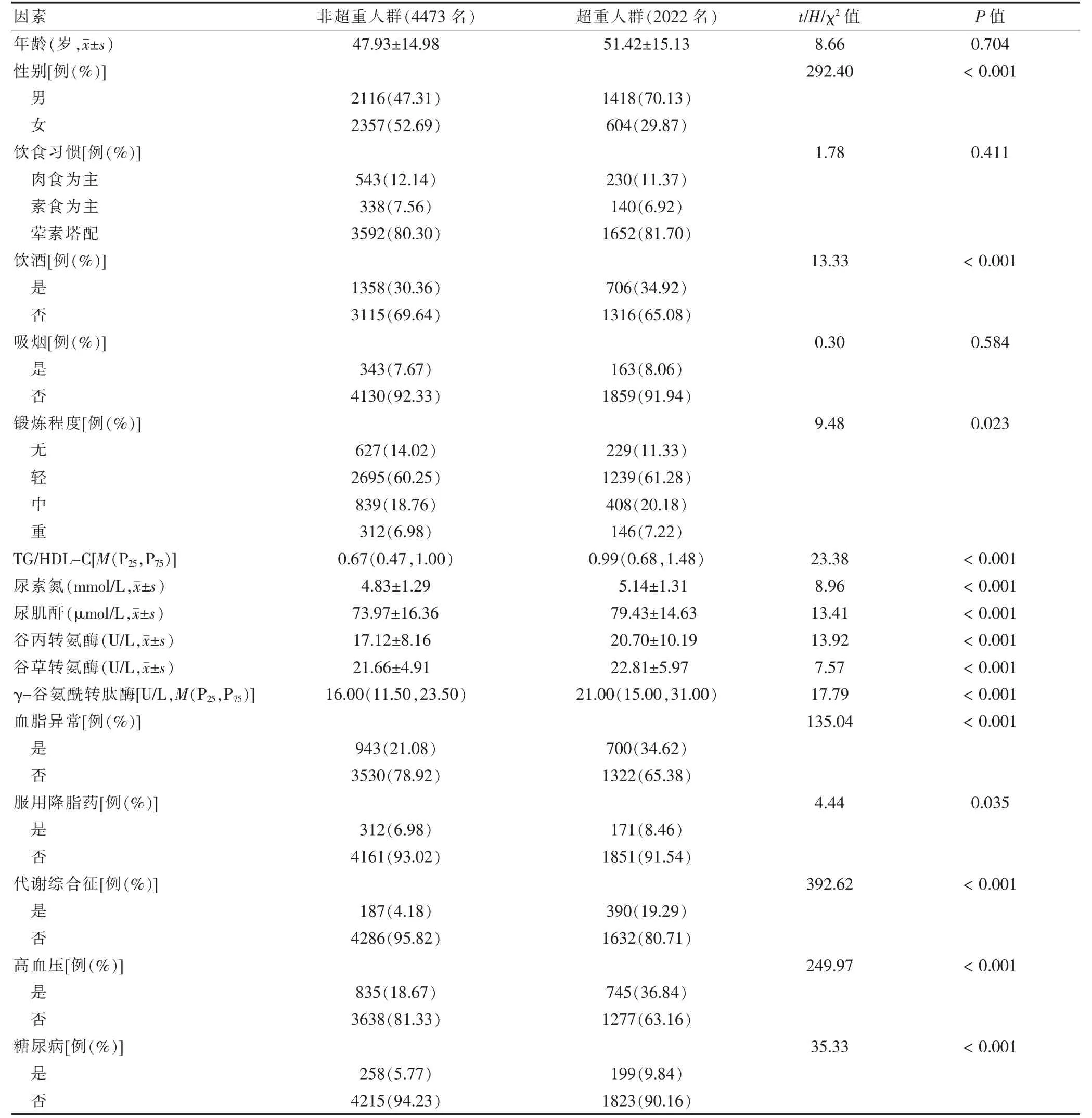
表1 不同体重指数分层的研究对象基线特征比较
2.3 TG/HDL-C 比值与NAFLD 发病风险的剂量反应关系
基于限制性立方样条分析的TG/HDL-C 比值与NAFLD 发病风险的剂量反应关系见图2。在整体人群中,随着TG/HDL-C 比值的增大,NAFLD 发病风险呈线性增加(线性检验:P <0.001)(图2A)。在非超重人群中,TG/HDL-C 比值与NAFLD 发病风险呈线性相关(线性检验:P <0.001),且TG/HDL-C<1 时,即可以增加NAFLD 的发病风险(图2B)。在超重人群中,TG/HDL-C 比值与NAFLD 发病风险也呈线性相关(线性检验:P <0.001)。见图2C。

表2 不同体重指数分层的TG/HDL-C 比值与NAFLD 发病风险的关系[OR(95%CI)]
3 讨论
NAFLD 已逐渐成为全世界范围内的最主要的慢性肝病之一,严重危害人民群众的生命健康[17-18]。然而,NAFLD 发病隐匿,迫切需要临床研究加强血清学标志物的研究和临床应用为NAFLD 的无创性诊疗和预防治疗提供科学依据。
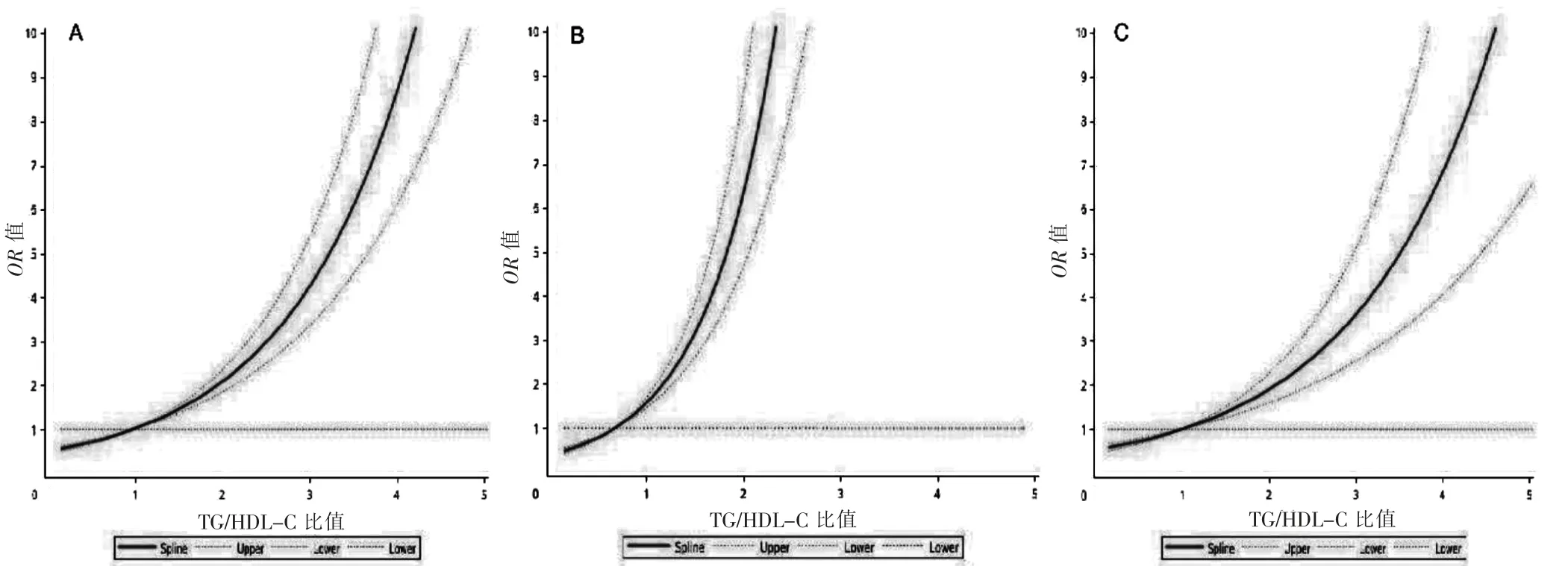
图2 TG/HDL-C 比值与NAFLD 发病风险的剂量反应关系
NAFLD 患者中血脂异常的临床特征多为TG 和HDL-C 降低[19-20]。但是有关TG/HDL-C 比值对NAFLD发病风险的影响的研究为数不多。林仿等[21]分析的结果基于335 名研究对象随访3 年的数据分析了TG/HDL-C 比值与NAFLD 的预测价值,结果表明TG/HDL-C 比值与NAFLD 发病风险之间存在统计学关联。但是该研究未考虑代谢综合征、糖尿病、高血压等因素的影响。本研究调整了较多混杂因素后,发现NAFLD 的发病风险随着TG/HDL-C 比值的增大而升高,且进一步采用限制性立方样条分析证明了两者之间为线性剂量反应关系。TG/HDL-C 比值与NAFLD发病风险相关的机制可能有:肝脏是脂肪代谢的重要场所,当血液中的TG 增多超过肝脏的正常负荷会引起肝脏脂质浸润,从而导致肝内脂肪分解增加、肝内游离脂肪酸摄取增加、极低密度脂蛋白合成增加以及脂肪酸氧化及TG 输出的减少,导致肝脏内脂质沉积[22-23]。其次,肝脏中部分游离脂肪酸会以极低密度脂蛋白的形式输出,增加的极低密度脂蛋白会导致HDL-C 降低,进而抑制了氧化低密度脂蛋白氧化的逆向转运和促进了低密度脂蛋白的氧化,增加NAFLD的发生风险[24-25]。
目前,随着NAFLD 在非超重人群中的发病率的增加,区分非超重和超重人群研究NAFLD 是必要的,以便提供特定的预防或治疗措施[3]。本研究对象在随访4 年间,非超重人群中NAFLD 发病率为10.08%。这与Sun 等[26]研究结果相近,在随访5 年NAFLD 的发病率为10.87%。而且本研究还发现在非超重人群中TG/HDL-C 比值<1 时,即可以增加NAFLD 的发病风险。这些结果提示非超重人群中也会存在NAFLD的发病风险,且血脂异常或IR 症状较轻时,便可能增加NAFLD 的发病风险。因此,在临床中也应重视该特殊群体的NAFLD 的预防工作。

