胃癌患者全胃切除术后早期肠内营养的方式及临床功效
卫二强
(陕西省核工业二一五医院,陕西 咸阳)
针对胃肠外科收治的需实施全胃切除术胃癌患者,在常规状态下术后要进行全肠外营养以及胃肠减压处理,然而全肠外营养虽然起到一定的营养支持,但是由于缺少食物造成的刺激,对患者的肠蠕造成一定的抑制,促使其消化液分泌情况受到影响,引起一系列并发症发生,例如:胃肠功能紊乱[1-2]。所以,针对实施全胃切除术胃癌患者,给予早期肠内营养是十分重要的,该方式不仅可改善或者是保持患者器官结构、功能以及组织等,还具有极高的安全性[3-4]。因此,本研究选择2017 年3 月至2019年3 月我院接诊的胃癌患者100 例为对象,探究胃肠外科早期给予实施全胃切除术胃癌患者术后肠内营养效果,现报道如下。
1 资料与方法
1.1 一般资料
本研究2017 年3 月至2019 年3 月我院接诊的胃癌患者100例为对象,随后根据实施给予营养方式不同将其均分为两组,包括50 例A 组和50 例B 组。其中50 例A 组患者通过胃肠营养管给予早期肠内营养,男性28 例,女性22 例,年龄最小37 岁,最大79 岁,平均(58.3±2.6)岁。而50 例B 组则通过静脉给予全肠外营养,男性26 例,女性24 例,年龄最小36 岁,最大78 岁,平均(56.5±2.3)岁。以上100 例患者全部实施胃镜以及术后病理诊断确诊为胃癌疾病,并且均未出现严重慢性疾病或者是心血管疾病等,所有患者肝肾功能没有出现较为明显的异常,同时实施手术治疗前均未接受抗肿瘤治疗。对以上100 例患者相关基线资料加以比对,结果显示组间数据并无统计学意义(P>0.05)。
1.2 方法
1.2.1 手术治疗
两组患者入院后全部进行气管插管全身麻醉处理,随后进行全胃切除,完成后消化道实施食管空肠Roux-en-Y 吻合术,术后对患者实施常规的放置胃管;其中A 组手术实施过程中将空肠营养送至其空肠吻合口远端处。两组患者手术治疗后全部给予相同的抗生素进行干预,时间为5 d。
1.2.2 术后营养支持方式
A 组:手术完成的第1 天通过胃肠营养管将250~500 mL 的生理盐水缓慢的给予,让患者的胃肠能够有一个适应期,查看患者有无出现不适感;随后术后第2 天将瑞能(批准文号:国药准字H20040722 生产厂家:华瑞制药有限公司)注入胃肠营养管内,初始流速控制在每小时50 mL,若患者未出现呕吐、腹泻、恶心以及腹胀等症状,慢慢增加输注速度,4~6 d 以后将胃管拔除,恢复正常饮食;在进行输注的过程当中,每4 h 便将20 mL温开水将鼻腔管进行1 次冲洗,防止营养液将胃肠营养管堵塞。
B 组:术后查看患者有无发生循环功能障碍,随后对患者实施静脉营养支持,按照患者校正系数以及能够消耗情况做相应调整,4~7 d 后恢复正常饮食。
1.3 评判标准
对比手术前后两组患者各项营养指标,包括:Alb(白蛋白)、TP(血清总蛋白)和体重)、各项肝功能指标[主要包括:AST(谷草转氨酶)、DB(直接胆红素)、ALT(谷丙转氨酶)、TB(总胆红素)和IB(间接胆红素)];术后恢复情况,包括:住院时间、进食流食时间以及术后通气时间。
1.4 统计学方法
表1 对比两组患者治疗前后各项肝功能指标改善情况(±s)
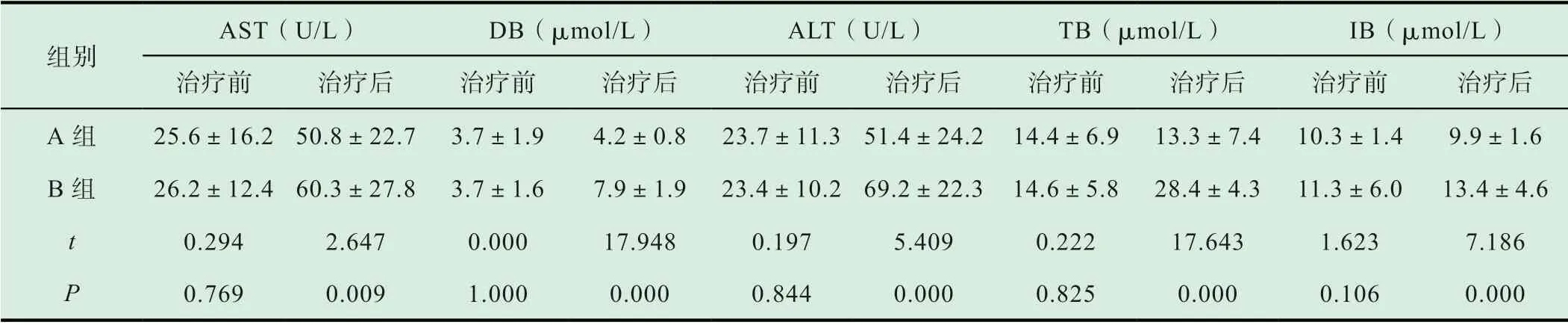
表1 对比两组患者治疗前后各项肝功能指标改善情况(±s)
组别AST(U/L) DB(μmol/L) ALT(U/L) TB(μmol/L) IB(μmol/L)治疗前 治疗后 治疗前 治疗后 治疗前 治疗后 治疗前 治疗后 治疗前 治疗后A 组 25.6±16.2 50.8±22.7 3.7±1.9 4.2±0.8 23.7±11.3 51.4±24.2 14.4±6.9 13.3±7.4 10.3±1.4 9.9±1.6 B 组 26.2±12.4 60.3±27.8 3.7±1.6 7.9±1.9 23.4±10.2 69.2±22.3 14.6±5.8 28.4±4.3 11.3±6.0 13.4±4.6 t 0.294 2.647 0.000 17.948 0.197 5.409 0.222 17.643 1.623 7.186 P 0.769 0.009 1.000 0.000 0.844 0.000 0.825 0.000 0.106 0.000
2 结果
2.1 对比两组患者治疗前后各项肝功能指标改善情况
如表1 所示,治疗前两组患者各项肝功能指标水平有可比性(P>0.05);治疗后与B 组患者相比较,A 组患者AST、DB、ALT、TB 和IB 水平显著偏低(P<0.05)。
2.2 对比两组患者治疗前后各项营养指标改善情况
如表2 所示,治疗前两组患者各项营养指标有可比性(P>0.05);治疗后与B 组患者相比较,A 组患者TP、Alb 和体重无明显差异(P>0.05)。
表2 对比两组患者治疗前后各项营养指标改善情况(±s)
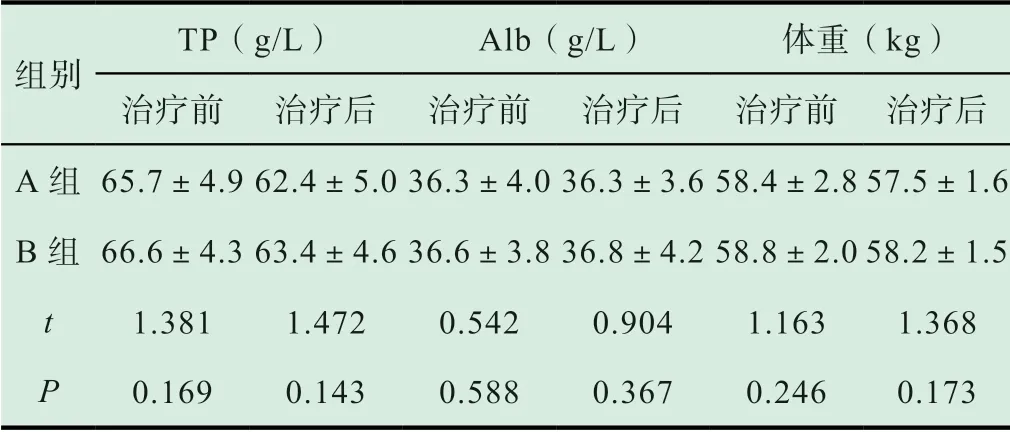
表2 对比两组患者治疗前后各项营养指标改善情况(±s)
组别TP(g/L) Alb(g/L) 体重(kg)治疗前 治疗后 治疗前 治疗后 治疗前 治疗后A 组65.7±4.9 62.4±5.0 36.3±4.0 36.3±3.6 58.4±2.8 57.5±1.6 B 组 66.6±4.3 63.4±4.6 36.6±3.8 36.8±4.2 58.8±2.0 58.2±1.5 t 1.381 1.472 0.542 0.904 1.163 1.368 P 0.169 0.143 0.588 0.367 0.246 0.173
2.3 对比两组患者治疗后恢复情况
如表3 所示,治疗后与B 组患者相比较,A 组患者住院时间、进流食时间以及术后通气时间显著偏短(P<0.05)。
表3 对比两组患者治疗后恢复情况(±s)

表3 对比两组患者治疗后恢复情况(±s)
组别 住院时间(d)进流食时间(h)术后通气时间(h)A 组 15.3±3.5 74.4±20.2 55.7±18.8 B 组 19.8±5.4 87.7±23.8 70.1±17.3 t 6.993 4.261 5.636 P 0.000 0.000 0.000
3 讨论
随着肠外营养支持的不断推广以及认识,肠外营养治疗促使患者出现不同程度的并发症,例如:肠道黏膜废用、萎缩或者是屏障功能异常[5]。据相关研究人员指出,实施腹部手术后,主要为结肠与胃麻痹。其中小肠的吸收功能以及运动功能可在短时间内恢复,全胃切除术后给予早期肠内营养是可行的[6]。由于胃癌患者病情原因影响,导致出现营养不良发生率显著偏高,患病后患者的总摄入量明显降低,实施胃全切除术后对患者造成的创伤较大,与此同时对于营养的需求显著增加,从而促使术后患者免疫力下降以及严重营养不良,增加术后并发症风险,对后期的康复造成影响。对于全胃切除术患者,以往通常采用全肠外营养支持,经静脉给予患者多种微量元素以及营养。虽然能起到一定的疗效,但是会对患者的胃肠道造成损害,致使菌群以及内分泌失调,引起机体代谢紊乱等一系列并发症[7-8]。
对患者给予早期的肠内营养支持,能够对其肠黏膜细胞造成刺激,促使其生长。加速兴奋型胃肠道激素胃泌素的分泌,从而加快胃肠道运动功能。本研究结果指出,治疗前两组患者各项肝功能指标水平有可比性(P>0.05);治疗后与B 组患者相比较,A 组患者AST、DB、ALT、TB 和IB 水平显著偏低(P<0.05);治疗前两组患者各项营养指标有可比性(P>0.05);治疗后与B 组患者相比较,A 组患者TP、Alb 和体重无明显差异(P>0.05);治疗后与B 组患者相比较,A 组患者住院时间、进流食时间以及术后通气时间显著偏短(P<0.05)。由此可见,通过实施早期肠内营养支持,可促使患者胃肠功能早日康复,缩短患者住院时间,同时还能使受损的胃肠尽快修复重生。与此同时,还能对患者的肝功能起到保护效果,最大程度降低内毒素以及肠道细菌对患者肝功能造成损害。总而言之,针对胃肠外科收治的胃癌患者,在给予全胃切除术后给予早期肠内营养支持,不仅能加速患者术后胃肠功能的恢复,同时还能改善患者的肝功能指标,降低并发症的发生,促使患者早日康复。

