泡状棘球蚴原头节与肝癌细胞共培养的相互作用研究
杨海成,杨照辉,史康杰,温钰鹏,张示杰
泡状棘球蚴病(alveolar echinococcosis, AE)是一种人兽共患病,当人误食多房棘球绦虫(Echinococcusmultilocularis,E.multilocularis)的虫卵时,虫卵发育成六钩蚴入血,成虫寄生于肝脏可致AE。E.multilocularis的生命周期复杂,根据流行病学研究发现其终宿主为野生或家养犬科动物,如北极狐、豺、狼或狗等,而人类是中间宿主[1]。E.multilocularis的幼虫期是AE的病原体,估计每年有17 400例感染,其中大多数发生在中国,多聚集在新疆、青海、西藏等地[2]。AE是一种破坏性的临床病症,其特征在于寄生虫的进行性、浸润性增殖,多似恶性肿瘤[3]。AE主要影响肝脏,若治疗不及时,往往病死率极高[4]。肝脏中最常见的恶性肿瘤为肝细胞癌(hepatocellular carcinoma,HCC),随着社会进入老龄化,我国HCC的患病数依然很庞大,5年转移率和复发率均高于60%[5]。前期研究发现泡球蚴原头节无法长时间在体外培养,直到Hemphill与Gottstein首次提出泡球蚴原头节与饲养细胞共培养可显著延长原头节在体外的存活时间[6]。目前虽有原头节与饲养细胞共培养的报道,发现Hela细胞可作为泡球蚴的饲养细胞,促进泡球蚴的生长发育,但泡球蚴原头节与肝癌细胞(hepatoma cells,HepG2)共培养较少见。近年有关寄生虫感染后导致宿主体内感染灶内细胞增殖的研究逐渐增多,多房棘球绦虫[7]、枯氏锥虫(Trypanosomacruzi)[8]、刚第弓形虫(Toxoplasmagondii)[9]感染后,细胞内ERK信号通路被激活,促进宿主细胞增殖。体外实验表明,泡状棘球蚴囊液中存在多种促炎细胞因子。因此我们将人源肝癌HepG2细胞作为饲养细胞与泡球蚴原头节共培养观察泡球蚴原头节的存活及成囊情况,反之再去观察泡状棘球蚴原头节对饲养细胞的作用。基于此想法,我们初步分析E.multilocularis与肝癌HepG2细胞的相互作用及其机制,为包虫病合并肝癌的临床早期诊治奠定基础。
1 材料与方法
1.1伦理声明 本实验所用动物均按照2017年3月1日《实验动物管理条例》严格执行,并且经过石河子大学医学院第一附属医院伦理委员会同意(许可证号:2015-018-01)。
1.2 材 料
1.2.1原头节及肝癌细胞的制备 从新疆维吾尔自治区疾控中心购SPF级长爪沙鼠(Merionesunguiculatus)50只(雌雄各25只),实验动物许可证号:SCXK(新)2017-0021,鼠龄在6~8周之间,体重(40±5)g,用于E.multilocularis的保种与传代。新疆石河子大学第一附属医院实验动物中心提供感染E.multilocularis6个月以上的长爪沙鼠(15只),按照原头节提取方法提取原头节。肝癌HepG2细胞购于武汉普诺赛公司,使用含1%青链霉素(购于Gibco公司)及10%胎牛血清(购于Gibco公司)的DMEM培养基培养。
1.2.2主要试剂 伊红染料、RNA提取试剂盒、反转录试剂盒、SYBR Green试剂盒、CCK8检测试剂盒、细胞凋亡检测试剂盒、RIPA细胞裂液等。
1.3原头节与肝癌细胞共培养 肝癌HepG2细胞采用10%的胎牛血清及1%双抗的高糖DMEM培养基,培养环境为5% CO2、37 ℃培养箱中,隔天换液或传代。待肝癌细胞贴壁后,将原头节按数量加入到培养瓶中,换液前提前收集泡状棘球蚴原头节。
1.4原头节活性检测及成囊情况 将存在饲养细胞的原头节组与无饲养细胞的原头节组重新换液时计时,每隔2 d取等量的原头节数量进行活性检测,使用伊红染色的方法计算活性,以抗红染原头节计算存活量,以红染原头节计算死亡量,存活率=[存活量/(存活量+死亡量)]×100%。在原头节与肝癌细胞共培养时,每隔7 d换液,每次取10 μL培养液计算成囊率,成囊率=(成囊泡数/视野下总原头节数)×100%。
1.5CCK8法检测HepG2细胞增殖情况 按5×105/mL密度将HepG2细胞种植在24孔板中并设置空白组比较,培养12 h后,以不同浓度(0、3 000、6 000、9 000 个/孔)的原头节加入到肝癌细胞中,每组设置3个对照组,待共培养48 h与72 h后,将原头节从上清中完全取出,每孔加入25 μL CCK-8试剂,避光,37 ℃条件中孵育1.5 h,使用酶标仪在450 nm吸光度时的吸光度(A)值,以此来计算细胞的增值率。增值率=[(A实验组-A空白组)/(A对照组-A空白组)]×100%。
1.6流式细胞仪检测肝癌细胞凋亡情况 按5×105/mL密度将HepG2细胞种植在6孔板中,采用不同数量(0、3 000、6 000、9 000 个/孔)的原头节与肝癌细胞共培养48 h后,彻底去除原头节后,使用预冷的PBS冲洗干净后,加入胰酶消化后收集细胞,分别加入PI和Annexin V-FITC抗体后,设置对照组,避光情况下上机检测。
1.7实时荧光定量PCR检测HepG2细胞中caspase3、caspase9、Bax、Bcl-2的mRNA表达水平
使用上述方法处理后的细胞,Trizol法提取细胞中总RNA,调平后逆转录成cDNA,保存条件:37 ℃ 2 min,42 ℃ 60 min,70 ℃ 5 min,4 ℃保存。将所得cDNA进行实时荧光定量PCR,所用PCR引物序列见表1。扩增条件为:95 ℃ 10 min,95 ℃ 15 s,60 ℃ 30 s,循环40次。使用2-△△Ct计算公式得出mRNA的表达量。
1.8Western Blot方法测定蛋白表达量 使用上述处理过的细胞加入RIPA细胞裂解液,获取肝癌细胞中总蛋白样品,用BCA的方法检测蛋白浓度,调整蛋白浓度后使各组浓度一致,应用SDS-聚丙烯酰胺凝胶电泳的方法,加入一抗、二抗,化学发光得出灰度值计算目的蛋白表达量。
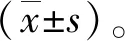
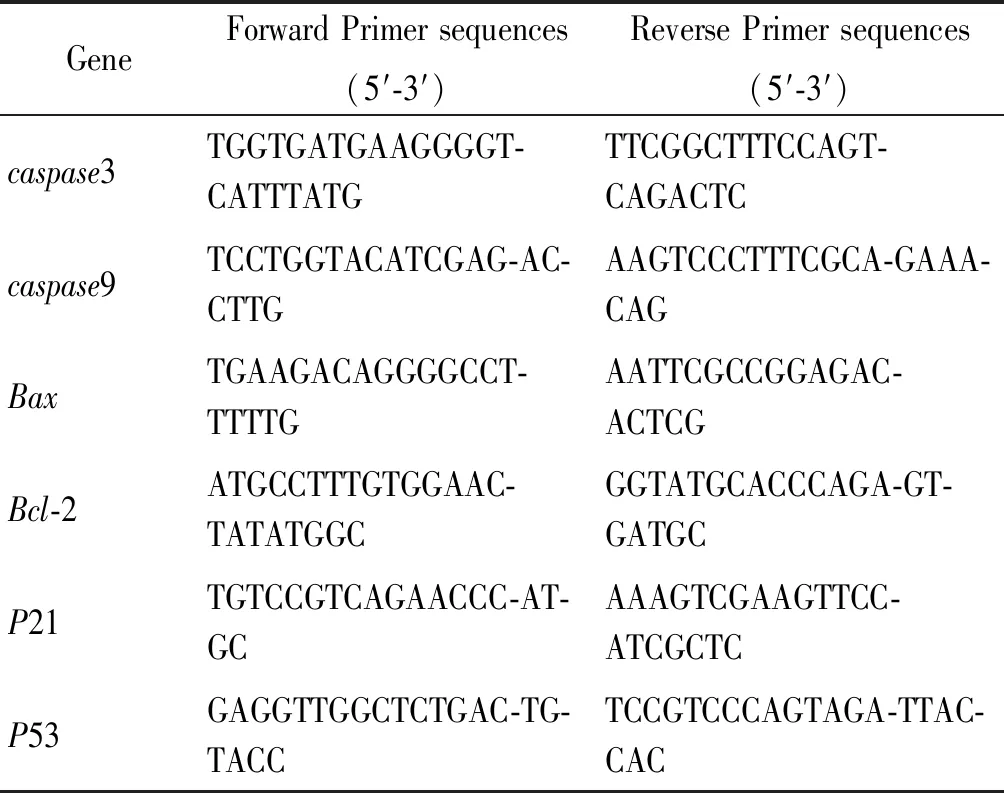
表1 实时荧光PCR引物序列Tab.1 Primer sequences for real-time PCR
2 结 果
2.1肝癌细胞作为饲养细胞可以促进泡球蚴原头节的存活和提高活性 随着肝癌HepG2细胞浓度的增加,原头节形态以及活性有着显著变化。实验组与对照组相比较,原头节形态更稳定,成活率更高,使用伊红染色时,有饲养细胞存在的原头节抗红染能力越强,存活率为[(91.42±2.47)%]显著高于无饲养细胞组[(73.10±4.68)%,t=-7.738,P<0.05],见表2。
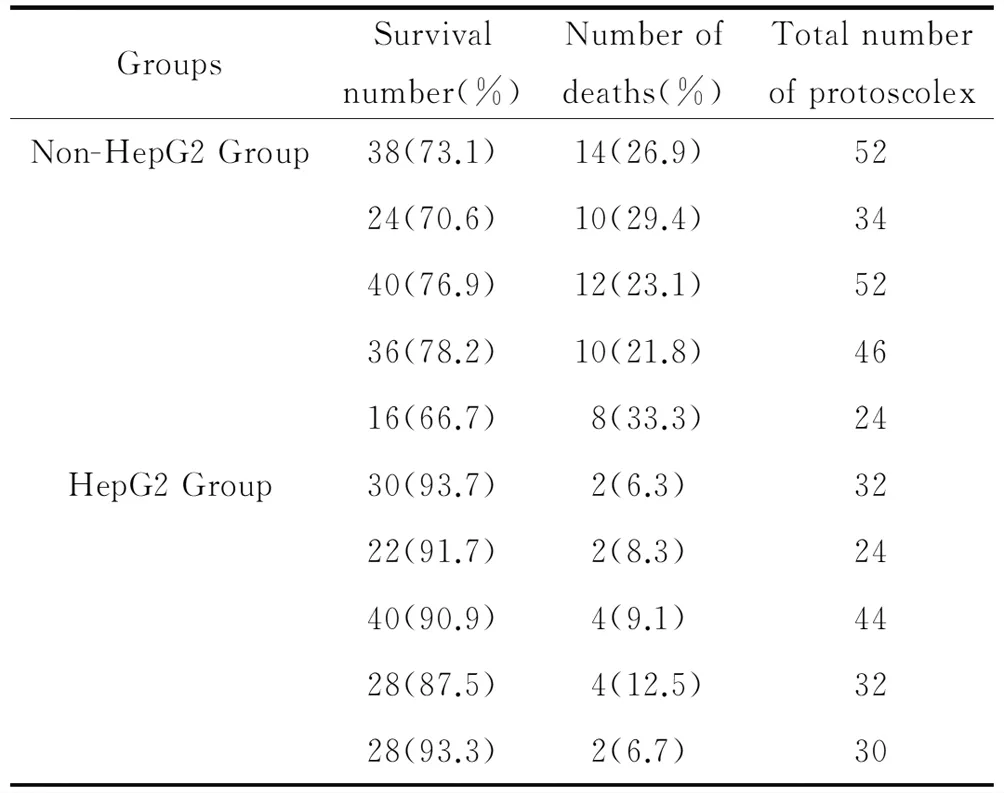
表2 饲养细胞与E.multilocularis共培养后E.multilocularis的存活情况Tab.2 Survival of E. multilocularis after co-culture with feeder cells
2.2肝癌细胞作为饲养细胞可以促进泡球蚴原头节成囊 存在肝癌细胞作为饲养细胞时,原头节成囊率[(66.72±2.02)%]显著高于无饲养细胞组的成囊率[(30.21±2.25)%,t=11.228,P<0.01]。随着定期更换饲养细胞时,囊泡的直径会不断变大。
2.3泡球蚴原头节促进肝癌细胞增殖及抑制凋亡
2.3.1利用CCK8法检测泡球蚴原头节与肝癌细胞共培养48 h和72 h后肝癌细胞的增殖情况 将泡球蚴原头节与肝癌细胞共培养48 h后,与无原头节共培养组比较,实验组(4.13±0.04,4.43±0.07,3.77±0.04)均促进肝癌细胞增殖(t=-130.912、-89.051、-134.067,P均<0.01),浓度为9 000个/孔组较前两组有所降低,但均高于对照组。将共培养时间增加到72 h时,实验组(5.24±0.06,5.84±0.04,6.94±0.05)均高于对照组(t=-125.853、-206.432、-219.405,P均<0.01)。见图1。
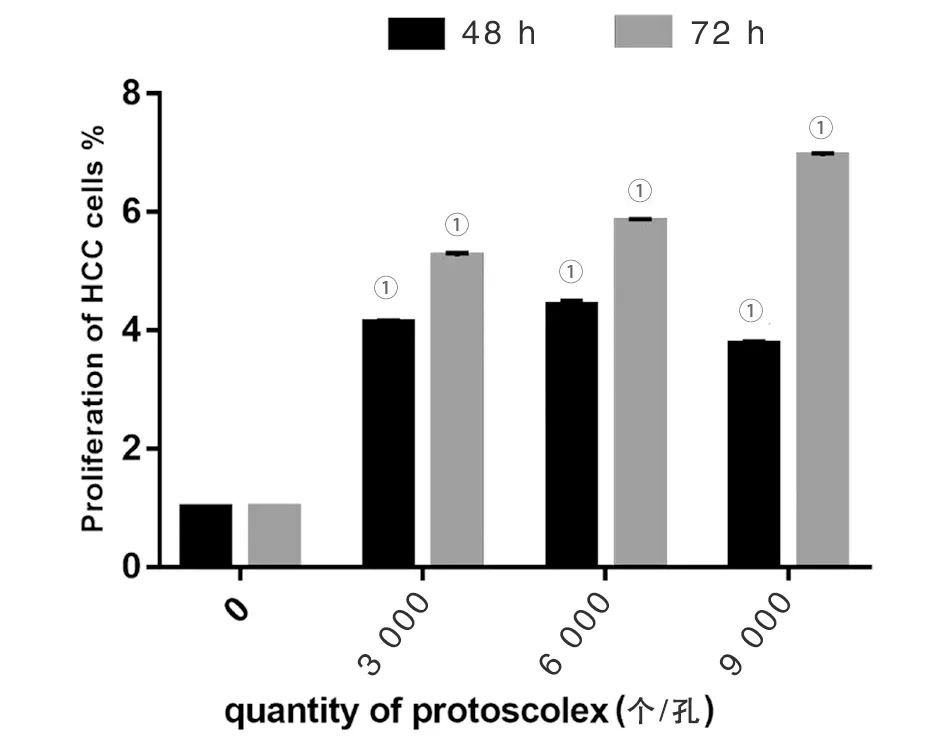
①P<0.01 vs 对照组 (0个/孔). 图1 CCK8法检测不同数量原头节对肝癌HepG2细胞增殖情况Fig.1 CCK8 method for detecting the proliferation of HepG2 with different numbers of protoscolex
2.3.2Annexin V-FITC/PI 流式细胞术检测原头节抑制肝癌HepG2细胞凋亡情况 如图2所示,检测共培养48 h后的肝癌细胞凋亡情况,流式结果显示:对照组凋亡率为(25.27±0.05)%,浓度为3 000个/孔组凋亡率为(17.28±0.10)%, 6 000个/孔组为(9.96±0.03)%, 9 000个/孔组为(18.78±0.07)%。与对照组相比,实验组中3 000个/孔、6 000个/孔和9 000个/孔组肝癌HepG2细胞发生凋亡的比例均降低(t=18.829、31.523、11.644,P均<0.01),但6 000个/孔组凋亡比例最低,见图2。
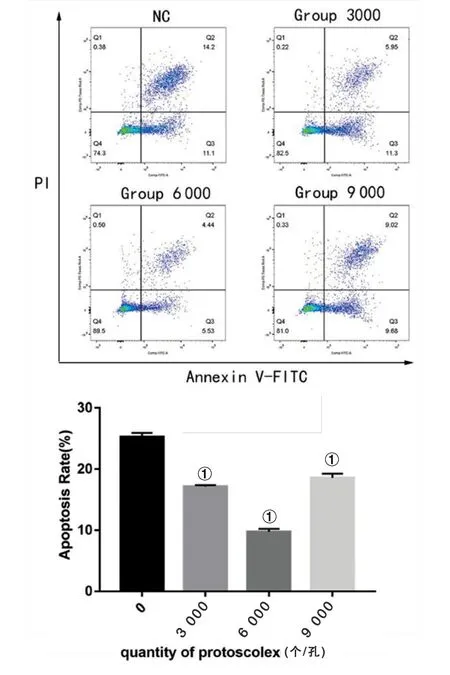
①P<0.01 vs 对照组(0 个/孔)图2 Annexin V-FITC/PI 流式细胞术检测肝癌HepG2细胞凋亡情况Fig.2 Annexin V-FITC/PI flow cytometry detecting HepG2 cell apoptosis
2.3.3泡球蚴原头节与肝癌细胞共培养后肝癌细胞中mRNA的变化 与对照组相比较,实验组中Bcl-2表达升高(F=75.801,P<0.01),而Bax、caspase3、caspase9、P21、P53表达降低(F=70.206、360.218、240.962、687.871、182.437,P均<0.01),但发现浓度6 000个/孔组的促凋亡基因下降不明显,而促增殖基因反而升高明显。见图3。
2.3.4原头节与肝癌细胞共培养后可降低肝癌HepG2细胞的Bax、caspase3和caspase9表达,并促进Bcl-2表达 利用Western-blot检测不同数量原头节对HepG2中Bax、caspase3和caspase9的表达,均呈现不同程度的降低(F=703.092、48.490、968.834,P均<0.01),但随着原头节数量的不断增加Bcl-2的表达却增加(F=103.726,P<0.01),见图4。说明原头节可通过caspase通路及线粒体通路来影响HepG2细胞的凋亡。
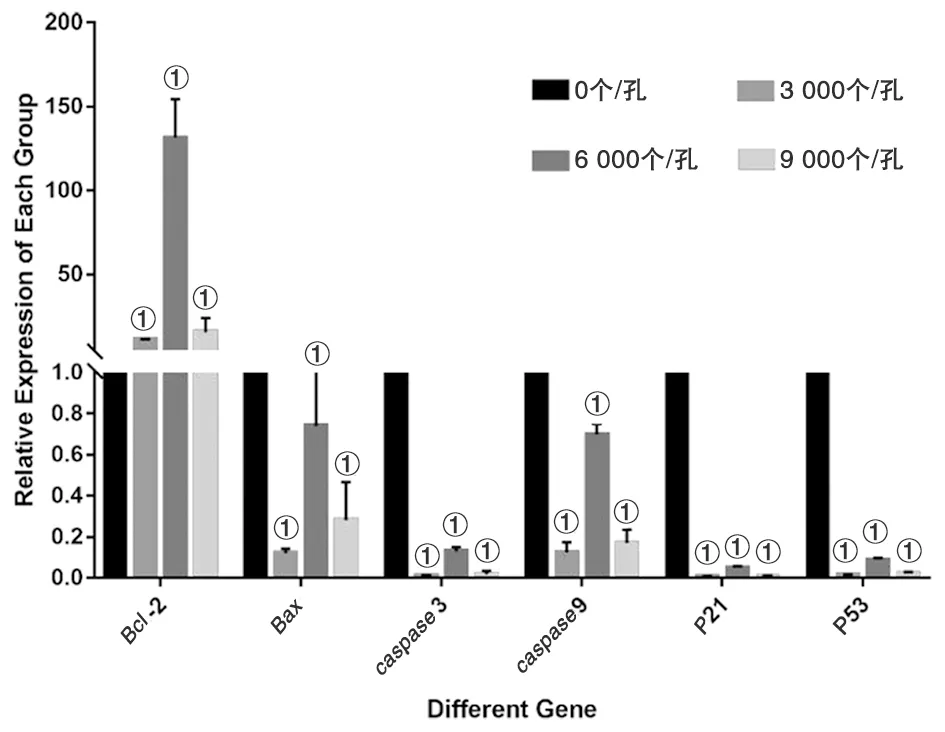
①P<0.01 vs 对照组(0 个/孔)图3 Real-Time PCR检测凋亡相关分子caspase3、caspase9、Bax、Bcl-2、P21、P53的mRNA表达情况Fig.3 Real-time PCR detection of the mRNA expression of the apoptosis-associated molecules caspase3, caspase9, Bax, Bcl-2, P21 and P53
3 讨 论
泡状棘球蚴病虽是良性病变,但呈现恶性生长,较易侵袭和转移,故生存率较低。原发性肝癌的发生发展是一个多因素、多阶段的过程,需要基因改变和表观遗传的共同参与。而泡状棘球蚴的生长发育是依赖于宿主环境而呈现浸润性生长,研究表明不同动物种属之间的细胞因子如胰岛素、表皮生长因子、成纤维细胞生长因子和转化生长因子-β等不仅结构上有明显的同源性,而且在功能上也可以相互替代[10]。因此利用这一点宿主可能提供某些细胞因子为其生长提供帮助,而动物进化及生长最早是建立在细胞间通讯的基础之上。有研究表明EGFR通路可参与泡状棘球蚴生发层细胞的增殖和存活,抑制EGFR通路可诱导泡球蚴生发细胞的caspase3酶活性升高,出现凋亡特征[11]。研究团队还发现当抑制EGF所诱导的ERK磷酸化,可导致生发层细胞的凋亡,抑制其增殖[12]。泡状棘球蚴甚至还表达G蛋白偶联受体(GPCRs)、蛋白酶、铁离子通道等[13]。本研究发现泡球蚴原头节的生长发育离不开饲养细胞,当肝癌HepG2细胞与之共培养时,原头节存在显著的高存活率,延长了泡球蚴原头节在体外培养的时间,且更易成囊成泡,为后期研究生发层细胞提供可靠来源。发生此现象的原因可能是肝癌HepG2细胞分泌了某些细胞因子作用于泡状棘球蚴原头节的对应受体导致相关通路的激活,以此来促进其生长发育。
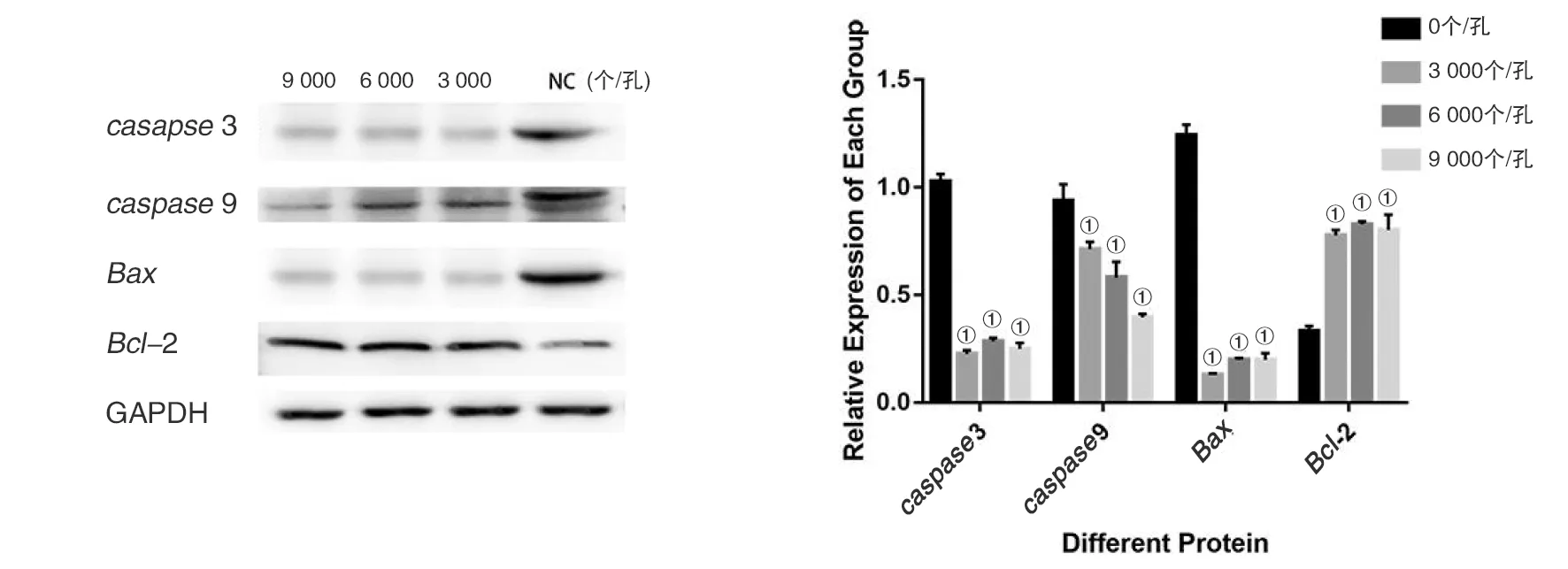
①P<0.01 vs 对照组(0 个/孔)图4 Western-blot 检测HepG2中Bax、Bcl-2、caspase3和caspase9的表达Fig.4 Western-blotting detection of the expression of Bax, Bcl-2, caspase3 and caspase9 in HepG2 cells
Romic B等[14]对肝细胞癌(HCC)合并肝包虫病的研究进行了系统回顾,分析了HCC癌变的性质,以了解肝癌变的诊断特征并作出合适的治疗。Kübeck M等[15]报告了目前肝癌合并AE的病例,阐述了泡状棘球蚴可导致慢性肝实质性改变,以此来促进肝癌的发生。上述研究仅局限于通过临床病例进行分析,并未有明确的分子机制来阐明发生的原因。Stadelnan B等[16]发现E.multilocularisPGI与人类的PGI在核酸序列上有86%的同源性,这种酶可作为一种生长因子在肝癌发生上起重要作用。另有研究人员发现AE可影响人类的免疫系统,以此来增加恶性肿瘤发生的风险。caspase3对于肿瘤的凋亡是一个重要分子,剪切的caspase3是促进凋亡的主要裂解酶,而Bcl-2可抑制caspase3的活性,Bax与Bcl-2同源为一种水源性相关蛋白,Bax的过度表达可拮抗Bcl-2的保护作用[17]。本研究发现当原头节存在时,CCK8检测结果显示共培养时肝癌细胞表现出活跃增殖现象,且流式结果与CCK8一致表现出凋亡减少,显著低于对照组,但浓度6 000 个/孔组的凋亡率低于3 000 个/孔组与9 000 个/孔组,发生这种原因的可能是9 000 个/孔组原头节密度较大,影响了肝癌HepG2细胞的代谢。实验组的P21、P53、caspase3、caspase9及Bax低于对照组,Bcl-2高于对照组,随着原头节数量的增加,增殖呈现上升趋势,表明无论从caspase家族或线粒体通路都是原头节抑制肝癌细胞的凋亡而促进增殖,这说明原头节可能分泌某些促增殖因子例如EGF、OPN等,它们作用于肝癌细胞表面受体导致此现象的出现。
本实验是研究泡球蚴原头节与肝癌细胞的相互作用,可为后期体外培养原头节及生发层细胞提供依据,也可为预防泡球蚴病合并肝癌患者复发或恶化提供理论依据。研究证实了泡球蚴原头节可促进肝癌细胞的增殖而抑制其凋亡,这可为后期研究提供理论依据以及组织损伤修复的新药开发奠定基础。但本研究对具体分泌了哪些因子导致该现象的产生尚无定论,机制尚未阐明。因此需要进一步探索以解释更深的机制,也需进一步加强泡球蚴原头节生物制剂的基础实验和临床研究。
利益冲突:无

