围产期奶山羊注射5-HTP后血液ceRNA网络构建分析
胡凯召,赵海瑛,陈顺新,杜 玮,高慧杰,郑惠玲
(西北农林科技大学 动物科技学院,陕西 杨凌 712100)
奶山羊在产羔前后两周内的奶山羊由于产道收缩和形成初乳,会消耗掉血液中大量的钙离子,造成血液中的钙离子浓度迅速降低,极易引发低血钙症[1]。并伴随着产后瘫痪、乳腺炎、酮病、胎衣不下等疾病[2],对奶山羊产业造成巨大的经济损失。在外周组织中,L-色氨酸在色氨酸羟化酶(Tryptophan Hydroxylase 1,TPH1)的作用下生成5-HTP,5-HTP在芳香族氨基酸脱羧酶的作用下可以生成5-HT[3-4]。5-HT可以诱导甲状旁腺激素相关肽(Parathyroid Hormone-related Peptide,PTHrP)的表达,增强破骨细胞的活性[5],溶解骨骼中的钙释放到血液中[6-7]。此外5-HT还可以诱导山羊乳腺上皮细胞中与钙代谢有关基因的表达,从而调控山羊乳腺上皮细胞向乳汁中释放钙离子[8-9]。
人类基因组中只有2%的基因转录的转录本可以编码蛋白质,其余98%的基因转录的转录本都没有编码蛋白质的能力[10],但近些年研究发现,这些非编码转录本可以影响基因的转录翻译过程,调控编码蛋白质基因的表达,对生物体的生理活动和代谢过程有着重要的调控作用。2011年Salmena等提出了ceRNA假说,该假说认为在 ceRNA 网 络 中 ,microRNA为核心元素,mRNA、LncRNA、CircRNA和假基因等作为ceRNA,通过竞争一个或多个microRNA应答元件(microRNA Response Element,MRE)来调节其mRNA的表达,进而行使调节功能[11]。进而调控组织或细胞许多生理活动,包括细胞增殖凋亡、细胞迁移侵袭、脂代谢、糖代谢等[12-13]。
Lin等[14]在人脐静脉内皮细胞(Human Umbilical Vein Endothelial Cells,HUVEC)构建的粥样硬化模型中发现,LncRNA MKI67IP3可吸附Let-7e,进而调控核转录因子-KB(Nuclear Transcription Factor-KB,NF-KB)的表达,并在人动脉粥样硬化斑块组织中得到了验证。 第10染色体缺失的磷酸酶与张力蛋白同源物基因( Gene Of Phosphate And Tension Homology Deleted On Chromsome Ten ,PTEN)PTEN 是重要的抑癌基因,在黑色素瘤、前列腺癌和胶质母细胞瘤中都已经发现了 PTEN的ceRNA[15-16]。
本试验通过向围产期的奶山羊注射5-HTP,提高奶山羊体内5-HT的浓度,在分娩当天采集血液后进行全转录组测序,鉴定出差异表达的基因并作富集分析,筛选鉴定出差异表达的LncRNA、microRNA、CircRNA。构建ceRNA 调控网络,并对网络中的基因作功进行功能注释与富集分析。最后筛选出与钙离子代谢相关的LncRNA/CircRNA-microRNA-mRNA调控网络,为5-HT调控山羊钙代谢提供了一种全新的分子机制。
1 材料方法
1.1 试验样本采集
从陕西省周至县宏兴奶山羊养殖基地选取6只体况良好、胎次相近,处于妊娠后期的奶山羊,分为2组,每组3只,预产期前7 d开始试验组静脉注射浓度为0.8 mg/kg的5-HTP,另一组为对照组,注射等量生理盐水。分娩当天采集血液,使用Trizol试剂盒提取RNA。
1.2 构建文库与上机测序
1.2.1 small RNA文库的构建 RNA样品检测合格后按照small RNA文库构建试剂盒构建文库,将RNA随机打断成片段,分别在RNA两端连接测序接头,通过逆转录合成cDNA。采用凝胶分离技术筛选目标片段,得到small RNA文库。
1.2.2 LncRNA文库的构建 按照LncRNA文库构建试剂盒构建文库,加入Fragmentation Buffer将mRNA随机打断成片段,加入随机引物和逆转录酶合成第一条cDNA链,然后合成第二条链。 用AMPure XP珠纯化cDNA,之后加上测序接头。通过PCR富集获得cDNA文库。
1.2.3 上机测序 测序由北京百迈克生物科技有限公司完成,采用Illumina HiSeq平台将构建好的Small RNA、LncRNA文库进行上机测序。
1.3 差异表达转录本的鉴定
1.3.1 差异表达基因的筛选与分析 采用Trommatic对原始测序数据进行过滤,用HISAT2软件将LncRNA文库的高质量测序数据与山羊参考基因组进行比对,使用StringTie对转录本进行组装,用FPKM值计算基因的表达量。用EBSeq软件以log2Fold Change>1,FDR<0.05作为筛选的阈值筛选差异表达的基因。用Metascape(www.metascape.org)对差异表达基因进行富集分析。
1.3.2 差异表达LncRNA的筛选 根据与参考基因组比对的结果,用StringTie软件组装转录本。采用CPC、CNCI、CPTA和Pfam结构域分析估计候选LncRNA的编码潜力。取4种分析方法不编码蛋白质的转录本的交集为鉴定出的LncRNA。用StringTie软件通过FPKM值计算 LncRNA的表达量,EBSeq软件以log2Fold Change>1,FDR<0.05作为阈值筛选差异表达的LncRNA。
1.3.3 差异表达CircRNA的筛选 根据与参考基因组比较的结果,通过CIRI、find-Circ预测并鉴定CircRNA,用TPM值计算CircRNA的表达量,并用EBSeq软件以Log2Fold Change> 1,FDR <0.05用作筛选的阈值来筛选差异表达CircRNA。
1.3.4 差异表达microRNA的筛选 对于Small RNA的文库,用Bowtie软件将测序数据与非编码RNA 数据库进行比对,过滤掉非编码RNA和重复序列,获得包含microRNA的注释序列。利用Bowtie软件将注释序列与参考基因组进行序列比对,获取在参考基因组上的注释信息。将比对到参考基因组的序列与miRBase数据库中的成熟microRNA序列进行比对,序列相同的为已知microRNA。对于比对结果不相同的序列,用miRDeep2软件进行新microRNA的预测。同样用TPM值计算microRNA的表达量,用EBSeq以 log2fold Change>1, FDR<0.05作为阈值筛选差异表达的microRNA。
1.4 ceRNA网络的构建与分析
筛选差异表达的mRNA,microRNA,LncRNA,CircRNA和它们的序列,使用这些转录本构建LncRNA/CircRNA-microRNA-mRNA调控网络。使用RNAhybrid和RNA 22设置阈值来预测LncRNA、CircRNA与microRNA的结合情况。满足这两个软件阈值的LncRNA-microRNA和CircRNA-mivroRNA调控关系被保留。对于microRNA-mRNA相互作用关系,使用miRanda设置阈值来预测它们之间的结合情况,满足阈值的调控关系保留下来。选取LncRNA、/CircRNA与mRNA表达趋势相同并与microRNA表达趋势相反的调控关系作为最终的调控网络。最后使用cytoscape3.6.1构建ceRNA网络,对于ceRNA网络中的基因使用Metascape进行富集分析。
2 结果与分析
2.1 差异表达转录本的筛选与鉴定
EBSeq软件设置阈值log2fold Change>1、FDR<0.05来筛选差异表达的mRNA、microRNA、LncRNA和CircRNA,共获得999个差异表达的mRNA,其中586个上调,413个下调。 筛选出667个差异表达的LncRNA,其中371个上调,296个被下调。 在87个差异表达的microRNA中,有46个上调, 41个下调。 最后,筛选出95个差异表达的CircRNA。 其中,有66个上调,有29个下调。
2.2 差异表达基因的富集分析
如图1所示,山羊注射5-HTP后主要影响免疫反应过程、无机离子稳态和脂代谢。通过调控对有毒物质的反应、白细胞迁移来影响免疫反应过程。山羊注射5-HTP后会影响无机离子的稳态,主要是体内钙离子的稳态。
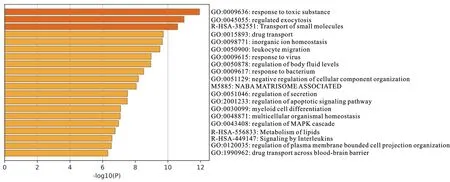
图1 差异表达基因富集分析Fig. 1 Enrichment analysis of differentially expressed genes
2.3 ceRNA网络的构建与分析
根据ceRNA的作用机制和RNAhybrid、RNA22和miRanda软件,构建了ceRNA调控网络(图2)。对于CeRNA网络中的这些mRNA,采用Metascape进行富集分析。如图3所示,通过LncRNA/CircRNA-microRNA-mRNA调控网络,Ln-cRNA与CircRNA主要影响小分子的转运、无机离子(钙离子)稳态、白细胞介素-8的产生调节和水解酶的活性调节。富集分析结果发现,TLR9、JPH1和GJC2与钙代谢有关。TLR9可负调节钙转运ATP酶的活性。JPH1参与钙释放通道活性的调节、钙离子释放到胞质溶胶中,GJC2与钙离子跨膜转运正调节有关。LncRNAMSTRG.1354.2可以与TLR9竞争性的结合microRNA NC_0308251_46027,从而调节TLR9的表达。TLR9可以影响钙转运ATP酶的活性,基于这一作用机制,LncRNA可以参与调控钙代谢,其他的调控关系也是类似的。
3 讨 论
Laporta等[17]使用野生型小鼠、TPH1基因敲除小鼠和TPH1基因敲除后注射5-HTP的乳腺进行转录组测序,与TPH1基因敲除的小鼠相比,野生型小鼠增加了5-HT的含量,注射5-HTP后同样增加小鼠体内5-HT的浓度。通过转录组测序分析发现,野生型相对于其它两组鉴定出62个共同差异表达的基因,进行富集分析结果表明,增加小鼠体内5-HT的浓度后,主要影响钙稳态、脂质代谢和细胞周期、免疫反应等过程。这与本试验差异表达基因的富集分析结果基本上是一致的,证实了采用转录组测序分析的方法来探究5-HT的生物学功能是可靠的。除此之外,还表明尽管小鼠和山羊是两个不同的物种,但是在两个物种之间一些基因是保守的,并且它们的表达都受5-HT浓度的影响。
Weaver等[18]研究发现通过注射或饲喂5-HT的前体物质可增加奶牛体内5-HT的浓度,5-HT的浓度与奶牛泌乳第一天血清中钙的浓度呈正相关。Zang等[9]在山羊乳腺上皮细胞中用干扰TPH1和添加5-HTP来减少或增加5-HT的浓度,发现5-HT可以促进PTHrP的表达,并以剂量依赖性的方式促进钙敏感受体(Calcium Sensing Re-ceptor,CASR)的表达,降低钙转运质膜ATP酶1(ATPase Plasma Membrane Ca2+Transporting 1,ATP2B1)的表达。这些研究都发现5-HT可以显著的影响血清中的钙离子浓度,参与钙代谢,并且影响与钙代谢相关基因的表达。这进一步印证了注射5-HTP后转录组测序分析的结果。
Watanabe等[19]的综述中指出肠道的肠嗜铬细胞在餐后产生5-HT。 在小鼠中,它通过对几种5-HT受体的作用,诱导脂质浓度降低。此外5-HT通过5-HT受体2A和2C加速脂肪细胞的分化。进而调控脂质代谢。5-HT可以调控许多免疫细胞的储存、反应和转运。包括T细胞、巨噬细胞、肥大细胞、树突状细胞和血小板,尤其是T细胞[20]。围产期的奶山羊注射5-HTP后还影响脂代谢和免疫反应过程,这与本研究富集分析的结果是一致的,印证转录组测序分析的结果,5-HT确实可以调控脂代谢和免疫反应。5-HT可以通过与其受体作用,激活或抑制细胞内的信号通路,从而调控脂代谢和免疫反应过程[21]。
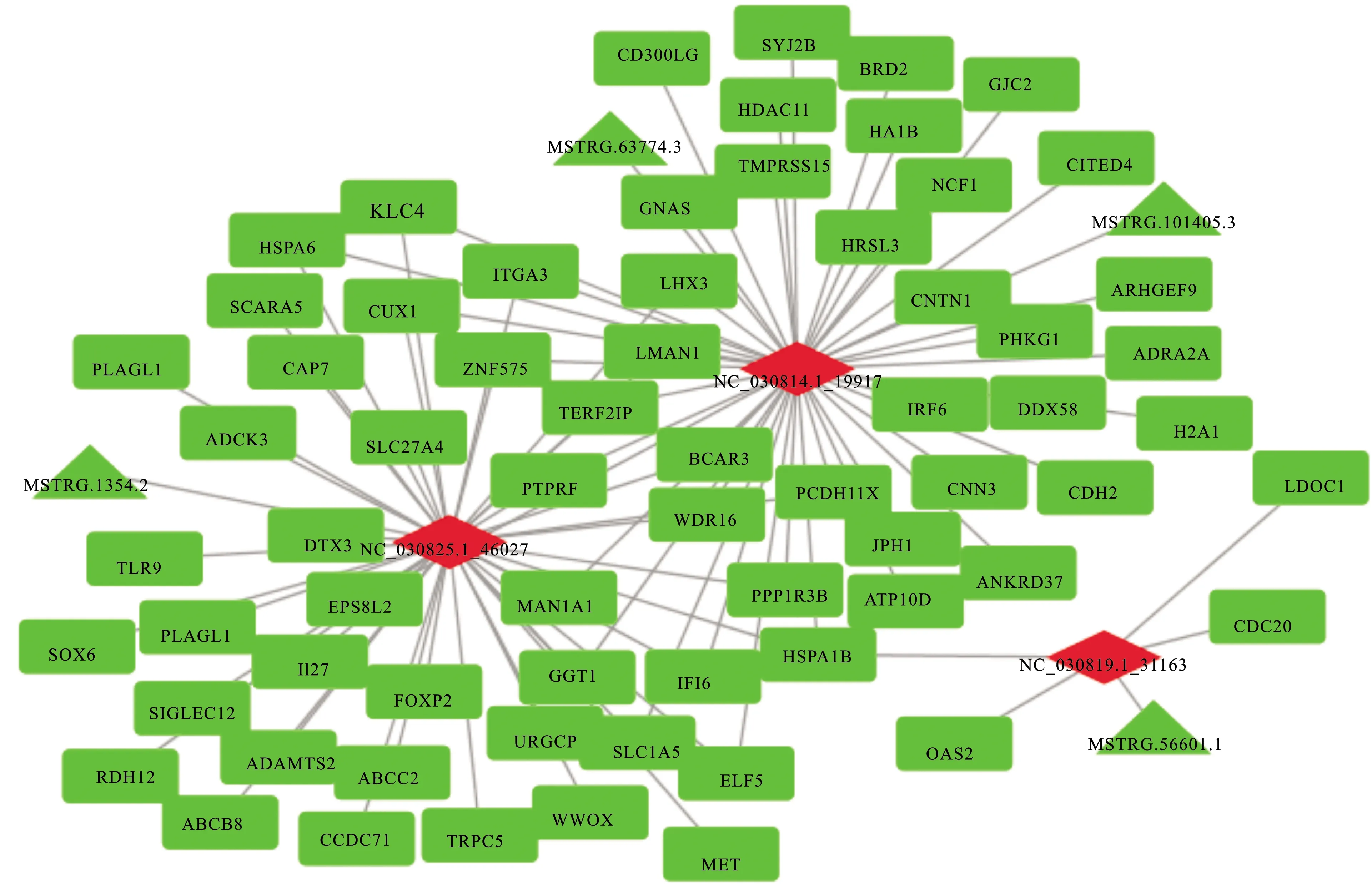
A
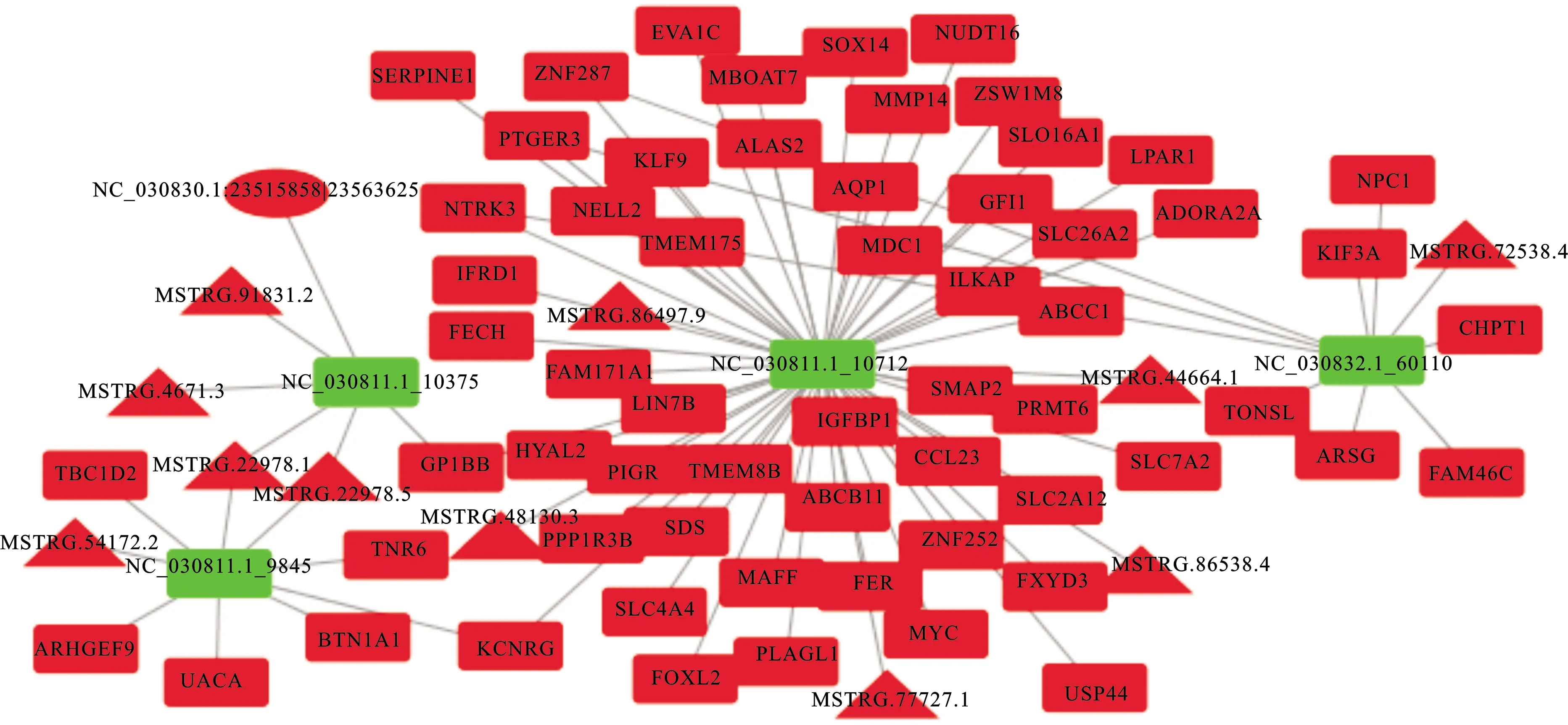
B
Wang等[22]用GEO数据库中动脉粥样硬化模型的巨噬细胞和正常的巨噬细胞的全转录组测序数据,鉴定出差异表达的LncRNA、CircRNA、microRNA、mRNA,并且构建ceRNA调控网络。结果发现CircRNA hsa_circ_0028198、hsa_circ_0092317和LncRNAXIST可与天冬氨酸β-羟化酶 (Aspartate Beta-Hydroxylase,ASPH)竞争性地结合miR-543,APSH通过与钙电压门控通道辅助亚基α2δ4 (Calcium Voltage-gated Channel Auxiliary Subunit alpha2 delta 4,CACNA2D4)参与钙代谢。
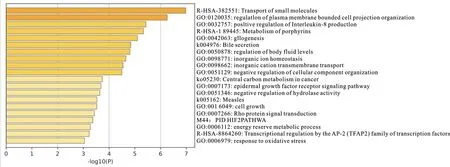
图3 ceRNA网络中的基因富集分析Fig3. Enrichment analysis of the genes in the ceRNA network
CircRNA和LncRNA的最重要机制之一是通过吸附microRNA来阻止microRNA对靶基因的抑制。特定基因的表达受LncRNA / CircRNA-microRNA-mRNA调控网络的调控,进而影响生物学过程[23-25]。然而,在本研究构建ceRNA网络中,CircRNA不能调控与钙代谢有关的基因。2 个LncRNA通过与microRNA竞争性地结合钙代谢相关的基因来调控钙代谢。LncRNA与CircRNA通过ceRNA调控网络行使调控基因表达的作用,进而调控钙代谢等过程,阐述了一种调控基因表达的新机制。这些分子机制有待进一步细胞分子试验验证。
4 结 论
对注射和不注射5-HTP的围产期奶山羊的血液进行转录组测序分析,发现其差异表达基因主要参与钙代谢、脂质代谢、免疫反应和细胞凋亡等过程。构建ceRNA调控网络并进行富集分析,发现TLR9、GJC2和JPH1 3个与钙代谢相关的基因,LncRNA MSTRG.1354.2可与TLR9竞争性地结合 microRNA NC.030825.1_6027,进而调控TLR9的表达,MSTRG.56601.1和MSTRG.101405.3都可以与GJC2、JPH1竞争性地结合NC.030814.1_19917,进而调控GJC2和JPH1的表达。本研究为围产期山羊钙代谢调控提供了一种全新的分子机制,为寻找新的防治围产期奶山羊低血钙症的有效方法提供了新思路。

