柑橘胁迫响应基因WRKY47的克隆与表达分析
沈丹 杨莉 胡威 匡柳青 郭文芳 卢婷 刘德春 刘勇


摘要: 以檸檬[Citrus limon (L.) Burm.f.]、甜橙[Citrus sinensis (L.) Osbeck]、芦柑(Citrus reticulata Blanco)、金柑[Fortunella japonica (Thunb.) Swingle]为试验材料,基于甜橙基因组数据库中的甜橙基因碱基序列,利用RT-PCR方法克隆获得4个WRKY家族基因ClWRKY47、CsWRKY47、CrWRKY47和FjWRKY47的cDNA全长碱基序列。序列分析结果表明,这4个基因的cDNA全长都是1 567 bp,开放阅读框为1 506 bp,编码501个氨基酸。氨基酸序列和结构分析结果显示,这4个基因编码的蛋白质属于Group IIa+IIb类WRKY蛋白。进化树分析结果显示,所克隆的4个柑橘WRKY蛋白与克莱门柚WRKY47蛋白的亲缘关系最近。对CsWRKY47启动子顺式作用元件预测分析,发现CsWRKY47启动子包含脱落酸响应元件(ABRE)、茉莉酸甲酯响应元件(CGTCA-motiF)、抗氧化响应元件(ARE)、参与干旱诱导的MYB结合位点(MBS)等多个与胁迫相关的顺式作用元件。实时荧光定量表达分析结果表明,柠檬ClWRKY47和甜橙CsWRKY47能被高盐、干旱、低温胁迫诱导表达;芦柑CrWRKY47在干旱和低温胁迫下诱导表达,高盐胁迫下表达量下调;金柑FjWRKY47 在高盐胁迫下诱导表达,干旱和低温胁迫下下调表达。为进一步开展柑橘胁迫相关基因WRKY47的功能鉴定奠定了基础。
关键词: 柑橘;WRKY;非生物胁迫;基因克隆;表达分析
中图分类号: Q785 文献标识码: A 文章编号: 1000-4440(2021)01-0129-10
Cloning and expression analysis of stress response gene WRKY47 in citrus
SHEN Dan, YANG Li, HU Wei, KUANG Liu-qing, GUO Wen-fang, LU Ting, LIU De-chun, LIU Yong
(College of Agriculture, Jiangxi Agricultural University, Nanchang 330045, China)
Abstract: Based on the Citrus sinensis gene base sequences contained in the sweet orange genome database, the cDNAs sequences of four WRKY family genes ClWRKY47, CsWRKY47, CrWRKY47 and FjWRKY47 were cloned from lemon [Citrus limon (L.) Burm.f.], sweet orange [Citrus sinensis (L.) Osbeck], ponkan (Citrus reticulata Blanco) and kumquat [Fortunella japonica (Thunb.) Swingle] by RT-PCR, respectively. The results of sequence analysis showed that the cDNA of these four genes were 1 567 bp in length, the open reading frame (ORF) was 1 506 bp, and 501 amino acids were encoded. The results of amino acid sequence and structure analysis demonstrated that the proteins encoded by these four genes belonged to the Group IIa+IIb WRKY protein. Phylogenetic tree analysis results indicated that the four citrus WRKY proteins were closely related to the Citrus clementine WRKY47 protein. Predictive cis-acting element analysis of CsWRKY47 promoter revealed that CsWRKY47 promoter contained abscisic acid response element (ABRE), methyljasmonic acid response element (CGTCA-motiF), anaerobic response element (ARE), MYB binding site involved in drought-response (MBS) and many other stress-related cis-acting elements. Real-time fluorescence quantitative PCR analysis suggested that the expression levels of ClWRKY47 and CsWRKY47 were induced by drought, low temperature and high salt. Besides, the expression of CrWRKY47 was induced under drought and low temperature stress, but suppressed under high salt stress. However, the expression level of FjWRKY47 was upregulated under high salt stress and suppressed under drought and low temperature stress. These results lay a foundation for further functional identification of the stress-related gene WRKY47 in citrus.
Key words: citrus;WRKY;abiotic stress;gene cloning;expression analysis
植物的生长发育过程很大程度上受环境的影响,其中非生物胁迫主要为干旱、高盐以及低温。在非生物胁迫信号的感知以及生理和生化反应上,植物自身已经进化出应对胁迫的各种复杂的响应机制。简单的说,植物可以通过一系列胁迫信号转导和调控相关基因来响应非生物胁迫[1-2]。这些非生物胁迫响应基因按功能可以分为两大类,即调控型基因和功能型基因。调控基因编码的转录因子(TFs)可以转导胁迫信号并调控功能基因的表达,而这些功能基因在减轻植物遭受胁迫带来的损害中起着直接作用[3]。
研究发现, bZIP、WRKY、NAC、AP2/ERF和MYB等转录因子家族都与植物响应逆境的过程相关 [4]。WRKY是植物中最重要的转录因子家族之一。该家族蛋白质包含1到2个由约60个氨基酸组成的高度保守的WRKY DNA结合结构域,还含有C2H2或C2HC锌指结构,可与DNA序列W-box(TTGACC/T)结合,调控下游基因表达[2]。自1994年首次在甜薯中克隆出1个WRKY 家族转录因子基因SPF1之后[5],又陆续在高等植物以及低等植物(如苔藓)中克隆出多个WRKY 家族基因[6]。在克隆出来的植物WRKY家族基因中,已有许多被验证能够响应非生物胁迫,并在这个过程中发挥调控作用 [7]。如Qiu等[8]利用Northern blotting技术,对克隆获得的13个水稻WRKY基因进行分析,发现在这13个水稻WRKY基因中有10个基因能够被非生物胁迫(高盐、高温、干旱和低温)诱导表达。Jiang等[9]通过芯片谱分析法对高盐处理后的拟南芥根系进行分析,发现有18个WRKY家族基因能够被高盐处理诱导表达。同时,单个WRKY家族基因可以被多种非生物胁迫诱导表达。例如樱桃砧木PcWRKY1基因在渗透胁迫和高盐胁迫下均能被诱导表达[10];芍药PLWRKY13可以被低温、高温、干旱和盐胁迫同时诱导表达,并且正向调节牡丹中番茄红素的产生[11]。拟南芥AtWRKY47基因可以被硒胁迫、镉胁迫诱导表达,并且AtWRKY47功能缺失型突变体对硒胁迫表现更敏感,但是对镉胁迫更耐受,其过表达植株也对镉胁迫表现出高度耐受[12-13]。前人研究结果表明,水稻OsWRKY47功能缺失型突变体对干旱胁迫敏感并且产量下降,而OsWRKR47过表达植株对干旱胁迫更耐受,说明OsWRKY47基因是干旱胁迫响应的正调控因子[14]。
柑橘是世界上最重要的水果种类之一,中国柑橘种植面积和产量一直在不断增长,但其产业发展一直受到非生物胁迫的影响和制约。目前,柑橘中的WRKY基因研究还不多,对柑橘WRKY47基因的研究未见报道。因此,本研究从柠檬、甜橙、金柑、芦柑4个不同柑橘种类中克隆得到WRKY47基因,对克隆出的基因的碱基序列及其编码蛋白质进行生物信息学分析,并使用实时荧光定量PCR分析这4个基因在非生物胁迫(高盐、干旱和低温)下的时空表达模式差异,以期为柑橘抗逆分子育种提供候选基因资源和理论依据。
1 材料与方法
1.1 试验材料及材料的处理
将柠檬[Citrus limon (L.) Burm.f.]、甜橙[Citrus sinensis (L.) Osbeck]、芦柑(Citrus reticulata Blanco)、金柑[Fortunella japonica (Thunb.) Swingle]种子消毒催芽后分别播种于MS固体培养基中,置于28 ℃恒温培养箱中培养28 d左右,再转移至Hoagland培养液中预培养2~3 d,然后进行胁迫处理。高盐、干旱处理时将4种幼苗分别转移至含有250 mmol/L NaCI、20% PEG-6000的Hoagland液体培养基中常温培养。低温处理时幼苗转移到干净的Hoagland液体培养基中并置于4 ℃培养箱中培养。每种材料取18~24个植株进行胁迫处理,然后分别于处理0 h(CK),1 h、3 h、6 h、12 h、24 h时取其叶片,-80 ℃储存,备用。
1.2 叶片总RNA提取及反转录
柠檬、甜橙、芦柑、金柑叶片总RNA提取方法采用Trizol法。RNA含量用超微量分光光度计检测, RNA提取质量用1%琼脂糖凝胶电泳检测。用日本TOYOBO公司生产的ReverTra Ace-α-TM试剂盒将提取的总RNA反转录成cDNA,存放于-20 ℃,备用。
1.3 ClWRKY47、 CsWRKY47 、CrWRKY47和 FjWRKY47基因克隆
由华中农业大学构建的甜橙基因组数据库中含有大量甜橙基因序列,通过序列搜索和拼接获得包含完整开放阅读框(ORF)的CsWRKY47转录因子基因序列。基于该序列用Primer Premier5.0软件设计了1对基因特异性引物CsWRKY47-F和CsWRKY47-R(表1)。以获得的4个物种的叶片cDNA为模板,通过PCR扩增获得ClWRKY47、CsWRKY47、CrWRKY47、FjWRKY47基因碱基序列全长。PCR扩增程序参考郭文芳[15]的方法,退火温度56 ℃ 30 s。扩增产物在1 %琼脂糖凝胶中进行电泳分离,切胶回收后的PCR目的片段用DNA回收试剂盒[天根生化科技(北京)有限公司产品]回收并纯化,然后与pMD18-T载体连接[宝日医生物技术(北京)有限公司产品]并转化到大肠杆菌中,菌液PCR鉴定为阳性克隆后送上海生物工程有限公司测序。
1.4 生物信息学分析
利用NCBI 中的ORF Finder工具对测序获得的ClWRKY47、CsWRKY47、CrWRKY47、FjWRKY47基因的cDNA碱基序列进行分析,确定这4个基因的开放阅读框和所编码的氨基酸序列,并对其碱基序列进行比对;利用ExPASy ProtParam在线分析工具对蛋白质氨基酸序列及理化性质进行分析;使用DNAMAN软件进行蛋白质一致性分析和不同植物蛋白质间的多序列比对分析;利用InterProScan在线软件分析蛋白质结构功能域;采用MEGA5软件构建4种蛋白质与其他植物蛋白质间的系统进化树;通过PlantCARE在线网站进行基因的啟动子顺式作用元件预测分析;采用TMpred预测基因编码蛋白质的跨膜结构;通过ProtScale在线软件预测蛋白质亲疏水性;采用在线软件PSORT II对蛋白质进行亚细胞定位分析;利用SOPMA软件预测蛋白质的二级结构并用SWISS-MODEL软件进行蛋白质三级结构预测建模。
1.5 实时荧光定量PCR
采用Primer Premier 5.0设计CsWRKY47基因的实时定量引物CsWRKY47-Fq和CsWRKY47-Rq,内参基因为柑橘CsActin基因(表1)。非生物胁迫处理后4个物种WRAKY47基因的表达量在BIO-RAD CFX9 6荧光定量PCR仪上进行检测。qRT-PCR反应体系的总体积为20.0 μl:10.0 μl荧光染料[宝日医生物技术(北京)有限公司产品]、8.0 μl ddH2O、1.0 μl F/R引物、1.0 μl总cDNA。qRT-PCR反应程序参照文献[15]。每处理样品设3次重复。相对表达量用2-△△Ct方法计算。
2 结果与分析
2.1 CsWRKY47的克隆与分析
以甜橙为材料,通过RT-PCR扩增克隆获得CsWRKY47基因碱基序列。测序和生物信息学分析结果显示,该基因cDNA碱基序列全长1 567 bp,开放阅读框(ORF)为1 506 bp,编码501个氨基酸。ExPASy ProtParam在线分析结果显示,CsWRKY47蛋白分子式为C2 327H3 727N699O757S25,其氨基酸组成有20种,理论等电点(PI)为8.58,PI值大于7说明该蛋白质可能为碱性蛋白质;预测相对分子质量约为54 410,脂肪系数为64.93,不稳定指数为49.48,总平均亲水性为-0.637,一般总平均亲水性的值小于0为亲水蛋白质,因此推测该蛋白质属于弱稳定性亲水蛋白质。通过ProtScale在线软件预测CsWRKY47蛋白亲疏水性,进一步证明其为亲水性蛋白质(图1A)。
采用TMpred预测蛋白质跨膜结构,结果显示,CsWRKY47蛋白N端343~363、376~396、461~480这3个位点处具有跨膜结构。PSORT II在线软件预测结果表明,CsWRKY47蛋白亚细胞定位于细胞核上的可能性最高。利用SOPMA软件预测CsWRKY47蛋白的二级结构,结果显示,该蛋白质具有27.94% α-螺旋、8.18%延伸链、2.59% β-折叠以及61.28%无规则卷曲(图1B)。使用SWISS-MODEL搜索并获得CsWRKY47蛋白同源模型,推测出该蛋白质可能的4个三级结构模型(图1C)。通过NetPhos 2.0 Serve预测CsWRKY47蛋白磷酸化位点,结果表明,CsWRKY47蛋白含有26个丝氨酸(Ser)以及2个苏氨酸(Thr)磷酸化位点。
2.2 CsWRKY47基因启动子序列预测分析
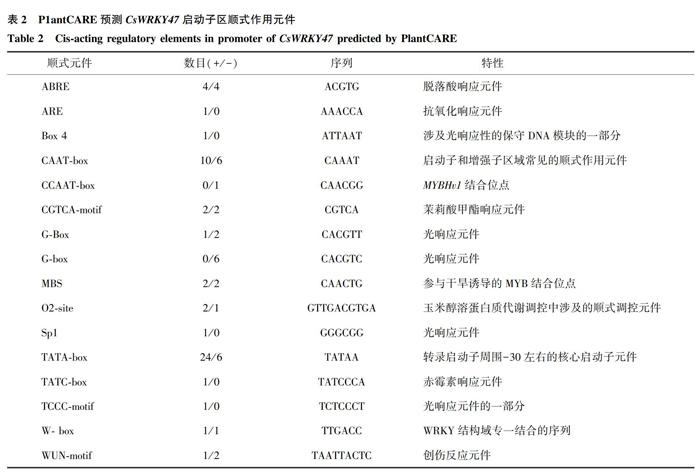
将从甜橙基因组数据库获取的CsWRKY47基因起始密码子ATG上游1 500 bp的DNA碱基序列作为该基因的启动子序列,并通过PlantCARE在线分析网站对该基因启动子序列进行顺式作用元件预测分析,分析结果(表2)显示,CsWRKY47基因启动子除了含有16个CAAT-box和30个TATA-box 2种基本的顺式作用元件外,还含有多个光响应元件,如G-Box、Sp1、TCCC-motif等;另外在DNA双链上分别有1个WRKY结构域专一结合的W-box元件,同时还包含多个与胁迫相关的顺式作用元件,如8个脱落酸响应元件(ABRE)、4个茉莉酸甲酯响应元件(CGTCA-motiF)、1个赤霉素响应元件(TATC-box)、1个抗氧化响应元件(ARE)、4个参与干旱诱导的MYB结合位点(MBS)等。
2.3 不同种类柑橘WRKY47蛋白的同源性及进化分析
为了解不同种类柑橘中WRKY47蛋白的差异和功能,通过RT-PCR扩增,分别从柠檬、芦柑、金柑3个柑橘种类中克隆出WRKY47基因,并分别命名为ClWRKY47、 CrWRKY47和FjWRKY47。测序结果表明,这3个基因的碱基序列与CsWRKY47的cDNA碱基序列长度一致,均为1 567 bp,生物信息学分析发现开放阅读框为1 506 bp并且编码501个氨基酸;对4个基因的碱基序列进行比对发现,这4个基因cDNA碱基序列有16个碱基存在差异,相似性达99.68%(图2)。
通过NCBI数据库将ClWRKY47 、CsWRKY47、CrWRKY47、FjWRKY47的碱基序列翻译成氨基酸序列,并用DNAman对这4条氨基酸序列进行比对,结果显示,这4条氨基酸序列有7个位点存在差异,序列一致性达99.55%。进一步通过与其他植物WRKY47蛋白进行多序列比对分析(图3)发现,这4个蛋白质在N端267~333位点都含有1个高度保守的WRKY结构域,并且在该结构域的N末端有1个WRKYGQK保守氨基酸序列和1个C端锌指结构基序C2H2(CX4-5CX22-23HX1H),说明这4个蛋白质都属于WRKY转录因子家族的Group IIa+IIb类。
为了验证ClWRKY47、CsWRKY47、CrWRKY47和FjWRKY47的蛋白质进化关系,使用MEGA 6.0软件中的最大似然法构建系统进化树,结果(图4)显示,这4个新蛋白质与克莱门柚WRKY47(XP_006444621.1)蛋白亲缘关系最近,并且都聚集在同一分支上,与龙眼WRKY47(AEO31517.2)蛋白亲缘关系较近,与葡萄WRKY47(XP_002281194.1)蛋白亲缘关系最远。
2.4 非生物胁迫处理对不同种类柑橘WRKY47基因表达的影响
分别对甜橙、柠檬、芦柑和金柑分别进行250 mmol/L NaCl、20% PEG-6000和4 ℃低温处理,取其叶片进行实时荧光定量表达分析。由图5a可知,250 mmol/L NaCl胁迫处理植株时,甜橙CsWRKY47在叶片中表达量逐渐升高,24 h时达到最大值,为对照的3倍左右,整体变化较大;柠檬ClWRKY47表達量在1 h时最低,此后逐渐升高,在6 h时达到最高,整体变化趋势为先升后降;芦柑CrWRKY47在高盐处理后,与对照相比,整体表达是下调的,表达量表现出受高盐处理的抑制;金柑FjWRKY47表达量整体呈现缓慢升高的趋势,在6 h时达到最大值。
由图5b可知,20% PEG6000模拟干旱胁迫处理时,甜橙CsWRKY47表达量在24 h内缓慢升高,在6 h和24 h时出现2次表达高峰;柠檬ClWRKY47的表达量呈现先升高后下降的趋势,在6 h时表达量达到最高;芦柑CrWRKY47在24 h内表达量变化趋势较平缓,在1 h、6 h以及12 h时表达量高于对照;金柑FjWRKY47对干旱胁迫也有响应,但其表达量低于对照,表明干旱胁迫对金柑FjWRKY47的表达有一定的抑制作用。
由图5c可知,4 ℃低温处理时,甜橙CsWRKY47表达量整体呈现先升高后下降的趋势,在12 h时表达量最高,为对照的2.7倍左右;柠檬ClWRKY47表达量与对照相比总体上变化不大,但在1 h和6 h时其表达量高于对照,说明低温能诱导其表达;芦柑CrWRKY47表达量在前12 h处于缓慢升高的趋势,但在24 h时表达量降低到最低;金柑FjWRKY47的表达量在24 h内都低于对照,说明低温胁迫抑制FjWRKY47的表达。
以上结果表明,在高盐、干旱和低温处理下,ClWRKY47、CsWRKY47、CrWRKY47和FjWRKY47的表达量都发生了改变。柠檬ClWRKY47和甜橙CsWRKY47均能被3种非生物胁迫诱导表达;芦柑CrWRKY47在干旱和低温胁迫下也能被诱导表达,但在高盐胁迫下表达量下调;金柑FjWRKY47 可以响应高盐胁迫,但在干旱和低温胁迫下,表达都低于对照,尤其是低温胁迫下,FjWRKY47明显下调表达。
3 讨论
WRKY家族转录因子具有调控植物生长发育和响应非生物胁迫等多种功能。但是,目前有关柑橘中WRKY转录因子的研究较少。为了初步验证柑橘中WRKY47基因对逆境的响应机制以及在不同柑橘种类中的差异,我们从柠檬、甜橙、芦柑、金柑中分别克隆出ClWRKY47、CsWRKY47、CrWRKY47和FjWRKY47基因。根据所含有的保守结构域的差异,WRKY转录因子可分为Group I、Group II和Group III 3类[16]。Group II最初又被分为IIa、IIb、IIc、IId和IIe 5个亚组,但最近的系统发育分析结果表明,IIa和IIb,IId和IIe分别被合并为IIa +IIb和IId+IIe [17]。在本研究中,多序列比对分析结果表明,这4种蛋白质与其他植物WRKY47蛋白都具有高度保守的WRKY结构域和C2H2锌指结构,这与前人研究结果[2]相吻合。同时,有研究结果表明,AtWRKY47蛋白属于Group IIb 类[11],推测ClWRKY47、CsWRKY47、CrWRKY47和FjWRKY47蛋白属于WRKY转录因子家族的Group IIa+IIb类。此外,通过系统进化树可以明显看出这4个蛋白质具有种属特异性,与克莱门柚WRKY47蛋白这个同属植物蛋白质亲缘关系最近且都聚集在进化树的同一个分支上,这与植物系统分类学的进化趋势是一致的。另外,通过对甜橙CsWRKY47氨基酸序列的分析发现,该蛋白质定位在细胞核上的可能性最高,符合转录因子的一般特征,即亚细胞定位于细胞核上[18-20],该结果还需要通过试验进一步验证。
顺式作用元件存在于基因的启动子中,一般是由5~20个碱基序列组成的特异性DNA序列,具有转录调节功能 [21]。对玉米基因ZmCIPK10和ZmZIP71启动子序列进行分析,发现两者启动子序列中含有大量的逆境相关元件,如脱落酸、低温等响应元件,进一步通过非生物胁迫处理植株后,发现在干旱、低温和高盐胁迫下,ZmCIPK10和ZmZIP71基因表达量上升,表明两者在植物应对逆境的过程中起调控作用[22-23]。在本試验中,对CsWRKY47基因启动子顺式作用元件进行预测分析,结果表明,该基因启动子包含多个光响应元件和植物逆境胁迫应答相关作用元件。由此推测,CsWRKY47基因可能受到光、激素及其他非生物胁迫的诱导,参与了植物非生物胁迫响应过程。欧芹在受到病原菌侵染时,PcWRKY1基因在短时间内会迅速表达且表达量显著增加,对其启动子序列分析发现,其自身启动子具有3个W-box元件, PcWRKYl蛋白不仅可以通过自身的启动子W-box元件与其他WRKY蛋白结合以行使功能,还可以通过该元件与自身结合并形成自我调节[24] 。本研究中,CsWRKY47基因启动子也含有W-box元件,猜测CsWRKY47蛋白可能可以与自身启动子结合以自我调节,或者与其他WRKY蛋白结合以调控其对逆境的响应表达。
前人研究结果表明,WRKY转录因子在植物响应非生物胁迫中扮演着重要的角色,例如在拟南芥中,AtWRKY25和AtWRKY33的表达受到NaCl和干旱处理的诱导并显著提高[25];蔡荣号等[26]在模式植物拟南芥中通过异源表达玉米ZmWRKY114基因发现转基因植株在高盐胁迫下绿苗率低于野生型植株,并且其根系生长也受到了抑制,ZmWRKY114基因在调控植物应对高盐胁迫的过程中可能起负调控作用。Zou等[27]对拟南芥的研究结果证实低温诱导了野生型拟南芥中AtWRKY34基因的表达。本研究结果表明,柠檬ClWRKY47和甜橙CsWRKY47都能被3种非生物胁迫诱导表达,但是芦柑CrWRKY47与金柑FjWRKY47对不同的胁迫表现出了差异表达。芦柑CrWRKY47在盐胁迫后表达下调,在干旱和低温胁迫下表达上调,金柑FjWRKY47在盐胁迫后上调表达,在干旱和低温胁迫后表达下调。植物在应对干旱胁迫和高盐胁迫的过程中,有很多基因参与响应胁迫,并在这2个胁迫过程中同一个基因起着相反的作用[28-29];也有基因在调控植物应对盐胁迫、低温胁迫和机械损伤过程中作用相反,例如杨树中,PtrWRKY75基因和PtrWRKY80基因的表达能被盐胁迫诱导,从而上调表达,但这2个基因对低温胁迫和机械损伤没有响应;PtrWRKY61基因和PtrWRKY88基因则特异性响应盐胁迫和机械伤害,对低温胁迫不响应[30]。因此,芦柑CrWRKY47与金柑FjWRKY47在不同的非生物胁迫处理后出现差异表达的原因可能是芦柑和金柑这2个柑橘种类自身遗传特性导致的,也可能是由于植物在不同的胁迫条件下,与不同柑橘种类WRKY47基因启动子结合的上游调控因子不同导致的。
综上所述,本研究克隆获得的ClWRKY47、CsWRKY47、CrWRKY47和FjWRKY47基因编码的转录因子属于WRKY转录因子家族的Group IIa+IIb类。顺式作用元件预测发现CsWRKY47基因启动子含有多种逆境相关元件。qRT-RCR表达分析结果揭示,CrWRKY47与FjWRKY47对不同非生物胁迫的响应不同。这些结果表明柑橘WRKY47可以响应多种非生物胁迫,可能在柑橘抵御非生物胁迫过程中发挥重要的作用。
参考文献:
[1] HIRAYAMA T, SHINOZAKI K. Research on plant abiotic stress responses in the post-genome era: past, present and future[J]. The Plant Journal, 2010,61(6): 1041-1052.
[2] LIU J H, PENG T, DAI W. Critical cis-acting elements and interacting transcription factors: key players associated with abiotic stress responses in plants[J]. Plant Molecular Biology Reporter, 2014, 32(2):303-317.
[3] REN X, CHEN Z, LIU Y, et al. ABO3, a WRKY transcription factor, mediates plant responses to abscisic acid and drought tolerance in arabidopsis[J]. Plant Journal for Cell & Molecular Biology, 2010, 63(3):417-429.
[4] XU Z S, CHEN M, LI L C, et al. Functions and application of the AP2/ERF transcription factor family in crop improvcmcn[J].J Integr Plaint Piol,2011,53(7):570-585.
[5] ISHIGURO S, NAKAMURA K. Characterization of a cDNA encoding a novel DNA-binding protein, SPF1, that recognizes SP8 sequences in the 5′ upstream regions of genes coding for sporamin and beta-amylase from sweet potato [J]. Molecular & General Genetics Mgg, 1994, 244(6):563-571.
[6] EULGEM T , RUSHTON P J , ROBATZEK S , et al. The WRKY superfamily of plant transcription factors.[J]. Trends in Plant ence, 2000, 5(5):199-206.
[7] CHEN L G, SONG Y, LI S J, et al. The role of WRKY transcription factors in plant abiotic stresses [J]. Biochim Biophys Acta, 2012, 1819 (2): 120-128.
[8] QIU Y , JING S , FU J , et al. Cloning and analysis of expression profile of 13 WRKY genes in rice[J]. Chinese Science Bulletin, 2004, 49(20):2159-2168.
[9] JIANG Y, DEYHOLOS M K. Comprehensive transcriptional profiling of NaCl-stressed arabidopsis roots reveals novel classes of responsive genes[J]. BMC Plant Biol, 2006,6:25.
[10]徐 麗,陈 新,宗晓娟,等. 樱桃砧木PcWRKY1基因的克隆与表达分析[J].江苏农业学报,2018,34(3):636-641.
[11]WANG X, LI J, GUO X, et al. PlWRKY13: a transcription factor involved in abiotic and biotic stress responses in paeonia lactiflora[J]. Int J Mol Sci, 2019,20(23):5953.
[12]钱靓雯. WRKY47在植物硒富积及耐受中的作用研究[D].合肥:合肥工业大学,2018.
[13]孟 云. 拟南芥WRKY47基因在镉胁迫应答中的作用机理研究[D].合肥:合肥工业大学,2019.
[14]RAINERI J, WANG S, PELEG Z, et al. The rice transcription factor OsWRKY47 is a positive regulator of the response to water deficit stress[J]. Plant Molecular Biology, 2015, 88(4/5):401-413.
[15]郭文芳. 柑橘抗逆相关基因NAC83、MYB15和COR15a的克隆与表达分析[D].南昌:江西农业大学,2015.
[16]LLORCA C M, POTSCHIN M, ZENTGRAF U. bZIPs and WRKYs: two large transcription factor families executing two different functional strategies[J]. Frontiers in Plant Science, 2014,5:169.
[17]RUSHTON D L, TRIPATHI P, RABARA R C, et al. WRKY transcription factors: key components inabscisic acid signaling[J]. Plant Biotechnol, 2012,10:2-11.
[18]LIU Y, YANG T, LIN Z, et al. A WRKY transcription factor PbrWRKY53 from Pyrus betulaefolia is involved in drought tolerance and AsA accumulation[J]. Plant Biotechnol J, 2019,17:1770-1787.
[19]GUO H, WANG Y, WANG L, et al. Expression of the MYB transcription factor gene BplMYB46 affects abiotic stress tolerance and secondary cell wall deposition in Betula platyphylla[J]. Plant Biotechnol J, 2017,15:107-121.
[20]魏 鑫,王寒涛,魏恒玲,等. 陆地棉GhWRKY33的克隆及抗旱功能分析[J].中国农业科学,2020,53(22):4537-4549.
[21]郭晋艳,郑晓瑜,邹翠霞,等. 植物非生物胁迫诱导启动子顺式元件及转录因子研究进展[[J].生物技术通报,2011 (4):16-20.
[22]赵晋锋,余爱丽,王寒玉,等. 非生物逆境胁迫下ZmCIPK10基因表达分析[J].生物技术进展,2011,1(2):130-134.
[23]刘彦丹,英 生,张登峰,等. 玉米逆境胁迫响应基因ZmbZIP71的克隆与表达分析[J].植物遗传资源学报,2011,12(5):775-781.
[24]TURCK F, ZHOU A, SOMSSICH I E. Stimulus-dependent, promoter-specific binding of transcription factor WRKY1 to Its native promoter and the defense-related gene PcPRl-1 in Parsley[J]. Plant Cell, 2004,16:2573-2585.
[25]LI S, FU Q, CHEN L, et al. Arabidopsis thaliana WRKY25, WRKY26, and WRKY33 coordinate induction of plant thermotolerance[J]. Planta,2011, 233(6):1237-1252.
[26]蔡荣号,李 尉,陈浩伟,等. 异源表达玉米ZmWRKY114基因增强拟南芥对盐胁迫的敏感性[J].安徽农业大学学报,2019,46(6):1040-1047.
[27]ZOU C, JIANG W, YU D. Male gametophyte-specific WRKY34 transcription factor mediates cold sensitivity of mature pollen in Arabidopsis[J]. J Exp Bot, 2010,61(14):3901-3914.
[28]XIANG Y, HUANG Y, XIONG L. Characterization of stress-responsive CIPK genes in rice for stress tolerance improvement[J]. Plant physiology, 2007, 144(3):1416.
[29]LEE S K, KIM B G, KWON T R, et al. Overexpression of the mitogen-activated protein kinase gene OsMAPK33 enhances sensitivity to salt stress in rice (Oryza sativa L.)[J]. J Biosci, 2011,36(1):139-151.
[30]JIANG Y Z, DUAN Y J, YIN J, et al. Genome-wide identification and characterization of the populus WRKY transcription factor family and analysis of their expression in response to biotic and abiotic stresses[J]. Journal of Experimental Botany,2014,9(22):22.
(責任编辑:陈海霞)
收稿日期:2020-10-13
基金项目:国家重点研发计划项目(2019YFD1000100);国家自然科学基金项目(31701896);江西省自然科学基金面上项目(20202BAB205001);江西省柑橘产业技术体系项目(JXARS-07-栽培岗位)
作者简介:沈 丹(1996-),女,江苏溧阳人,硕士研究生,研究方向为果树抗逆生理。(E-mail)sd17751769221@163.com
通讯作者:刘德春,(E-mail)ldc873380800@163.com;刘 勇,(E-mail)liuyongjxau@163.com

