四川地区藜麦叶斑病病原菌的分离及鉴定
廖映凯 罗吉 许芮涵 芶琳 邱爱东


摘要: 通过筛查并鉴定四川地区藜麦叶斑病的致病菌,旨在为后续研发生物防治制剂提供理论依据。分别采集成都金堂、十陵和西昌等种植基地患有藜麦叶斑病的植株。经组织分离、平板纯化分离菌株,并采用科赫法则确定致病菌;扩大培养致病菌菌株,提取其DNA,用rDNA-ITS(rDNA-內转录间隔区)、16S rDNA通用引物进行PCR扩增测序,对测序结果进行BLAST比对,并用MEGA 4.0构建系统发育树。结果显示,分离筛选到的2株细菌菌株SCCDP-2、SCCDP-4能够导致四川地区藜麦叶斑病的发生,经鉴定为成团泛菌(Pantoea agglomerans)。
关键词: 藜麦叶斑病;病原菌;鉴定
中图分类号: S432.4+2 文献标识码: A 文章编号: 1000-4440(2021)01-0060-07
Isolation and identification of leaf spot disease pathogen of Chenopodium quinoa in Sichuan
LIAO Ying-kai1, LUO Ji1, XU Rui-han1, GOU Lin2, QIU Ai-dong1
(1.School of Pharmacy and Bioengineering, Chengdu University, Chengdu 610106, China;2.College of Life Science, Sichuan Agricultural University, Chengdu 611130, China)
Abstract: The pathogenic bacteria of Chenopodium quinoa leaf spot disease in Sichuan were screened and identified to provide theoretical basis for subsequent development of biological control agents. The plants infected with C. quinoa leaf spot disease were collected from Jintang, Shiling and Xichang planting bases in Chengdu. The strains were isolated by tissue isolation and plate purification, and the pathogenic bacteria were determined according to Kochs postulates. The pathogenic strains were further cultivated, and its DNA was extracted. The universal primers of rDNA-ITS and 16S rDNA were used for PCR amplification and sequencing, and the sequencing results were compared by BLAST. In addition, MEGA 4.0 was used to build phylogenetic trees. The results showed that the isolated and screened two strains SCCDP-2 and SCCDP-4 could cause the occurrence of C. quinoa leaf spot disease in Sichuan, and the two strains were identified as Pantoea agglomerans.
Key words: leaf spot disease of Chenopodium quinoa;pathogenic bacteria;identification
藜麦(Chenopodium quinoa)是藜科藜属植物,原产于南美洲的安第斯山高原地区,具有5 000~7 000年的种植历史[1]。藜麦具有很高的营养价值,被联合国粮食及农业组织推荐为适宜人类食用的“全营养食品”,其蛋白质含量显著高于水稻和玉米,达到16%~30%,此外,藜麦的必需氨基酸比例较均衡,并且极易被人体吸收[2-4]。20世纪80年代末,藜麦被引入中国西藏地区进行试种研究,2008年以后开始得到大规模引种[5]。随着种植规模的扩大,藜麦病害愈发突显,从而严重影响了其产量,尤其在四川地区,藜麦叶斑病的发病率约为40%,在严重的地块甚至达到80%。患病藜麦叶片上出现坏死病灶,呈斑点状,中间浅黄色,边缘褐色,外围有褪绿晕圈,严重时可导致藜麦死亡。本研究对四川地区藜麦叶斑病患病植株进行采样及病原菌分离,根据形态学特征并结合rDNA-ITS(rDNA-内转录间隔区)、16S rDNA序列分析,对藜麦叶斑病致病菌进行系统鉴定,以期为藜麦叶斑病的后续生物防治提供理论依据。
1 材料与方法
1.1 病菌标本的采集
2019年5月在四川省成都市龙泉驿区、成都市金堂县、西昌市美姑县、凉山彝族自治州盐源县藜麦种植基地采集藜麦叶斑病的新鲜患病植株。
1.2 试剂
葡萄糖、无水乙醇、次氯酸钠、琼脂、巯基乙醇等试剂均为国产分析纯,胰蛋白胨、酵母提取物均购自上海汉尼生物技术有限公司,DNA提取试剂盒购自成都福际生物技术公司。
1.3 引物
rDNA-ITS、16S rDNA通用引物序列由北京擎科生物科技有限公司成都分公司合成,详见表1。
1.4 试验方法
1.4.1 病原菌的分离 选取有典型叶斑病症状的藜麦叶片,用组织分离法分离病原菌[6]。用无菌水冲洗病株叶片后,将叶片放入75%乙醇中浸泡35 s,再用0.2%次氯酸钠浸泡60 s,随后用无菌水冲洗3次,最后将叶片置于无菌滤纸上晾干。将用上述方法處理的叶片切块后置于LB、PDA固体培养基上培养,挑取单菌落,反复纯化得到纯菌株。
1.4.2 菌落的形态学观察 将得到的纯化菌株分别置于PDA、LB固体培养基上,于25 ℃恒温培养,肉眼观察菌落的形态特征。对菌落进行革兰氏染色后,在光学显微镜下观察菌落的形态特征。
1.4.3 致病性鉴定 在温室条件下栽培藜麦,当藜麦长至5~6叶期时,采用针刺接种法用分离纯化得到的供试菌液(原菌液与无菌水的体积比为1∶5)分别接种叶片,以接种灭菌蒸馏水的处理作为对照。每天观察藜麦叶片的生长状态,从患病叶片中再次分离筛选菌株。根据柯赫法则,重复进行3次,确定致病菌株。
1.4.4 分子生物学鉴定 (1)病原菌DNA的提取。按试剂盒说明书提取致病菌株的DNA。
(2)内转录间隔区(ITS)基因的扩增。以菌株DNA为模板,用27F、1492R引物PCR扩增16S rDNA,反应体系:3.5 μl模板,2.0 μl引物(10.0 μmol/L),12.5 μl Taq PCR master Mix,7.0 μl ddH2O,总体积25.0 μl。PCR扩增条件:94 ℃预变性4 min;94 ℃变性40 s,52 ℃退火45 s,72 ℃延伸1min,30个循环;72 ℃延伸10 min。
用ITS1、ITS4引物PCR扩增rDNA-ITS的反应体系:3.5 μl模板,2.0 μl引物(10.0 μmol/L),12.5 μl Taq PCR master mix,7.0 μl ddH2O,总体积为25.0 μl。PCR扩增条件:94 ℃预变性4 min;94 ℃变性40 s,55 ℃退火45 s,72 ℃延伸1 min,30个循环;72 ℃延伸10 min。将PCR扩增产物于4 ℃保存,并进行凝胶电泳验证。
(3)核酸序列的测定。PCR产物由北京擎科生物科技有限公司成都分公司进行测定。在GenBank中对测得的核酸序列进行BLAST比对分析。
1.4.5 系统发育树的构建 用MEGA 4.0软件进行核酸序列的聚类分析,用邻接法(NJ)构建系统发育树。
2 结果与分析
2.1 病株采集
采集藜麦发病初期、中期、后期3个时期的病株。在发病初期,病斑直径约为4 mm(图1a);在发病中期,病斑颜色加深,形状渐渐不规则,最大直径接近1 cm(图1b);在发病后期,病斑颜色较深,部分叶片呈枯萎状(图1c)。
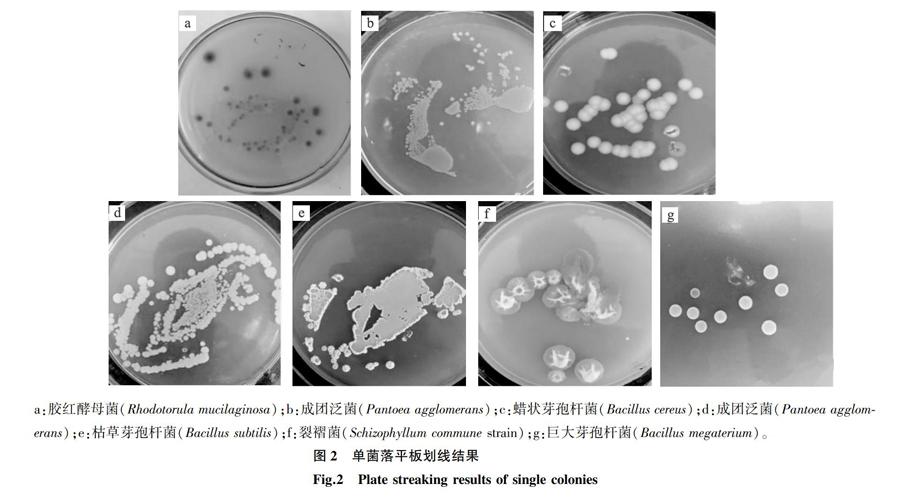
2.2 病原菌的分离纯化
采集藜麦病株后,用组织分离法[6]进行病原菌的分离,获得如图2a至图2g所示纯化菌株。通过肉眼观察可知,图2a、图2f的菌株呈现真菌菌落形态,图2b、图2c、图2d、图2e、图2g的菌株表现为细菌菌落形态。经分子生物学鉴定可知,图2a至图2g分别为胶红酵母菌(Rhodotorula mucilaginosa)、成团泛菌(Pantoea agglomerans)、蜡状芽孢杆菌(Bacillus cereus)、成团泛菌(P. agglomerans)、枯草芽孢杆菌(Bacillus subtilis)、裂褶菌(Schizophyllum commune strain)、巨大芽孢杆菌(Bacillus megaterium),分别编号为1、2、3、4、5、6、7。
2.3 致病性鉴定
配制1~7号菌株的菌液并接种健康藜麦叶片。结果表明,用灭菌水(对照)和编号为1、3、5、6、7的菌株接种10 d后,植株未见病斑发生(图3a、图3b)。由图3c、图3d可见,用编号为2、4的菌株处理植株10 d后,均有病斑发生。由图3e、图3f可见,用编号为2、4的菌株接种15 d后,植株患病症状明显加重,病斑扩大并增多,并且病斑颜色加深。用编号为2、4的菌株接种植株后,从感病叶片中分离纯化病菌,观察到与供试菌株相似的形态特征(图3g、图3h),且重复3次接种试验的结果均一致。将分离获得的2株藜麦叶斑病致病菌分别命名为SCCDP-2、SCCDP-4。
2.4 形态学鉴定
将SCCDP-2、SCCDP-4致病菌在LB固体培养基上培养后肉眼观察菌落的特征,同时通过显微镜观察菌落的形态特征。由图4a可见,经24 h固体培养基培养,菌落呈白色,并且表面光滑、边缘整齐;48 h后,菌落颜色变黄,直径达到2~3 mm,微凸起于平板,在紫外灯下未出现黄色荧光(图4b);显微镜(×100)观察结果显示,菌体呈直杆状,大小为(1.0~2.5) μm×(0.5~1.0) μm,无菌丝结构(图4c);革兰氏染色结果显示,菌落呈阴性,有周生鞭毛(图4d)。结合肉眼观察结果得出,SCCDP-2、SCCDP-4这2株致病菌的形态学特征与细菌一致。
2.5 分子生物学鉴定
分别提取分离获得的2株致病菌的DNA,并用引物进行PCR扩增。图5为PCR扩增得到的电泳图谱,其中1号、2号条带对应致病菌SCCDP-2的电泳结果,3号、4号条带对应致病菌SCCDP-4的电泳结果,可见这2个菌株的16S rDNA扩增产物大小约为1 000 bp。菌株SCCDP-2、SCCDP-4的16S rDNA测序结果分别见图6、图7。将菌株SCCDP-2、SCCDP-4的16S rDNA测序结果在GenBank中进行BLAST比对可知,菌株SCCDP-2、SCCDP-4的16S rDNA碱基序列分别与Pantoea agglomerans strain C410P1、Pantoea agglomerans strain NA131的16S rDNA碱基序列有99%、99%的同源性。
2.6 系统发育树
用MEGA 4.0对致病菌(SCCDP-2、SCCDP-4)的16S rDNA碱基序列进行聚类分析,并用NJ法构建系统发育树。由图8可见,致病菌SCCDP-2和SCCDP-4的16S rDNA碱基序列与泛菌属(Pantoea)中的成团泛菌(Pantoea agglomerans)处于同一分支,且自展值支持率达到99%以上,提示致病菌SCCDP-2菌株与SCCDP-4菌株的起源相同,是成团泛菌的不同亚型。
3 讨论
本研究通过对藜麦叶斑病患病植株进行病菌的分离、培养、纯化,共得到7株菌株。依据科赫法则,用7株菌株的菌液分别浸染健康藜麦植株,筛选得到2株能够导致藜麦叶斑病的菌株,经形态学和分子生物学鉴定,确定这2株菌株为成团泛菌,并且是该菌属的不同亚型。
目前,国内外关于藜麦相关病害的系统性研究还比较缺乏,对藜麦叶斑病病因的研究也存在差异。段慧[7]在内蒙古种植区通过研究判断,导致藜麦叶斑病发生的病原菌为链孢属(Alternaria);Testen等[8]在美国发现的藜麦钉孢叶斑病的致病菌为藜钉孢(Passalora dubia);殷辉等[9]的研究结果却显示,造成藜麦钉孢叶斑病的病原菌为藜尾孢(Cercospora.cf.chenopodii)。笔者的研究结果表明,在四川地区,导致藜麦叶斑病發生的致病菌为成团泛菌。造成以上差异的原因,可能与不同地域、不同藜麦品种等因素有关。笔者分离得到的2株细菌菌株能够感染健康植株,其16S rDNA碱基序列与成团泛菌的同源性达99%以上,系统发育树结果显示,这2个分离菌株与成团泛菌属于同一分支,自展值支持率达到99%,提示这2株菌株源于同一祖先,是成团泛菌的不同亚型。成团泛菌作为藜麦叶斑病的致病菌系首次报道。
成团泛菌属于肠杆菌目肠杆菌科泛菌属,为泛菌属的模式种[10]。泛菌属由成团泛菌(P.agglomerans)和分散泛菌(P.dispersa)2个种组成,是由Beji等[11]和Mergaeri等[12]于1989年提出的新属。泛属菌广泛存在于土壤、水、植物种子表面以及动物和人的伤口、体液中,并可引起病害发生[13]。据报道,成团泛菌在植物上可引起稻谷内颖褐变[14]以及洋葱腐烂病[15]、棉花细菌性烂铃病[16]、香蕉叶鞘腐败病[10]、玉米秆茎腐病等[13]。由于四川地区植物种类丰富、种植密度较大,能够为成团泛菌侵染藜麦提供有利条件;另外,四川盆地气候湿润,温度适宜,也利于成团泛菌的生长。这些原因可能成为四川地区藜麦叶斑病致病菌为成团泛菌的重要因素。为了提高四川地区藜麦的种植产量及品质,下一步将对成团泛菌的致病机制进行深入探讨,同时也将开展四川地区藜麦叶斑病的生物防治研究。
参考文献:
[1] ANDRS Z S, FRANCISCO F, PABLO Z, et al. Breeding quinoa (Chenopodium quinoa Willd.): potential and perspectives[J]. Molecular Breeding,2014,34(1):13-30.
[2] WRIGHT K H, PIKE O A, FAIRBANKS D J, et al. Composition of Atriplex hortensis, sweet and bitter Chenopodium quinoa seeds[J]. Journal of Food Science, 2002, 67(4): 1383-1385.
[3] VEGA-GLVEZ A, MIRANDA M, VERGARA J, et al. Nutrition facts and functional potential of quinoa (Chenopodium quinoa Willd.), an ancient Andean grain: a review[J]. Journal of the Science of Food and Agriculture, 2010, 90(15): 2541-2547.
[4] ABUGOCH J L E. Quinoa (Chenopodium quinoa Willd): composition, chemistry, nutritional, and functional properties[J].Advances in Food and Nutrition Research, 2009, 58:1-31.
[5] 任贵兴,杨修仕,么 杨. 中国藜麦产业现状[J].作物杂志,2015(5):1-5.
[6] 张瑞颖,左雪梅,姜瑞波,等. 平菇褐斑病病原菌的分离与鉴定[J].中国食用菌,2007,26(5):58-60.
[7] 段 慧. 藜麦叶斑病病原菌分离鉴定与防治[D].呼和浩特:内蒙古农业大学,2017.
[8] TESTEN A L, MCKEMY J M, BACKMAN P A. First report of passalora leaf spot of quinoa caused by Passalora dubia in the United States[J]. Plant Disease,2013,97(1):139.
[9] 殷 辉,周建波,吕 红,等. 藜麦尾孢叶斑病的病原鉴定[J].植物病理学报,2019,49(3):408-414.
[10]严玉宁,何 红,叶艺俊,等. 香蕉叶鞘腐败病病原鉴定[J].植物病理学报,2011,41(2):124-130.
[11]BEJI A,MERGAERI J,GAVINI F, et al. Subjective synonymy of Erwinia herbicola, Erwinia milleliae, and Enterobacter agglomerans and redefinition of the taxon by genotypic and phenotypic data[J]. International Journal of Systematic Bacteriology, 1988,38(l):77-78.
[12]MERGAERI J, VERDONCK L, KERSTERS K. Transfer of Erwinia ananas (synonym, Erwinia uredovora) and Erwina stewartii to the genus Pantoea emend. as Pantoea ananas (Serrano 1928) comb.nov. and Pantoea stewartii (Smith 1898) comb.nov., respectively, and description of Pantoea stewartii subsp. indologenes subsp. nov[J].International Journal of Systematic Bacteriology, 1993, 43(l):162-173.
[13]曹慧英. 玉米新病害——細菌干茎腐病的研究[D].北京:中国农业科学院,2010.
[14]谢关林,徐传雨,任小平. 稻谷病原细菌Pantoea agglomerans的特征化研究[J].浙江大学学报(农业与生命科学版),2001,27(3):317-320.
[15]TOMOHIRO M, YUTA N, GO Y, et al. The plant pathogen Pantoea ananatis produces N-acylhomoserine lactone and causes center rot disease of onion by quorum sensing[J].Journal of Bacteriology,2007,189(22):8333-8338.
[16]MEDRANO E G, BELL A A. Role of Pantoea agglomerans in opportunistic bacterial seed and boll rot of cotton (Gossypium hirsutum) grown in the field[J]. Journal of Applied Microbiology,2007,102(1):134-143.
(责任编辑:徐 艳)
收稿日期:2020-04-16
作者简介:廖映凯(1993-),男,四川成都人,硕士研究生,研究方向为杂粮病因学。(E-mail)631459439@qq.com
通讯作者:邱爱东,(E-mail)quad69@163.com

