当归多糖通过TLR4/NF-κB 信号通路对糖尿病肾病大鼠的影响
白 宇,杨丽霞,贺 云,杨 倩,孟祥云,王永胜
(1.甘肃中医药大学,甘肃 兰州73000;2.陕西省榆林市中医医院,陕西 榆林 719000;3.甘肃省中医药研究院,甘肃 兰州 730050;4.甘肃省中医院,甘肃 兰州 730000)
糖尿病肾病 (diabetic nephropathy,DN) 是糖尿病(diabetes mellitus,DM) 常见的严重的慢性微血管并发症之一,是导致终末期肾病的主要原因,死亡率较高[1]。DN的发病机制目前尚未阐明,现代医学认为其机制主要与糖脂代谢紊乱、血流动力学改变、细胞因子、炎性反应、氧化应激、遗传等因素有关,其主要病理改变为肾脏中肾小球足细胞数量减少、肾小球基底膜增厚、肾小球系膜增生,最后发展为肾小球硬化和肾间质纤维化。目前DN 的临床疗效较差,因此发掘治疗DN 安全、有效的中药单体或复方备受肾病学界的关注。
高血糖刺激多种免疫炎症信号通路的激活及其相关炎症因子的分泌失调是导致DN 发生、发展的主要原因[2],其中TTLR4/NF-κB 通路是介导免疫炎症反应的关键信号通路[3]。大量的临床和实验研究发现当归及其相关复方可通过调节糖尿病肾病肾组织的免疫反应,发挥保护及治疗DN的作用,进一步研究发现当归中具有药理活性的成分包括挥发油、多糖、黄酮以及有机酸等。其中当归多糖对多种疾病表现出较好的治疗效果,具有抗肿瘤、抗氧化和调节免疫等作用[4],但其对DN 的治疗作用尚未见报道,因此本研究将当归多糖应用于对糖尿病肾病大鼠的治疗,观察其治疗效果并基于肾组织TLR4/NF-κB 通路及单核细胞趋化因子(monocyte chemotactic factor,MCP-1)、肿瘤坏死因子α (tumor necrosis factor-α,TNF-α)、白细胞介素-1 (interleukin-1,IL-1) 的表达,探讨当归多糖对糖尿病肾病的作用机制。
1 材料
1.1 动物 SD 大鼠60 只,10 周龄,雌雄各半,SPF 级,体质量(200±10) g,购于甘肃中医药大学[动物生产许可证号SCXK(甘) 2015-0002],饲养于甘肃中医药大学实验动物中心SPF 级实验室,温度22~24 ℃,相对湿度50%~70%,适应性喂养1 周后开始实验。
1.2 药物及试剂 当归多糖(批号CY170321,纯度≥98%) 购自陕西慈缘生物技术有限公司,用无菌PBS 配制成200 mg/mL 溶液,并过滤除菌,得到贮存液。厄贝沙坦片(批号4A294) 购自杭州赛诺菲制药有限公司,用无菌PBS 配制成6.75 mg/mL 溶液,并过滤除菌,得到贮存液。链脲霉素(批号B57377) 购自美国Sigma 公司。鼠抗人TLR4 单克隆抗体、兔抗人NF-κB (P-p65) 多克隆抗体、兔抗人 MYD88 多克隆抗体 (批号分别为8217052、4041556、821705157) 购自美国GeneTex 公司;逆转录试剂盒、Q-PCR 试剂盒(批号分别为A140704A、AA1102-1)购自日本TaKaRa 公司;尿微量蛋白测定试剂盒(批号A045-2) 购自南京建成生物工程研究所有限公司。引物均由日本TaKaRa 公司合成,见表1。

表1 引物序列
1.3 仪器 高速低温离心机(湖南赛特湘仪离心机仪器有限公司);超低温冰箱(中科美菱低温科技有限责任公司);Western blot 转膜仪、电泳仪(北京六一生物科技有限公司);化学发光成像仪(北京赛智科技有限公司);正置光学显微镜(日本奥林巴斯公司);自动凝胶成像系统(北京赛智创业科技有限公司);血糖仪(德国罗氏公司);实时定量Agilent PCR 仪(美国安捷龙公司);酶标仪(美国Bio-Rad 公司);转轮切片机(美国Stoelting 公司)。
2 方法
2.1 分组、造模及给药 参考文献[5] 方法,大鼠适应性饲养1 周后,按照随机数表法随机抽取10 只给予普通饲料喂养,其余50 只大鼠给予高脂高糖饲料喂养4 周,复制模型前禁食不禁水12 h,腹腔注射链脲佐菌素 (STZ)35 mg/kg,72 h 后取尾静脉血测定血糖,若空腹血糖>16.7 mmol/L,确认为糖尿病模型,未成功模型追加1 次STZ (17.5 mg/kg)。继续喂养4 周,用代谢笼收集24 h尿,24 h尿蛋白>30 mg 的大鼠即为糖尿病肾病大鼠,取造模成功的40 只大鼠随机分为5 组,模型组、阳性对照组(厄贝沙坦) 及当归多糖低、中、高剂量组(将当归多糖储存液分别稀释至50、100、200 mg/mL,使低、中、高剂量组灌药容量均为2 mL/kg),每组8 只,雌雄各半,每天灌胃给药。从普通喂养的大鼠中挑选8 只作为正常组,正常组和模型组灌服等容量蒸馏水,灌胃4 周,每日1 次。
2.2 样本采集 各组大鼠在给药4 周后禁食不禁水,代谢笼中收集24 h 尿液,-20 ℃保存待测,腹主动脉采血,分离血清,-20 ℃保存。采血后处死大鼠,分离肾脏,纵向切开成若干份,根据不同检测方法,分别置于4% 多聚甲醛和液氮中储存,待测。
2.3 一般情况与血糖、24 小时尿蛋白的检测 观察大鼠一般状况、饮水量、摄食量。其中在STZ 注射前后、灌药4 周末采尾静脉取血检测血糖,检测代谢笼收集的24 h 尿液中蛋白。
2.4 肾组织形态学特征 肾组织在4% 多聚甲醛中固定1 周,进行梯度酒精和二甲苯脱水。浸蜡包埋,待干燥后,切成4 μm 厚切片,贴片后,逆上述脱水步骤,进行水化,苏木素室温染色5 min,水洗,盐酸酒精分色,水洗,伊红染色30 s,按上述脱水步骤进行脱水透明,封片后显微镜下观察。
2.5 RT-PCR 实验 从液氮中取出保存的肾组织,在匀浆器中迅速研碎后加入适量TRIzol,在冰上继续研磨成匀浆,并静置5 min,13 000 r/min 离心10 min,取上清加入1/5体积TRIzol 的氯仿,室温静置5 min,13 000 r/min 离心10 min,取上清水相,加入等体积异丙醇,室温静置10 min,13 000 r/min 离心10 min,收集沉淀,75%乙醇洗涤2 次,室温晾干,加水溶解(以上皆用无RNA 酶试剂耗材完成)。然后经过RNA 含量检测、去基因组DNA 反应、cDNA 合成反应和实时荧光定量PCR 反应检测组织中mRNA 表达。荧光定量反应程序为预变性95 ℃、10 min、循环数1;扩增95 ℃、15 s,60 ℃、15 s,72 ℃、30 s、循环数40。用2-△△Ct表示基因相对表达量。
2.6 Western blot 实验 取大鼠新鲜肾脏组织,加入RIPA 裂解液,置于冰上研碎至匀浆后,4 ℃放置30 min,13 000 r/min离心10 min,取一部分上清,BCA 试剂盒检测蛋白浓度,另一部分上清加入上样缓冲液,煮沸变性后,加到4%浓缩胶浓缩,10%分离胶分离,再经过转膜、封闭、4 ℃孵育一抗(TLR4、MyD88、NF-κB 稀释比例分别为1 ∶2 000、1 ∶2 000、1 ∶3 000)、室温孵育二抗 (TLR4、MyD88、NF-κB 稀释比例1 ∶6 000)、ECL 发光液显色、电子曝光等步骤,最后进行数据分析。
2.7 统计学分析 采用SPSS21.0 软件进行分析,计量资料以() 表示,多组间比较用单因素方差分析,组间两两比较用LSD 分析,方差不齐时用Dunnett’s 法。以P<0.05 表示差异具有统计学意义。
3 结果
3.1 一般情况分析 正常组大鼠精神状态良好,反应机敏,毛发柔顺而光泽,饮食正常,体质量增加,尿量正常,粪便呈棕褐色颗粒状,垫料干燥;其他各组大鼠则不同程度出现精神倦怠萎靡,喜蜷卧睡觉,毛发晦暗无光泽,不柔滑,腹部皮毛潮湿且有腥臭味,活动量少,进食量多,饮水量也明显增多,每日换下的垫料潮湿,饲养盒底部存有大量尿液。后期大鼠极度虚弱,其中模型组大鼠症状表现最为严重,经药物治疗4 周后,中药各剂量组和阳性对照组大鼠情况有所改善,反应比之前灵敏,毛发稍微有光泽,进食量和饮水量均少于模型组。
3.2 STZ 注射前后大鼠血糖比较 STZ 注射前各组大鼠血糖比较无统计学意义(P>0.05),血糖在正常范围内,与STZ 注射前相比,除正常组外,STZ 注射后模型组及各药物干预组血糖升高(P<0.01)。与STZ 注射后相比,给药4周末厄贝沙坦组、当归多糖高剂量组血糖下降(P<0.05)。给药4 周末,与模型组比较,各药物干预组血糖下降(P<0.01)。见表2。
表2 各组大鼠血糖变化(,mmol/L)

表2 各组大鼠血糖变化(,mmol/L)
注:同一组下,与STZ 注射前比较,**P<0.01;与STZ 注射后比较,#P<0.05;同一时间下与模型组比较,▲▲P<0.01。
3.3 24 小时尿微量白蛋白的比较 与STZ 注射前相比,除正常组外,STZ 注射后4 周各组大鼠24 h 尿蛋白均增加(P<0.01);与STZ 注射后相比,给药4 周末厄贝沙坦组24 h尿蛋白下降(P<0.01)。给药4 周末,与模型组比较,各药物干预组24 h 尿蛋白下降(P<0.05)。见表3。
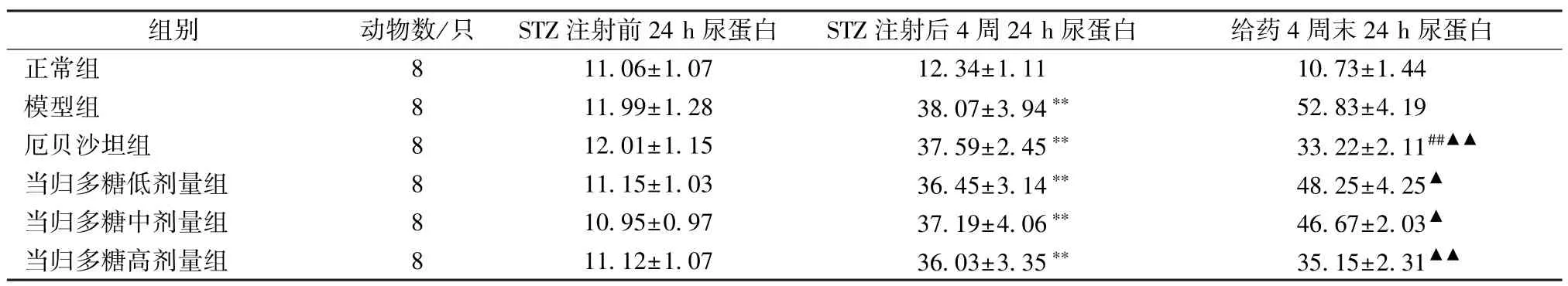
表3 各组大鼠24 h 尿蛋白变化(x±s,mg/24 h)
3.4 肾组织病理变化 正常组大鼠肾脏组织结构整齐、清晰,肾小球形态正常,肾小管官腔正常且不规则,胞质染色正常;与正常组相比,模型组肾小管管腔变大,管腔内可见透明管型,空泡化明显,胞质染色变浅,肾小管上皮细胞核固缩,肾小球体积变小,核固缩明显;与模型组相比,阳性药物组中肾小管管腔明显变小,未见空泡化改变,胞质染色相对加深,肾小球体积增大;与模型组相比,随着当归多糖剂量的增加肾小管管腔基本正常,胞质染色明显加深,肾小球体积增大,无固缩;高剂量组与阳性药物组的病理改变几乎一致。见图1。
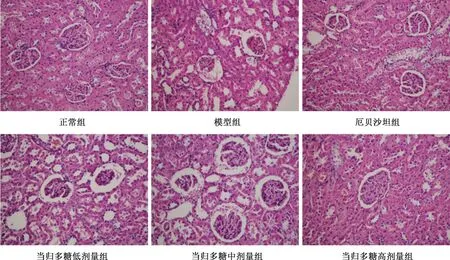
图1 各组大鼠肾组织病理变化(HE,×200)
3.5 肾组织中炎症因子mRNA 表达 与正常组相比,模型组大鼠肾组织中MCP-1、TNF-α、IL-1 mRNA 表达升高(P<0.01);与模型组相比,厄贝沙坦组大鼠肾组织中MCP-1、TNF-α、IL-1 mRNA 表达降低,当归多糖中剂量组大鼠肾组织中TNF-αmRNA 表达降低,当归多糖高剂量组大鼠肾组织中MCP-1、TNF-α、IL-1 mRNA 表达降低(P<0.05,P<0.01)。见图2。
3.6 肾组织中TOLL 样信号通路中TLR4、MyD88、NF-κB(p65) mRNA 表达 与正常组相比,模型组大鼠肾组织中TLR4、MyD88、NF-κB(p65) mRNA表达升高(P<0.01);与模型组相比,阳性药物组大鼠肾组织TLR4、MyD88、NFκB(p65) mRNA 降低,当归多糖中剂量组大鼠肾组织TLR4 和MyD88 mRNA 表达、当归多糖高剂量组大鼠肾组织TLR4、MyD88、NF-κB(p65) mRNA 表达降低(P<0.01,P<0.05)。见图3。
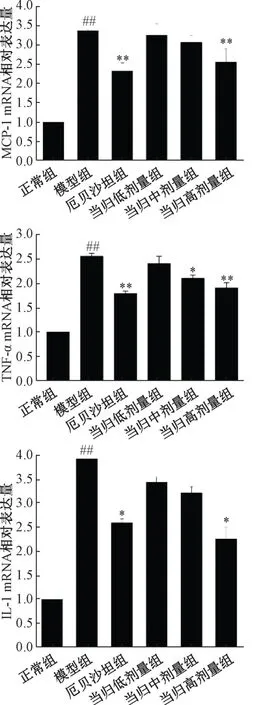
图2 当归多糖对糖尿病大鼠肾组织中MCP-1、 TNF-α、IL-1 mRNA 表达的影响
3.7 肾组织中TOLL 样信号通路中TLR4、MyD88、NF-κB(P-p65) 蛋白表达 与正常组相比,模型组大鼠肾组织中TLR4、MyD88 和NF-κB (P-p65) 蛋白表达升高 (P<0.01);与模型组相比,厄贝沙坦组大鼠肾组织TLR4、MyD88、NF-κB (P-p65) 蛋白表达降低,当归多糖中剂量组大鼠肾组织MyD88 和NF-κB (P-p65) 蛋白表达降低,当归多糖高剂量组大鼠肾组织TLR4、MyD88 和NF-κB (Pp65) 蛋白表达降低(P<0.05,P<0.01)。见图4。
4 讨论
DN 是糖尿病致死率较高的慢性并发症之一,难以根治,目前临床上应用中西医结合治疗能有效的减轻DN 患者的临床症状,改善其生活质量[6],但其中的机制尚不明确,故本研究采用中药单体当归多糖干预糖尿病肾病大鼠,为探索其效果及可能的治疗机制。本研究通过高脂高糖饲料联合STZ 注射建立DN 大鼠模型,经当归多糖干预后,与模型组相比,高剂量组DN 大鼠在第4 周血糖显著降低,提示当归多糖对糖尿病肾病具有一定的缓解作用,其具体分子机制尚需进一步研究。以上虽未直接证明当归多糖对DN 肾组织炎症反应有缓解作用,但由于DN 肾组织中的炎症反应是由高血糖引起的,因此当归多糖可通过降低血糖间接缓解DN 肾组织炎症反应。

图3 当归多糖对糖尿病大鼠肾组织中TLR4、MyD88、 NF-κB mRNA 表达的影响
DN 发病过程中,肾功能会逐渐受到损害,肾功能损害导致尿液中24 h 尿蛋白明显升高,因此,可通过24 h 尿蛋白的变化判断DN 肾功能的改变[7]。为研究当归多糖是否对DN 肾组织具有保护作用,本研究对DN 大鼠24 h 尿蛋白进行了检测,结果发现在经过当归多糖干预4 周后,尽管各组大鼠24 h 尿蛋白一直处于上升趋势,但与模型组相比,低、中、高剂量组均出现显著下降,这一结果提示当归多糖对糖尿病肾病肾组织具有保护作用。
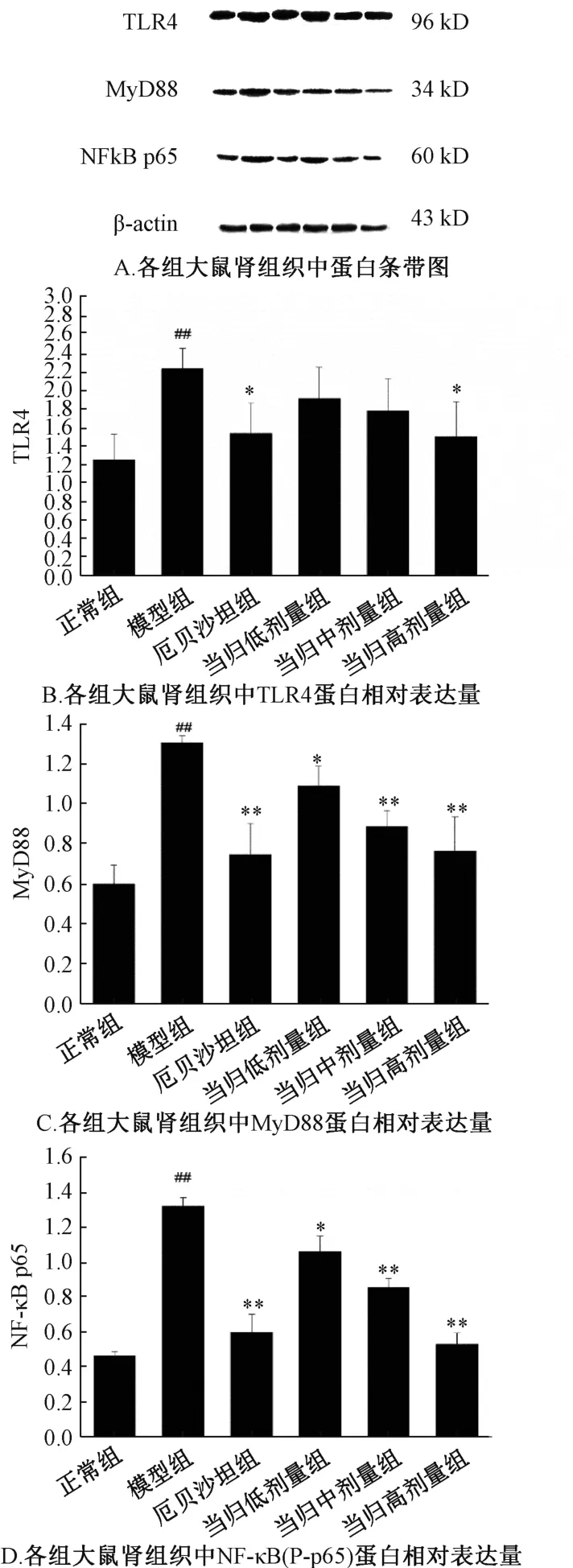
图4 当归多糖对糖尿病大鼠肾组织中TLR4、MyD88、NF-κB 蛋白表达的影响
炎症反应是DN 肾组织损伤的重要原因,DN 患者血液中高血糖可激活肾组织多条介导炎症的信号通路,TLR4/NF-κB 信号通路就是其中一条。在高糖因素的刺激下,激活了细胞膜上的TLR4,通过相关接头蛋白如:MyD88、IRAK-2、IRAK-4 等介导胞内信号传递,最终激活NF-κB,NF-κB 进入细胞核内转录、翻译[8-11],使得大量炎症因子如MCP-1、IL-1、TNF-α 等炎症因 子被释放入血[12-15],MCP-1 进入血液后激活和趋化巨噬细胞等免疫细胞聚集在肾组织中,增加细胞外基质沉积[16-17],TNF-α 可以改变肾小球基底膜的通透性,刺激成纤维细胞增殖,引起肾脏微血管结构改变[18-20],IL-1 介导中性粒细胞浸润,损伤内皮细胞,同时诱导其他炎症因子的释放,具有扩大效应[21-22]这些炎症因子的释放加快了DN 的发生发展。
上述研究已初步证实当归多糖对DN 肾组织具有保护作用。为进一步证实这种保护作用是否是通过抑制TLR4/NF-κB 炎症信号通路实现的,本研究对各组大鼠肾组织中TLR4/NF-κB 信号通路中蛋白和基因进行检测,结果发现与模型组相比,高剂量组肾组织中TLR4、MyD88、NF-κB 蛋白和基因降低。为证实当归多糖是通过减少炎症因子的释放从而达到保护肾脏的作用,本研究对肾组织中MCP-1、TNF-α、IL-1 mRNA 进行检测,结果发现当归多糖高剂量组可明显降低上述三种因子的表达,对糖尿病肾病肾组织起到保护作用。
综上,当归多糖可降低糖尿病肾病大鼠血糖,延缓肾组织损伤,对糖尿病肾病大鼠肾组织具有保护作用,其保护机制是当归多糖有效抑制TLR4/ NF-κB 信号通路中TLR4、MyD88、NF-κB 的蛋白和基因表达,降低MCP-1、TNF-α、IL-1 的释放从而减轻肾组织中的炎症反应,延缓DN 的进展。