第29届国际生物学奥林匹克竞赛试题 实验1 生物化学和分子生物学
杨 扬 张 立 张雁云 范六民 周 洁
(1 清华大学生命科学学院 北京 100084 2 北京师范大学生命科学学院 北京 100875 3 北京大学生命科学学院 北京 100871 4 华中师范大学第一附属中学 湖北武汉 430223)
总分:100 分 时间:90 min
一般信息
●流程说明和答题纸将在你位置的信封中提供。
●总分:100 分。
●考试时间:90 min。
●请将你的学生代码写入标题页左上角的框中。
●将提供单独的答题纸,用于写下所有答案。写在问题纸上的答案将不会得分。
●为了出示小旗,请将其置于桌子左墙上的旗架(=小管)中。
●请确保你的位置有全部材料和设备。如果缺少任何东西,你必须在哨声开始后5 min 内通过出示黄旗报告。5 min 后申报缺少任何物品将不予考虑。
●如遇紧急情况,请将你的黄旗置于旗架上。
●在实验过程中,如出错不提供额外的材料。
●建议你在开始之前通过阅读整个实验流程熟悉实验。
●当考试结束终止哨声响起时,应立即停止答题。将整个实验流程与答题纸一起放入信封中。实验监考人员将收取信封。
●当哨声停止时,如果你已将绿旗置于旗架上,但你的凝胶图尚未拍完,请站在你的位置旁边,直到实验监考人员来拍照。
祝你好运。
在下表中写出提示的数字。

?
材料:哨声响起后5 min 之内检查并报告有任何缺少的材料。
A.生物的
1.500 μL 细菌裂解物(标记为“Bacteria lysate BL”;在框中);
2.500 μL BSA 溶液,1 mg/mL(标记为“BSA”;在框中);
3.30 μL 质粒DNA,250 ng/μL(标记为“plasmid DNA”;在框中);
4.10 μL DNA酶(标记为“DNase,0.015 Units/μL”)置于冰上;
5.20 μL DNA 大小标记物(标记为“DNA size marker”;在框中)。
B.非生物的
1.垃圾桶(标记为“Waste bucket”);
2.1 mL 裂解缓冲液(标记为“Lysis buffer LB”;在框中);
3.2 mL 缓冲液A(分布在2 个管中,每个管标记为“Buffer A”;在框中);
4.1 mL 缓冲液B(标记为“Buffer B”;在框中);
5.3 mL 磷酸盐缓冲盐水(分布在2 个管中,每个标记为“PBS”;在框中);
6.8 μL DNase 反应缓冲液(标记为“DNase buffer”)置于冰上;
7.50 μL 凝胶上样染料(标记为“Loading dye”;在框中);
8.26×1.5 mL 管(在框中);
9.4.2 mL Bradford 试剂(在15 mL 管中)(标记为“Bradford reagent”);
10.亲和层析柱(标记为“Column”;置于柱架上);
11.微量移液器特殊吸头(标记为“MST”);
12.色谱柱架(标记为“Column holder rack”);
13.用于馏分收集的管架(标记为“Tube rack”);
14.2~20 μL 微量移液器;
15.20~200 μL 微量移液器;
16.100~1 000 μL 微量移液器;
17.用于2~20 μL 和20~200 μL 微量移液器的黄色吸头;
18.用于100~1 000 μL 微量移液器的蓝色吸头;
19.96 孔板(有学生名字);
20.铝箔;
21.有电源的琼脂糖凝胶电泳系统;
22.含有结合DNA 染色剂的琼脂糖凝胶(已置于电泳系统中);
23.一次性手套;
24.护目镜;
25.防水记号笔;
26.3 面旗帜,红色、绿色和黄色;
27.旗架(=小管)在你桌上左侧墙的位置;
28.你的名牌(置于架子上)。
建议你在开始实验前阅读下面的整个文本,熟悉实验。
介绍
在这个实验中,你将测试一种名为Pep 的蛋白质(在本实验条件下带正电荷)与DNA 相互作用的能力。你将获得待测DNA,但你必须从粗糙的细菌裂解液中纯化蛋白质Pep。在此之前已用质粒表达载体转化细菌,在质粒上含有组氨酸标记的Pep 编码基因。通过亲和层析进行蛋白质纯化。纯化柱中的树脂上结合有镍,组氨酸标签对镍具有亲和力并与镍结合相连。结合后,通过改变色谱方案中使用的缓冲液,可将蛋白质从树脂上分离。将洗脱的组分分别收集在几个管中。你将通过Bradford 方法确定2 个不同组分中的蛋白质浓度。这是比色测定法,其中考马斯亮蓝与蛋白质的附着导致其在595 nm 波长处的吸光度增加。通过使用测定已知浓度的牛血清白蛋白(BSA)溶液得到的标准曲线,可确定组分的蛋白质浓度。随后,将通过进行凝胶阻滞实验测试其中1 个组分中的Pep 蛋白与DNA 相互作用的能力。在该实验中,DNA 与蛋白质的相互作用会延迟电泳期间DNA 在琼脂糖凝胶上的迁移。
实验操作流程
A.通过亲和层析从细菌裂解物中纯化Pep 蛋白
1.记录已置于柱支架孔中的色谱柱。此外,还要注意其被紧紧地插入孔中。在实验过程中,避免将其从孔中移出。柱子的底部是密封的,柱子中的树脂用少量乙醇覆盖。仔细查看色谱柱的内容物,以正确检测树脂与上覆液体之间的边界。
2.打开色谱柱顶部的红色盖子,取掉色谱柱底部的微量移液器特殊吸头(MST),然后快速地将#1 管置于色谱柱下方的管架中,用以收集洗脱的乙醇。收集应持续进行,直至树脂上没有乙醇。将收集3~4 滴。
3.快速,但轻轻地向柱中加入500 μL 裂解缓冲液,在注入过程中不破坏柱内的树脂,使柱与裂解液LB 平衡。
4.将洗脱液滴收集在#2 管中,直至树脂上方没有缓冲液(收集约500 μL)。
5.快速,但轻轻地将500 μL 细菌裂解液添加到柱上,并开始在#3 管中收集液滴。确保所有细菌裂解液都已进入柱中(收集约500 μL)。
6.快速,但轻轻地将500 μL 洗涤缓冲液A 并开始在#4 管中收集液滴。随着树脂上方缓冲液的体积减少至约100~200 μL,另外添加300 μL 缓冲液A 并继续在同一#4 管中收集液滴。继续加入3 次300 μL(即柱子应用总体积为1.7 mL 的缓冲液A 洗涤)。收集可在#5 管中继续(在#4 管和#5 管中总共将收集约1.7 mL)。
7.快速,但轻轻地加入500 μL 缓冲液B 以开始分离与柱中树脂结合的Pep 分子。开始在#6、#7 和#8 管中收集液滴。每个管中应收集3 滴。随着树脂上方缓冲液的体积减少至约200 μL,另外添加200 μL 的缓冲液B 并继续收集洗脱液,直至在#8 管中收集3 滴。
8.快速用微量移液器特殊吸头(MST)密封色谱柱的底端。这是通过将色谱柱底部插入特殊吸头的宽口实现快速密封的。
B.BRADFORD 蛋白质分析(这项任务分为2个部分)
第1 部分
1.如表1所示准备牛血清蛋白BSA(=标准蛋白)稀释液:
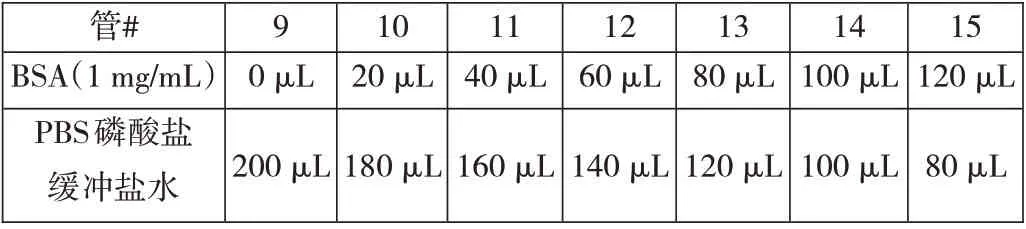
表1
2.如表2所示,在#16 管和#17 管中准备#7 管和#8 管的稀释液。
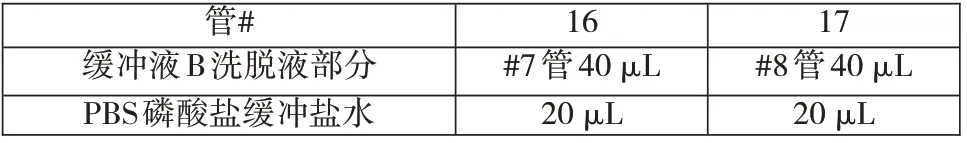
表2
3.将#9 管~#17 管每个管内的物质进行混合。
4.每个样品将一式2 份进行测定,分别在96孔板的B 行和D 行。为此,从#9~#15 管中各取出10 μL 分别加入孔B1 ~B7 中,然后再各取10 μL加入D1~D7 孔中。随后,从#16 管中各取10 μL 分别加入孔B8 和D9 中,从#17 管中各取10 μL 分别加入孔B11 和D11 中。在已加入样品的每个孔中分别加入190 μLBradford 试剂。用微量移液器尖轻轻混合,注意不要产生气泡,气泡会干扰吸光度测量。
5.在96 孔板上盖上盖子,且用铝箔包裹板,以防止暴露在光线下。在黑暗中培养应持续5 min(你可在5 min 培养期间开始此任务的第2 部分)。
6.完成5 min 培养后,将红旗置于旗架上。实验监考人员会将你的有编码的板拿到分光光度计站,在595 nm 波长下读取所有孔的吸光度。吸光度读数将用于评判你的表现。(45 分)
第2 部分
注意:Bradford 测定第2 部分中的所有数据均与考生之前进行的实验有关。
1.第1 部分中描述的Bradford 测定已由考生完成,吸光度读数用于绘制下面提供的标准曲线。
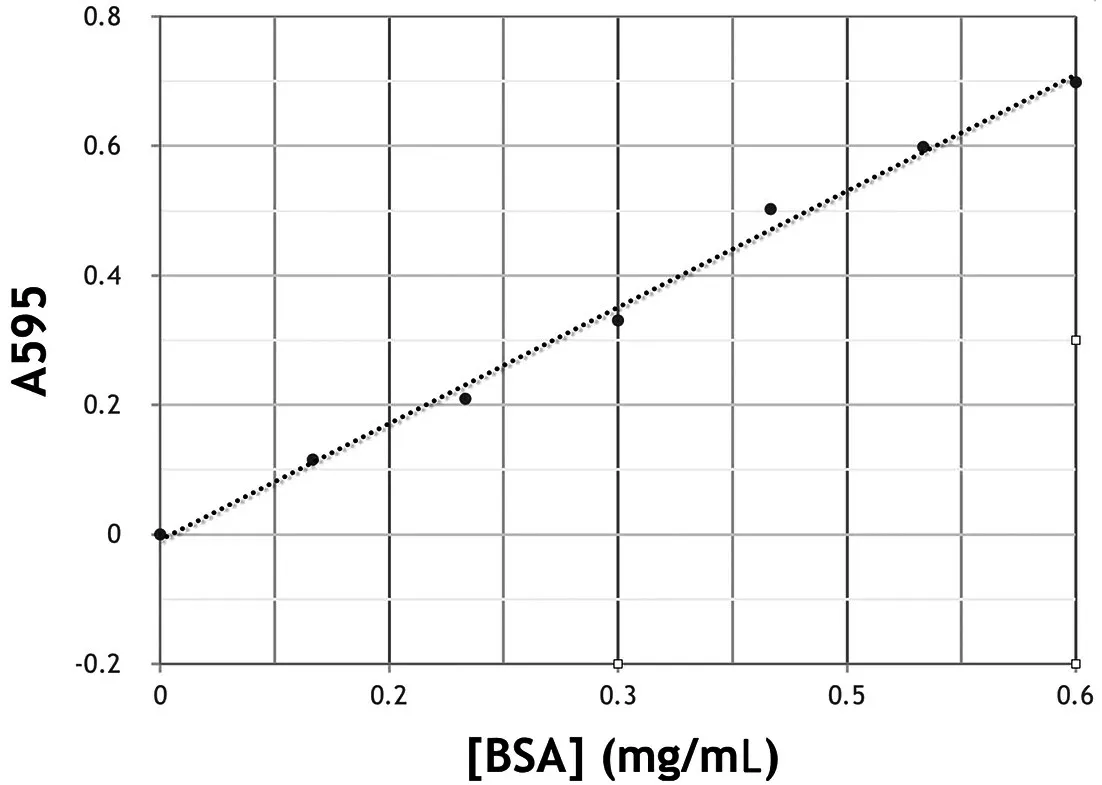
2.使用标准曲线和考生获得的#16 管和#17 管的A595(595 nm 处的吸光度),如下所示,计算考生的#7 管和#8 管中的组分的蛋白质浓度。在答题纸上写下#7 管和#8 管的蛋白质浓度(保留小数点后2 位数)。(5 分)

管16:管17:孔B9:0.32孔B11:0.41孔D9:0.34孔D11:0.43
C.凝胶阻滞分析
此测定将使用#8 管的内容物进行(=在加入缓冲液B 后收集液滴的第3 个管)。
1.按照下述步骤稀释#8 管:在#18 管中加入10 μL #8 管的物质和40 μL PBS,并且混合。
2.#19~#25 管应按下表3所述制备。按所述顺序添加(从上到下)。
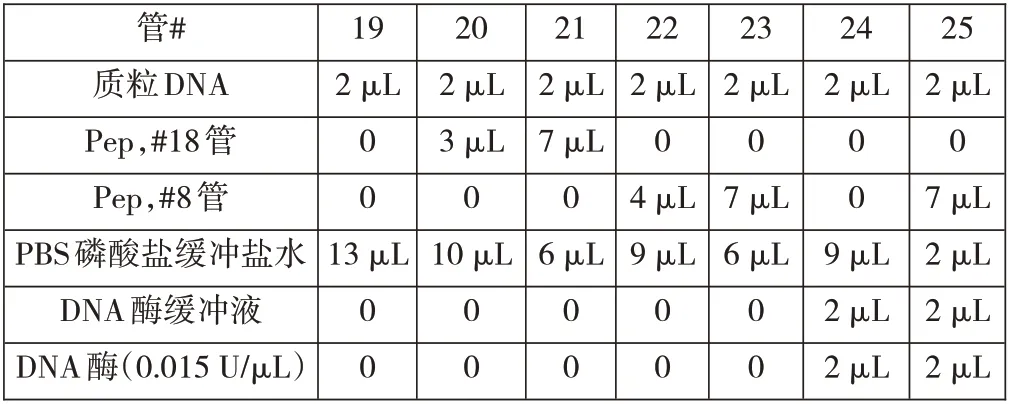
表3
3.将DNase 加入#24 管 和#25 管,3 min 后 向#19~#25 管中各加入3 μL 凝胶上样染料并混合。
4.此时凝胶电泳仪器将被关闭。小心不要按设备上的电源按钮或任何其他按钮。将#19~#25管各取15 μL 连续加入到电泳装置中琼脂糖凝胶的7 个相邻孔(当正极朝向你时从左到右)中。在第8 个孔中加入15 μL 已含有凝胶上样染料的DNA 大小标记物。注意:凝胶用电泳缓冲液覆盖,因此,将15 μL 等分试样非常温和地加到每个孔的底部,以防止在上样时溢出。
注意:凝胶的1 个孔留空。
5.上样完成后,将橙色照片罩插入设备。按下设备右下表面的电源按钮开始电泳。记录电泳开始的时间。右上方的2 个按钮用于高水平或低水平蓝色照明。按下按钮进行高水平照明。这将使你能在电泳过程中实时显示凝胶中DNA的迁移,因为DNA 结合染色剂已在凝胶中。DNA迁移可通过照片罩顶部的孔观察。观察过程中不应移除照片罩。
6.开始电泳15 min 后,按电源按钮断开电源。将你的绿旗置于旗架上,提醒监考人员注意。他/她将通过照片罩的孔拍摄凝胶照片(35 分)。你可在15 min 的时间间隔内进行下面的理论问题。
问题(总共15 分):
在答题纸中用“×”表示以下每个陈述的正确或错误。
1.蛋白质测定的线性范围越大,需要对测定中使用的目标样品浓度的关注越少(1 分)。
2.Pep 对质粒DNA 上DNase 活性的影响可能是依赖于这段DNA 的序列的(1 分)。
3.在孔上方的凝胶区域中对染色的DNA 的观察将反映DNA 与高浓度Pep 相互作用的结果(1分)。
4.假设下面所示的示意图代表管#19 的内容物的电泳图。靠近上面的那条带可能是环状质粒DNA,其中1 条链中的1 个磷酸二酯键已断开(1 分)。

5.学生A 试图纯化一个质粒,学生B 试图纯化另一个质粒。2 种质粒都没有重复序列。在质粒电泳后,2 位学生观察到如下所示2 个条带。基于已知的质粒大小,上部条带是出乎意料的。每个限制性酶消化质粒制备物都是按照完全消化进行的,随后对消化产物进行电泳。结果如下所示。质粒图谱显示每个质粒仅含有1 个所用酶的识别位点。
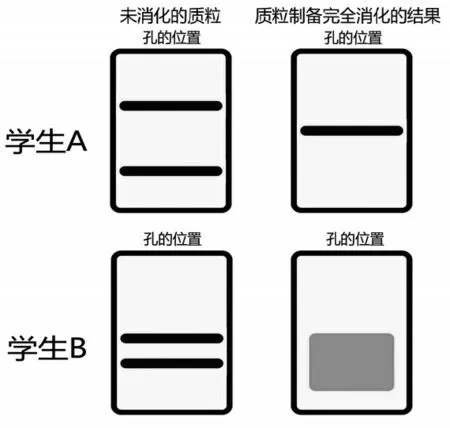
在答题纸中指出以下每个陈述是正确的还是错误的(4 分)。
a.学生A 的意外条带可能是线性化的质粒DNA
b.学生B 的意外条带可能是环状二聚体质粒DNA
c.用同样的限制酶部分消化学生A 的质粒制备物,跑出的电泳模式将预期产生至多3 个条带
d.用同样的限制酶部分消化学生B 的质粒制备物,跑出的电泳模式将预期产生3 个条带
6.为了确定一段目标线性DNA 分子的2 种稀有限制酶(RE1 和RE2)的限制酶图谱,进行以下实验。首先,标记DNA 分子的样品5’末端,分别用RE1 和RE2 切割。被标记的片段产物的长度如下图中星号所示。其他未被标记的DNA 样品也分别用RE1 和RE2 切割。将RE1 消化产物上样到非常宽的凝胶孔中并电泳。电泳后,通过Southern印迹将凝胶上的DNA 条带转移至硝酸纤维素滤纸上。将RE2 消化产物上样到另一个凝胶的非常宽的孔中并进行电泳,然后通过Southern 印迹将该凝胶上的DNA 条带转移至同样的含有RE1消化产物的硝酸纤维素滤纸上,但此转移相对于RE1 限制性片段的转移是垂直方向的。圆圈显示RE1 降解片段和RE2 降解片段之间杂交的位置。
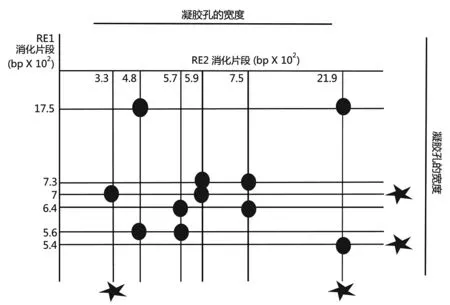
指出以下每个陈述的正确或错误(7 分)。
a.用RE1 和RE2 完全消化DNA 分子将产生11 个片段
b.通过用RE1消化产生的6.4×102bp和7.3×102bp DNA 片段在未消化的DNA 分子中相邻
c.分别通过RE1 和RE2 消化产生的5.6×102bp和4.8×102bp 片段在未消化的DNA 分子中是重叠的
d.分别通过RE1和RE2消化产生的17.5×102bp和21.9×102bp 片段在未消化的DNA 分子中重叠
e.2 种限制酶中,其中一种限制酶的任何消化产物都不会与另一种酶的3 种消化产物重叠
(待续)

