西洛他唑对海马神经干细胞糖氧剥夺性损伤的影响及其作用机制
李燕宏,丁 鑫,杜 坚,张红梅
脑梗死又称缺血性脑卒中,是由各种原因引起的局部脑组织缺血缺氧性坏死,进而产生临床上对应的神经功能缺失表现。由于大多数脑梗死是血栓堵塞脑动脉所致,血小板聚集又是血栓形成的关键步骤,因而抗血小板聚集治疗一直是治疗和预防这类疾病的重要手段[1]。为此,脑梗死病人需要长期服用阿司匹林等抗血小板药聚集物来预防疾病的发生。而在脑梗死治疗过程中,病人脑组织结构与功能的修复主要依赖于病灶区的神经元再生和血管重建过程[2-4]。神经干细胞(neural stem cells,NSCs)被认为在中枢神经系统再生与修复中起着重要作用[3]。那么,这些抗血小板聚集药物是否能调控NSCs 目前少有报道。磷酸二酯酶3 型抑制剂西洛他唑(cilostazol)作为一种抗血小板药物,常用于缺血性脑卒中的治疗[5]。近年来,有研究显示,除了抗血小板聚集的作用以外,西洛他唑在减少血管意外事件方面要优于阿司匹林[6];单独应用西洛他唑也能减轻动物模型的脑梗死区范围[7]。但是,西洛他唑是否通过调节NSCs 而介导对脑梗死的保护性作用目前并不清楚。为此,本研究通过小鼠海马NSCs 糖氧剥夺性损伤模型,探讨西洛他唑对小鼠海马NSCs 的保护性作用及机制。
1 材料与方法
1.1 材料
1.1.1 动物 SPF 级C57BL/6 小鼠(8 周龄)由成都医学院实验动物中心提供。雌鼠、雄鼠按照2∶1 比例合笼喂养,雌鼠交配受孕后自然分娩。取其1 d 龄新生C57BL/6 小鼠,用于海马NSCs 的分离培养。
1.1.2 主要药品及试剂 西洛他唑购自Sigma-Aldrich 公司;抗Nestin(批号:ab105389)、Alexa Fluor 488 荧光标记二抗IgG(批号:ab150077)、抗Bax(批号:ab32503)、抗Bcl-2(批号:ab196495)、抗C/EBP 同源蛋白(CHOP,批号:ab179823)购自Abcam 公司;抗甘油醛-3-磷酸脱氢酶(GAPDH)抗体购自Santa Cruz公司(批号:sc-25778);抗活化转录因子4(activating transcription factor 4,ATF-4)抗体购自Cell Signaling技术公司(批号:11815);ATF-4 siRNA 由锐博生物公司合成,转染试剂Lipofectamine2000 购自Invitrogen公司;CCK-8 检测试剂盒购自碧云天生物技术有限公司(批号:C0042)。
1.2 海马NSCs 的分离培养及鉴定 海马NSCs 的分离培养参照文献[8]提供的方法。取新生C57BL/6幼鼠(1 d 龄),经5%乙醇浸泡消毒,在超净工作台内断头取脑,小心分离海马组织,剪碎后加入0.25%胰酶于37 ℃消化15 min,采用DMEM 培养基终止消化,低速离心(1 500 r/min)后吸去上清液,沉淀细胞经DMEM 培养基重悬,200 目细胞滤网过滤,再次离心并弃上清,用DMEM培养基重悬细胞,调整细胞浓度以1×109个/ L 密度接种于培养瓶中,置于37 ℃恒温培养箱中培养。每3 d 更换培养液1 次,每6~7 d 传代培养。给药前,取第3 代NSCs 接种于六孔板中培养,接种密度1.0×106个/孔。待细胞融合度达到80%时,即用于药物处理。
为了鉴定NSCs,部分NSCs 接种于六孔板中,贴壁培养4 h 后吸去培养基,加4%多聚甲醛固定,0.3%Triton-100 通透细胞膜,山羊血清封闭,加稀释比1∶100的抗Nestin 抗体于4 ℃下孵育过夜,经磷酸缓冲盐溶液(PBS)漂洗后,再加Alexa Fluor 488 荧光标记二抗IgG 孵育2 h,加4",6-二脒基-2-苯基吲哚(DAPI)染核,封片,荧光显微镜下观察拍照。
1.3 糖氧剥夺性损伤模型制作及分组药物处理 糖氧剥夺性损伤模型制作的简要过程:待细胞融合度达到80%时,将培养基更换为无糖DMEM 培养基,并将NSCs 置于通1%O2、5%CO2乏氧混合气体的37 ℃恒温培养箱中培养3 h。
分组处理时,将细胞随机分为对照组、模型组、西洛他唑组、siRNA 空白对照组、ATF-4 siRNA 组。对照组NSCs 事先不做糖氧剥夺性损伤处理,直接采用正常糖含量的培养基培养,在正常氧含量混合气体的37℃培养箱中培养24 h。其他各组NSCs 预先进行糖氧剥夺处理3 h,随后其培养液更换为正常糖含量的DMEM 培养基,置于正常氧含量混合气体的37 ℃恒温培养箱中培养24 h。为了观察干扰ATF-4 对NSCs的影响,ATF-4 siRNA 组在接受糖氧剥夺损伤处理之前1 h,培养液即更换为含100 nmol/L ATF-4 siRNA 的DMEM 培养基。而siRNA 空白对照组NSCs 则在糖氧剥夺处理之前1 h开始接受100 nmol/L转染溶剂lipofectamine 2000 处理。NSCs 转染ATF-4 siRNA或溶剂lipofectamine 2000 的过程将持续至糖氧剥夺后24 h。西洛他唑组在糖氧剥夺处理后,其培养液更换为含10μmol/L 西洛他唑的DMEM 培养基,继续培养24 h。西洛他唑剂量参考文献[9]。药物处理完毕,即收集细胞样本进行检测分析。
另外,在检测西洛他唑对NSCs 增殖活力影响的剂量效应关系实验中,西洛他唑组再分为3 个亚组:低剂量西洛他唑组(1 μmol/L)、中剂量西洛他唑组(3μmol/L)、高剂量西洛他唑组(10μmol/L)。
1.4 NSCs 增殖活力检测 采用CCK-8 法。NSCs 以5.0×103个/孔密度接种于96 孔板,每组6 个复孔。糖氧剥夺和药物处理过程同上所述。药物处理过程完成后,各组培养板中每孔置换为新鲜100 μL 培养液,再加入10 μL 的CCK-8 溶液,37 ℃下继续培养2 h。采用SynergyH1 多功能酶标仪(美国BioTek 公司)检测各孔450 nm 处吸光值,以此作为细胞活力指证。
1.5 NSCs 中ATF-4、CHOP、Bax、Bcl-2 表达量检测 采用免疫印迹(Western Blotting)法。药物处理过程完成后,各组细胞经冷PBS 漂洗2 次,加RIPA 裂解液(碧云天生物技术有限公司)裂解细胞样本。随后,裂解混合液经4 ℃离心(12 000 r/min)10 min。所收集的蛋白浓度采用BCA 法定量。然后,每泳道加入50 μg 蛋白,经10%十二烷基硫酸钠-聚丙烯酰胺凝胶电泳(SDS-PAGE)分离,并电转至聚偏二氟乙烯(PVDF)膜。PVDF 膜加5%脱脂牛奶液在室温下封闭2 h;随后加一抗(抗ATF-4、抗CHOP、抗Bax、抗Bcl-2、抗GAPDH)4 ℃孵育过夜,漂洗3 次;再加辣根过氧化物酶(HRP)连接的二抗羊抗兔IgG 孵育1 h,再洗脱;加增强型化学发光试剂,以显示待测蛋白条带。蛋白条带图像扫描至电脑存储,利用ImageJ 1.43u 软件分析各条带的灰度值。其中,Bax/Bcl-2 蛋白表达量比值(即凋亡指数)用于衡量细胞凋亡程度,比值越高表示凋亡越强。
1.6 统计学处理 采用Graphpad prism 8.0 软件进行统计学分析。计量资料以均数±标准差(±s)表示,多组间采用单因素方差分析,两组间比较采用t检验。以P<0.05 为差异有统计学意义。
2 结 果
2.1 西洛他唑对糖氧剥夺下海马NSCs 增殖与凋亡的影响 免疫荧光检测结果显示,镜下可见大多数细胞染色呈Nestin 阳性的亮绿色,被染色细胞即为NSCs。详见图1。

图1 海马NSCs 的免疫荧光技术鉴定
CCK-8 法检测海马NSCs 增殖活力:与对照组比较,模型组海马NSCs 增殖活力明显下降(P<0.01);与模型组、低剂量西洛他唑组比较,中剂量西洛他唑组、高剂量西洛他唑组海马NSCs 的增殖活力明显提高(P<0.01)。根据NSCs 增殖活力实验研究结果,本研究后续实验中只选取高剂量(10 μmol/L)西洛他唑作为药物治疗组。Western Blot 检测Bax/Bcl-2 表达:与对照组比较,模型组Bax/Bcl-2 明显增加(P<0.01);与模型组比较,中剂量西洛他唑组、高剂量西洛他唑组Bax/Bcl-2 明显降低(P<0.01)。详见表1。
表1 各组海马NSCs 增殖活力和Bax/Bcl-2 比较(±s)
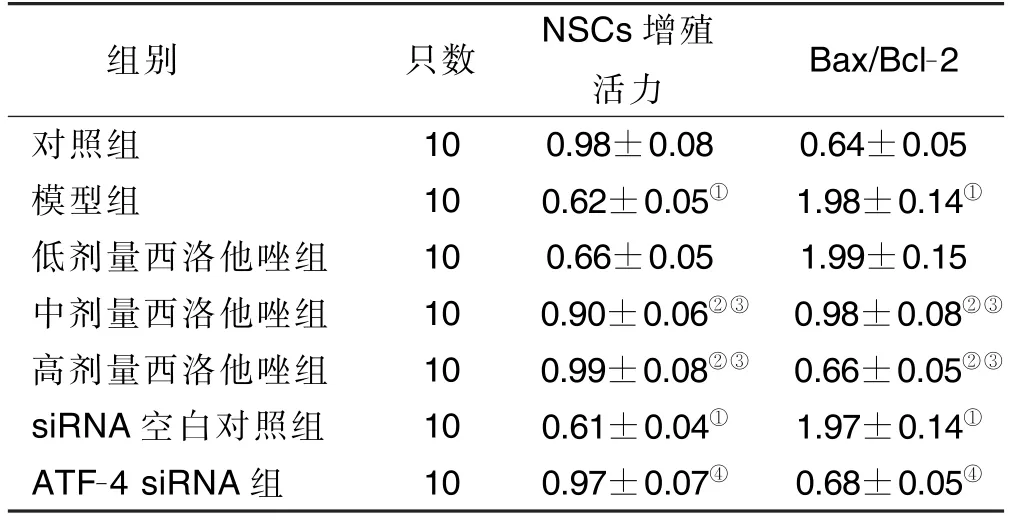
表1 各组海马NSCs 增殖活力和Bax/Bcl-2 比较(±s)
与对照组相比,①P <0.01;与模型组相比,②P <0.01;与低剂量西洛他唑组相比,③P <0.01;与siRNA 空白对照组相比,④P <0.01。
组别 只数 NSCs 增殖活力 Bax/Bcl-2对照组 10 0.98±0.08 0.64±0.05模型组 10 0.62±0.05① 1.98±0.14①低剂量西洛他唑组 10 0.66±0.05 1.99±0.15中剂量西洛他唑组 10 0.90±0.06②③ 0.98±0.08②③高剂量西洛他唑组 10 0.99±0.08②③ 0.66±0.05②③siRNA 空白对照组 10 0.61±0.04① 1.97±0.14①ATF-4 siRNA 组 10 0.97±0.07④ 0.68±0.05④
2.2 西洛他唑对糖氧剥夺下海马NSCs 中ATF-4、CHOP 信号通路表达的影响 与对照组比较,模型组海马NSCs 中ATF-4、CHOP 表达量明显增加(P<0.01);与模型组比较,高剂量西洛他唑组ATF-4、CHOP 表达明显降低(P<0.01)。详见表2。
表2 各组ATF-4/CHOP 信号通路表达比较(±s)
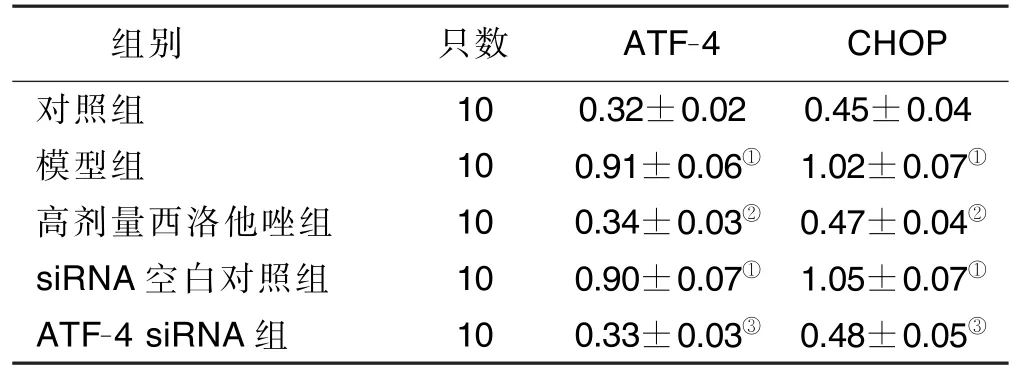
表2 各组ATF-4/CHOP 信号通路表达比较(±s)
与对照组相比,①P <0.01;与模型组相比,②P <0.01;与siRNA 空白对照组相比,③P <0.01。
组别 只数 ATF-4 CHOP对照组 10 0.32±0.02 0.45±0.04模型组 10 0.91±0.06① 1.02±0.07①高剂量西洛他唑组 10 0.34±0.03② 0.47±0.04②siRNA 空白对照组 10 0.90±0.07① 1.05±0.07①ATF-4 siRNA 组 10 0.33±0.03③ 0.48±0.05③
2.3 干扰ATF-4 对糖氧剥夺下海马NSCs 增殖与凋亡的影响 ATF-4 siRNA 在抑制ATF-4、CHOP 信号通路表达的同时,也明显升高NSCs 增殖活力(P<0.01)和降低Bax/Bcl-2(P<0.01)。详见表1、表2。
3 讨 论
人口老龄化已经成为当今全球最为关注的问题之一。随着老龄化程度的日益加重,各种中枢神经系统疾病(如脑梗死、阿尔茨海默病、帕金森病等)的发病率正急剧攀升[10]。NSCs 移植被认为是治疗这些疾病的重要手段,主要是因为NSCs 可以分化为神经元和神经胶质细胞,在中枢神经系统再生与修复中起着重要作用[11]。内源性NSCs 主要定位于海马齿状回、室管膜下区[12]。脑梗死时引起的局部脑组织血流突然终止,可通过糖氧剥夺的方式损伤脑内NSCs,使NSCs失去参与神经系统再生修复的能力[13]。因此,在脑梗死治疗实践中,务必关注各种治疗药物对脑内NSCs功能的影响,注重保护和改善脑内NSCs 的功能。为此,本研究观察常用抗血小板药西洛他唑对海马NSCs 糖氧剥夺性损伤的保护性作用。本研究结果显示,西洛他唑能通过改善海马NSCs 的增殖活力和抑制其细胞凋亡过程,从而抑制NSCs 的糖氧剥夺性损伤。因此,西洛他唑可能对维持脑梗死后NSCs 的神经再生能力具有一定保护作用。
为了进一步探讨西洛他唑保护海马NSCs 的细胞学机制,本研究探讨了ATF-4、CHOP 信号通路与海马NSCs 糖氧剥夺性损伤之间的关系,研究结果显示,糖氧剥夺性损伤可激活海马NSCs 中的ATF-4、CHOP信号通路;西洛他唑则下调ATF-4、CHOP 信号通路;采用ATF-4 siRNA 干扰抑制ATF-4、CHOP 信号通路,则明显提升NSCs 增殖活力和降低其细胞凋亡水平。事实上,ATF-4、CHOP 信号通路在心肌细胞[14]、胰腺β细胞[15]、神经元[16]等细胞的凋亡过程中都起着重要作用。尽管有实验证实CHOP 在骨髓间充质干细胞的凋亡中起着重要作用[17],但是ATF-4、CHOP 信号通路在NSCs 凋亡中的作用并不清楚。本研究结果则明确提示,ATF-4、CHOP 信号通路在糖氧剥夺诱导的海马NSCs 凋亡中起着重要作用,采用ATF-4 siRNA 干扰技术抑制ATF-4、CHOP 信号通路则明显抑制NSCs糖氧剥夺性凋亡。同时,本研究结果也证实西洛他唑对NSCs 糖氧剥夺性损伤的保护作用与其抑制ATF-4、CHOP 信号通路有关。
综上所述,本研究结果显示,糖氧剥夺通过上调ATF-4、CHOP 信号通路而促进海马NSCs 凋亡,从而影响其参与脑梗死时神经再生的能力。西洛他唑则通过抑制ATF-4/CHOP 信号通路,从而抑制NSCs 凋亡和改善海马NSCs 糖氧剥夺性损伤。另外,以往研究提示,脑缺血可导致脑组织ATF-4、CHOP 表达上调[18-21]。本研究结果提示,ATF-4、CHOP 信号通路可能是防治脑梗死等中枢神经系统疾病的重要靶点。

