幽门螺杆菌相关萎缩性胃炎的区域耐药性分析
贺新国,郭保根
成都市双流区中医医院消化内科,四川 成都 610020
慢性胃炎主要由幽门螺杆菌(H.pylori,Hp)感染所引起,感染Hp后少有自发清除,因此慢性胃炎长期持续存在,部分发展为慢性多灶性萎缩性胃炎,胃癌的发生危险明显高于普通人群[1]。不同地区,不同人群抗生素耐药差异较大,盲目滥用抗生素更易增加细菌耐药[2]。研究发现,标准的质子泵抑制剂(PPI)三联疗法对Hp 感染的根除率在少数地区已呈明显下降趋势,部分欧洲国家的Hp感染根除率已低于80%[3]。通过药敏试验选择敏感抗生素是提高Hp根除率的有效方法,但标准的细菌培养+药敏实验由于培养条件的限制,不宜在临床展开。本研究通过使用灵敏度高、特异性好的RT-PCR 方法和基因芯片检测法,针对萎缩性胃炎患者,检测胃镜活检标本中Hp 及其对常用抗菌药物的耐药性,了解与萎缩性胃炎相关性强的Hp耐药水平及耐药基因突变情况,旨在为本地区的Hp的根除治疗治疗提供参考依据。
1 资料与方法
1.1 一般资料 选取2019 年6 月至2020 年6月在成都市双流区中医医院消化内科经胃镜检查确诊的Hp相关萎缩性胃炎患者210例,其中男性115例,女性95 例,分离得到菌株200 株。纳入标准:初次到医院就诊并行胃镜检查者;之前未曾接受Hp 感染根除治疗;年龄18~80 岁;诊断符合慢性萎缩性胃炎(中国慢性胃炎共识意见2012年)。排除标准:近2周内服用过抗生素、激素、抑酸药、铋剂;严重的心肝肺、肾脏疾病者;有胃部手术史者。本研究经医院伦理审查委员会同意,所有患者均签署知情同意书。
1.2 方法
1.2.1 Hp鉴定 胃镜检查时,同时取2部位组织进行检测(胃窦和胃体各2块),立即置于10%中性甲醛溶液中固定,送病理科检测。①HE染色观察:胃镜活检组织经10%中性甲醛溶液固定、石蜡包埋后进行常规切片、HE 染色,镜下观察,排除急性、慢性炎症及溃疡性病变。②改良Giemsa Hp染色观察:采用Hp染色试剂盒(Giemsa法,北京益利精细公司),操作步骤按说明书进行,鉴定Hp。
1.2.2 Hp 药敏试验 采用纸片扩散法进行药敏试验,调整菌悬液浓度至6×107CFU/mL,均匀涂抹于酪蛋白绵羊血平皿(成都精博瑞生物科技有限公司),贴上药敏试纸后置于微需氧袋,37℃温度下培养3 d,测量抑菌圈直径,参照中国食品药品检定研究院制定的抗菌药物药敏试验判定标准判断Hp对常规抗生素的耐药情况。
1.2.3 RT-PCR方法检测Hp及其耐药性 ①组织DNA 提取:胃组织蜡块切10 um 厚蜡卷,按照QIAamp DNA mini kit(Qiagen,Germany),试剂盒操作步骤提取组织DNA。②RT-PCR 扩增及耐药性检测:采用RT-PCR方法,扩增Hp 23s rRNA和gyrA基因,鉴定Hp。③Hp 克拉霉素及左氧氟沙星耐药性检测:采用 RT-PCR,检 测 Hp23s rRNA 基 因 V 区 A2142G、A2143G、T2182C 突变和 gyrA 基因 N87K (C261A)、D91N(G271A)突变;人RNP基因作为内对照。
1.2.4 可视化基因芯片检测Hp 对克拉霉素和左氧氟沙星的耐药表型和基因型 提取胃黏膜DNA,制备基因芯片(深圳普瑞康研制开发的幽门螺杆菌感染个体化治疗检测试剂盒(基因芯片法)),检测本地区幽门螺杆菌对克拉霉素和左氧氟沙星的耐药表型和基因型。对于针对克拉霉素耐药位点设计的4 条探针(6号、7号、8号和9号),当某一条探针的平均灰度值为另三条的两倍及以上时,或者只有一条探针有信号时,则判断此条探针为阳性。针对喹诺酮耐药位点第87位氨基酸设计的四条探针(10号、11号、12号和13号),判读标准同于克拉霉素耐药位点的探针的判读。针对喹诺酮耐药位点第91 位氨基酸设计的三条探针(14 号、15 号和16号),判读标准也同于克拉霉素耐药位点的探针的判读。
1.3 统计学方法 应用SPSS22.0 统计学软件分析数据,计数资料组间比较采用χ2检验,以P<0.05表示差异具有统计学意义。
2 结果
2.1 Hp 的耐药清单 对分离的200 株菌株进行7 中常用抗生素的药敏试验,其中甲硝唑耐药140 株(70%),左氧氟沙星耐药 77 株(38.5%),克拉霉素耐药31株(15.5%),阿莫西林耐药20株(10%),呋喃唑酮、庆大霉素和四环素耐药各2株(1%)。
2.2 HpgyrA基因N87K(C261A)、D91N(G271A)突变情况 通过对耐左氧氟沙星菌株38 株和敏感菌株10 株进行gyrA 基因序列分析,N87K(C261A)突变耐药菌株有15 株,敏感组0 株,差异具有统计学意义(P<0.05);D91N (G271A)突变耐药菌株有13 株,敏感组0株,差异具有统计学意义(P<0.05),见表1。
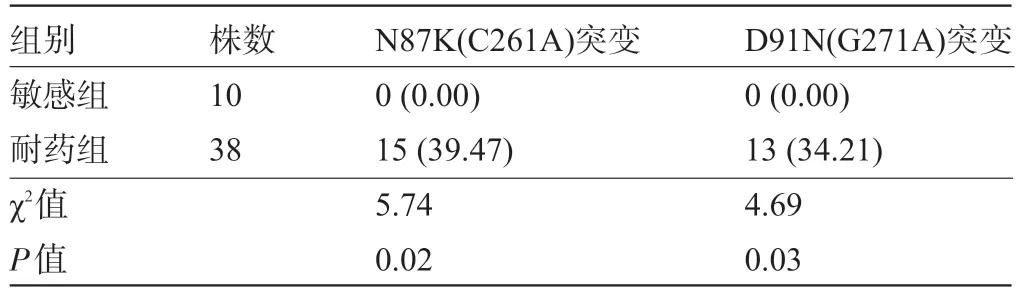
表1 HPgyrA基因N87K(C261A)、D91N(G271A)突变情况[株(%)]
2.3 Hp23s rRNA 基因 V 区 A2142G 、A2143G、T2182C 突变情况 通过对耐克拉霉素菌株31 株和敏感菌株10株进行23s rRNA基因序列分析,A2142G突变耐药菌株17 株,敏感菌株2 株,差异具有统计学意义(P<0.05);A2143G 突变耐药菌株 13 株,敏感菌株 1株,差异具有统计学意义(P<00.05);T2182C 突变耐药菌株15 株,敏感菌株4 株,差异无统计学意义(P>00.05),见表2。
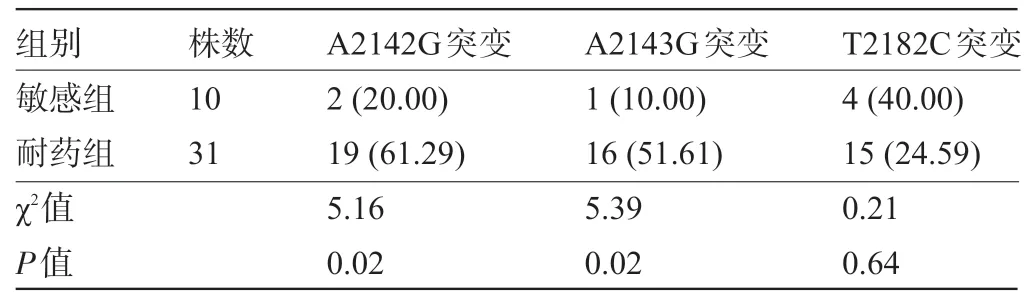
表2 Hp23s rRNA基因V区A2142G、A2143G、T2182C突变情况[株(%)]
3 讨论
Hp 感染后,部分患者由慢性非萎缩性胃炎发展为慢性萎缩性胃炎,其中部分可演变发展为胃癌[4]。萎缩是从非萎缩性胃炎向癌演变过程中重要的病变阶段。根除Hp 可消除炎症反应,使萎缩发展减慢或停止。然而,随着抗菌药物广泛及长时间使用,Hp 耐药率增高,增加根除Hp 的治疗难度[5]。其次,受药物影响及检测Hp方法的局限性,出现Hp检验假阴性,贻误抗Hp治疗时机,导致胃黏膜慢性炎症持续,腺体萎缩。更为重要的是,不同国家或同一国家不同地区Hp对抗菌药物的耐药性差异较大,Hp相关性胃黏膜的萎缩发生率也存在很大差异,目前本地区尚无Hp耐药率及相关性胃黏膜的萎缩发生率研究指导临床用药。
喹诺酮类药物通过抑制细菌复制过中的DNA 回旋酶和拓扑异构酶Ⅳ的活性发挥抑菌作用[6]。而DNA回旋酶中的A、B两个亚单位结构分别由gyrA和gyrB 基因编码,因此当gyrA 基因发生突变时即可影响细菌的耐药性。gyrA 基因突变的常见方式主要是编码 N87K(C261A)、D91N(G271A)的突变[7]。本次研究结果显示,N87K(C261A)、D91N(G271A)突变的耐药菌株和敏感菌株比较差异具有统计学意义。说明本地区Hp 对左氧氟沙星的耐药性主要源于C261A、G271A 的基因突变。有研究认为,N87K、D91N的改变是Hp 耐左氧氟沙星的主要原因,与本研究结果相符合[8]。克拉霉素能够与Hp23s rRNA基因V区中的核糖体亚基进行结合,通过抑制肽酰基转移酶的功能而阻止细菌蛋白质的合成,发挥抑菌作用[9]。当23s rRNA基因的某个点位发生突变时,核糖体结构随之改变,影响克拉霉素与其的有效结合,进而未能阻止蛋白质合成产生耐药性[10]。本研究结果显示,A2142G、A2143G突变耐药菌株和敏感菌株比较差异具有统计学意义;T2182C突变耐药菌株和敏感菌株比较差异无统计学意义。说明本地区Hp对克拉霉素的耐药性主要源于A2142G、A2143G 的基因突变。相关文献指出,A2143G 突变在克拉霉素耐药性的产生过程中期主导作用[11],但在根除Hp的治疗中却可以和阿莫西林产生协同效应,增强治疗效果,而A2142G突变则无次效果。因此,在本地区Hp 相关萎缩性胃炎的根除治疗中可通过联合用药的方式提高Hp根除率。
综上所述,Hp耐克拉霉素的主要原因是A2142G、A2143G 基因的突变,耐左氧氟沙星的主要原因是编码N87K、D91N 的基因C261A、G271A 发生突变,因此,在胃镜检查发现上述基因突变时,应避免使用克拉霉素和左氧氟沙星,更换或联合应用其他敏感抗生素。

