小麦TaHPPR基因的克隆与表达分析
郝小聪,王伟伟,张风廷,孙 瑞,房兆峰,柳 珊,曹志琛,朱文根,赵昌平,汪德州,唐益苗
(北京市农林科学院杂交小麦工程技术研究中心,北京100097)
0 引言
羟基苯丙酮酸还原酶(Hydroxyphenylpyruvate Reductase-HPPR)属于D-异构体特异性2-羟基酸脱氢酶家族[1]。该家族中的酶以NADH或NADPH作为辅酶催化2-酮酸可逆地还原成D-2-羟基酸,糖酵解和柠檬酸循环是产生NADH的主要来源,NADH分子是线粒体中能量生产的控制指标[2]。研究发现HPPR对4-羟苯基丙酮酸(pHPP)具有最高的亲和力,其中pHPP是植物光合作用的重要组成[3-4],HPPR催化pHPP还原为4-羟苯基乳酸(pHPL),是酪氨酸生物合成迷迭香酸Rosmarinic acid(RA)的关键酶[5-6]。
HPPR基因广泛存在于植物中,拟南芥HPPR家族包含 4个HPPR基因 ,HPR1,HPPR2(AT1G79870),HPPR3(AT1G12550)和HPPR4(AT2G45630),其 中HPPR2和HPPR3编码功能性羟基苯丙酮酸还原酶[7]。拟南芥中的HPR1是一种过氧化物酶体酶,参与了光呼吸循环,HPPR2、HPPR3和HPPR4负责将酪氨酸转化为酚类化合物,并在胞质溶胶中为光呼吸循环提供支路,其中HPPR4催化活性较低可能参与其他生物学过程[8-9]。为进一步分析HPPR基因的时空表达模式,构建拟南芥过表达相应启动子-GUS载体的转基因植株,在幼苗中,HPPR2在植株中非特异性表达,HPPR3主要在根中表达,HPPR4主要在毛状根和叶脉中毛状体表达;在花序中,HPPR2再次广泛表达,HPPR3和HPPR4在幼花的雄蕊中观察到表达。其中HPPR4是花药壁特异性基因,在花药中特异性表达的,在特定阶段阻断了花药的发育途径,从而导致花药发育异常[10]。丹参羟基苯丙酮酸还原酶(HPPR)基因SmHPPR在RA的生物合成中起重要作用。SmHPPR在茎和根中高度表达但在叶中弱表达,SmHPPR定位于细胞质中,SmHPPR含有特定的催化结构域与NAD(P)H结合,可能是光呼吸活性的细胞溶质NADPH依赖性羟基丙酮酸还原酶[11]。夏枯草羟基苯丙酮酸还原酶基因(PvHPPR)属于2-羟基酸脱氢酶家族,PvHPPR基因在根中的相对表达量最高,受水杨酸和乙烯的调节,PvHPPR定位在内质网中,过表达PvHPPR基因发现PvHPPR蛋白参与夏枯草中迷迭香酸的生物合成,并获得较高RA含量的毛状根株系[12]。在紫苏中扩增HPPR基因的启动子序列,结果分析发现其启动子序列包含多种顺式作用元件,包括激素响应相关元件、逆境胁迫响应元件、光周期响应元件等[13]。但小麦HPPR基因的研究还未见报道。
小麦是中国的主要粮食作物,也是能最大限度适应恶劣环境条件的主要作物[14],在全球范围内也被广泛种植[15]。逆境胁迫是导致作物减产的主要因素,其中高温、干旱和盐碱是限制作物产量的主要非生物胁迫因素,严重影响了作物生长、发育、结实,是全球减产的重要原因[16-17]。探明小麦抗逆机理对小麦育种和栽培具有重要意义。
本研究根据拟南芥中RA生物合成相关基因HPPR4(AT2G45630)的序列信息,通过同源克隆获得HPPR4直系同源基因TaHPPR,并对该基因进行生物信息学分析及组织表达特异性分析。通过非生物胁迫处理,在盐胁迫下该基因表达的抑制效果最显著。以小麦抗盐品种‘京冬8’、较敏感品种‘京411’和敏感品种‘小白麦’为研究对象[18],进行小麦抗盐性表达特性分析,为研究其对逆境胁迫应答的反应及对小麦抗盐性的影响提供理论基础。
1 材料与方法
1.1 试验材料及其处理
本实验室保存的‘太原806’、‘小白麦’、‘京冬8’及‘京411’为供试材料[19]。将‘太原806’种子在25℃的培养室中进行16 h/d的光照水培培养。幼苗水培生长2周(14天)后,进行干旱(滤纸吸干水,空气中晾干)、脱落酸(200 mol/L ABA)、高 盐(250 mmol/L NaCl)、低温(4℃)的胁迫处理,然后取各种幼苗处理0、2、5、8、12、24 h后的叶片[20]。以同样的条件对‘京冬8’、‘京411’、‘小白麦’种子进行高盐(200 mmol/L NaCl)[21]胁迫处理,然后取各幼苗叶片,液氮冷冻,置于-80℃冰箱备用,便于进行接下来的目的基因胁迫表达分析。
取北京海淀种植的开花15天后‘太原806’的不同组织:根、茎、叶、小花(除雄蕊)、颖壳、叶鞘,液氮冷冻[22],置于-80℃冰箱备用,便于进行接下来的目的基因组织特异性表达分析。
取均匀一致的‘京冬8’、‘京411’及‘小白麦’的种子,用0.1% HgCl2消毒5 min,清水冲洗干净。发芽前未进行盐胁迫处理,在25℃的培养室中进行每天16 h的光照水培培养,种子萌发3天后,选取萌发一致的小麦种子放入96孔水培盒中。将水培盒置于15℃的光照培养箱中,每天12 h光照,12 h黑暗,3个品种都进行0、200 mmol/L的2个浓度梯度水平的盐胁迫处理,培养8天,然后统计根长、株高、干重、鲜重和根数的数据,用于分析小麦不同品种在盐胁迫下幼苗生长状况[23]。
1.2 提取RNA及合成cDNA
小麦不同组织器官和幼苗总RNA提取的主要试剂是Trizol、氯仿、异丙醇、无RNase的水[24],在提取过程中,要尽量减少RNA的降解。提取完成的RNA测定OD260/280值,同时通过1%琼脂糖凝胶电泳检测总RNA的完整性,置于-80℃冰箱备用。用PrimeScriptRT reagent Kit with gDNA Eraser(TaKaRa)试剂盒进行反转录反应,在PCR仪上进行变性、退火反应。合成后的cDNA置于-20℃冰箱保存备用。
1.3 小麦HPPR蛋白TaHPPR编码基因克隆
利用NCBI网站下载小麦基因TraesCS2B02G048000的序列。根据下载的序列设计引物TaHPPR-F/TaHPPR-R(表1),使用‘太原 806’的cDNA作为模板进行PCR扩增。扩增体系50 μL,包括2×Phanta Max Master Mix(Vazyme,南京)25 μL、上下游引物(10 μmol/L)各 2 μL、模板DNA(100 ng/L)2 μL、ddH2O 19 μL。扩增程序:95℃预变性3 min;95℃变性15 s,60℃退火15 s,72℃延伸1 min,35个循环;72℃延伸5 min,4℃保存。扩增产物为平末端,为了保证扩增产物的完整性,进行琼脂糖凝胶电泳检测PCR产物的质量,目的片段经胶回收纯化,并克隆到pEASY®-Blunt Cloning Ki(tTransGen,北京)载体上,加连接产物于Trans1-T1感受态细胞,涂板过夜,PCR鉴定阳性克隆,正确后每个样品选取3个独立克隆进行测序(北京六合华大基因公司)。

表1 引物名称及序列
1.4 TaHPPR蛋白的生物信息学分析
从NCBI(https://www.ncbi.nlm.nih.gov/)网站下载该基因的蛋白序列;利用Pfam(http://pfam.xfam.org/)网站预测TaHPPR蛋白结构。以TaHPPR的蛋白序列为目标序列,在Gramene(WWW.gramene.org/)网站搜索,下载粗山羊草(Aegilops tauschii)、二粒小麦(Triticum dicoccoides)、短柄草(Brachypodium distachyon)、拟南芥 (Arabidopsis thaliana)、水 稻 (Oryza sativa)、大 豆(Glycine max)的同源蛋白序列,并在Pfam(http://pfam.xfam.org/)网站中对上述蛋白序列进行保守结构域分析,使用DNAMAN8软件输出序列比对结果。对于系统发育分析,使用MUSCLE(http://www.ebi.ac.uk/Tools/msa/muscle/)进行多序列比对分析(参数使用网站默认参数),Alignment导出比对结果,在MEGA6.0软件中创建系统进化树,使用邻接法和泊松校正模型,其中检验建树质量的Bootstrap method(步长检验)值设置为1000次重复。
1.5 TaHPPR基因的表达分析
利用WheatExp(https://wheat.pw.usda.gov/Wheat Exp/)网站对小麦TaHPPR基因的表达进行预测分析,根据TaHPPR基因cDNA序列,避开保守结构域设计表达分析所用引物TaHPPR-qPCR-F/TaHPPR-qPCR-R(表1)。使用Actin作为内参基因,将之前提取的cDNA作为模板进行实时荧光定量PCR(qRT-PCR)分析。PCR反应体系为 25 μL,包括 TB Green PremixExTaqTMII(2×)(TliRNaseH Plus),Bulk 12.5 μL、上下游引物(10 μmol/L)各 1 μL、cDNA 模板 2 μL(100 ng),ddH2O 8.5 μL,轻弹管底将溶液混匀,短暂离心。PCR扩增于CFX96 Real-Time PCR Detection System仪(Bio-Rad,美国)上进行,反应程序为:95℃预变性30s;95℃变性5 s,60℃退火30 s,进行40个循环后增加熔解曲线环节,95℃变性5 s,60℃退火30 s,95℃变性15 s,用扩增曲线和熔解曲线鉴定引物特异性。每次反应作3次生物学重复,并采用2-△△CT法[25]计算基因相对表达量,同时计算其标准差。
1.6 小麦TaHPPR亚细胞定位分析
瞬时表达载体构建:利用同源克隆技术将小麦的TaHPPR基因CDS序列构建到p16318hGFP载体上,引物为TaHPPR-GFP-F/TaHPPR-GFP-R(表1),终载体为p16318hGFP-TaHPPR(35S::TaHPPR::GFP)。
1.7 小麦原生质体制备与转化
酶解液溶液配方(10 mL):15%纤维素酶(CellulaseR10)1 mL,4%离析酶(MacerozymeR10)1 mL,0.8 mol/L甘露醇5 mL,2 mol/L KCl 0.1 mL,0.2 mol/L 2-吗啉乙磺酸(MES,KOH调pH至5.7)1 mL,55℃溶解10 min后再加入1 mol/L CaCl20.1 mL,1.5% BSA 1 mL,H2O 0.8 mL。40%(v/v)PEG solution(10mL):PEG40004g,0.8mol/Lmannitol2.5 mL,1 mol/L CaCl21 mL,H2O 3 mL。W5(500 mL):NaCl 9.0 g,CaCl218.4 g,2 mol/L KCl 1.25 mL,0.2 mol/L MES 5 mL。MMG solution(50 mL):MgCl20.152 g,0.2 mol/L MES 1 mL,0.8 mol/L mannitol 25 mL。
新鲜配制酶解液,用0.45 μm的滤头过滤除菌。幼苗水培1周(7天)后,取叶片制备原生质体。剪取中部生长良好的叶片用刀片切成0.5~1 mm宽的叶条,将切好叶条放入酶解液中,并用镊子让叶子完全浸入酶解液。用真空泵于黑暗中抽30 min。在室温中50 r/min 28℃摇动,酶解5 h,酶解液变绿时轻轻摇晃培养皿。用等体积的W5溶液稀释含有原生质体的酶液,过滤除去未溶解的叶片。用2.0 mL的离心管,4℃离心1~2 min沉淀原生质体,去上清,然后用1000 μL冰上预冷的W5溶液轻柔重悬原生质体。在冰上静置30 min。离心去上清,然后用适量MMG溶液,重悬原生质体,加入10~20μL的质粒DNA,用移液器轻柔混匀后加入110μL PEG溶液,轻柔拍打离心管完全混合,诱导转化混合物20~30 min。室温下用400~440 μL W5溶液稀释转化混合液,然后轻柔上下颠倒离心管使之混合完全以终止转化反应。室温下离心2分钟然后去除上清。再加入1 mL W5溶液悬浮清洗一次,离心2 min去上清。加入200 μL W5溶液25℃过夜避光培养。激光共聚焦显微镜下观察GFP标签表达。黄化苗原生质体的制备,参照上述方法。
2 结果与分析
2.1 TaHPPR基因的克隆及其编码蛋白的结构分析
以‘太原806’的cDNA为模板,利用引物TaHPPRF/TaHPPR-R(表1)进行PCR扩增,扩增产物经1%琼脂糖凝胶电泳检测后,得到大小为1000 bp左右的单一条带(如图1)。将目的片段纯化、克隆并测序后,得到长度为975 bp的序列。通过BLAST比对测序结果确定目的基因结构。TaHPPR转录本长度为975 bp,编码324个氨基酸。利用NCBI(https://www.ncbi.nlm.nih.gov/)的 Conserved Domain Search Service(CD Search),通过分析TaHPPR基因编码的氨基酸序列,发现其含有NADB-Rossmann superfamily,TaHPPR属于HPPR蛋白家族(如图2)。
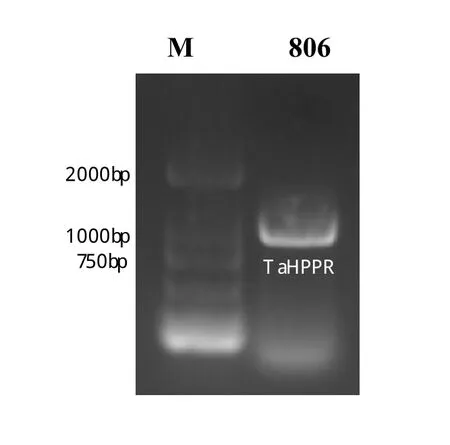
图1 TaHPPR凝胶电泳扩增产物

图2 TaHPPR保守结构域
2.2 TaHPPR同源蛋白序列的比对及进化分析
对TaHPPR及其同源蛋白序列比对结果发现,其与来源于二粒小麦(TRIDC2BG004220)、粗山羊草(AET2Gv20055400)、短柄草(BRADI_3g19270v3)、水稻(Os04g0107300)、大豆(GLYMA_07G082000)、拟南芥(AT2G45630)的NAD-binding domain蛋白序列相似性分别为100%、84%等。不同物种来源的HPPR蛋白均包含NAD-binding domain结构域,且保守性较高(图3)。利用邻接法构建进化树,系统进化分析结果表明,单子叶和双子叶植物中HPPR蛋白可分为两类,其中小麦与二粒小麦亲缘关系最近(图4)。

图3 TaHPPR与其他6种植物HPPR序列比对
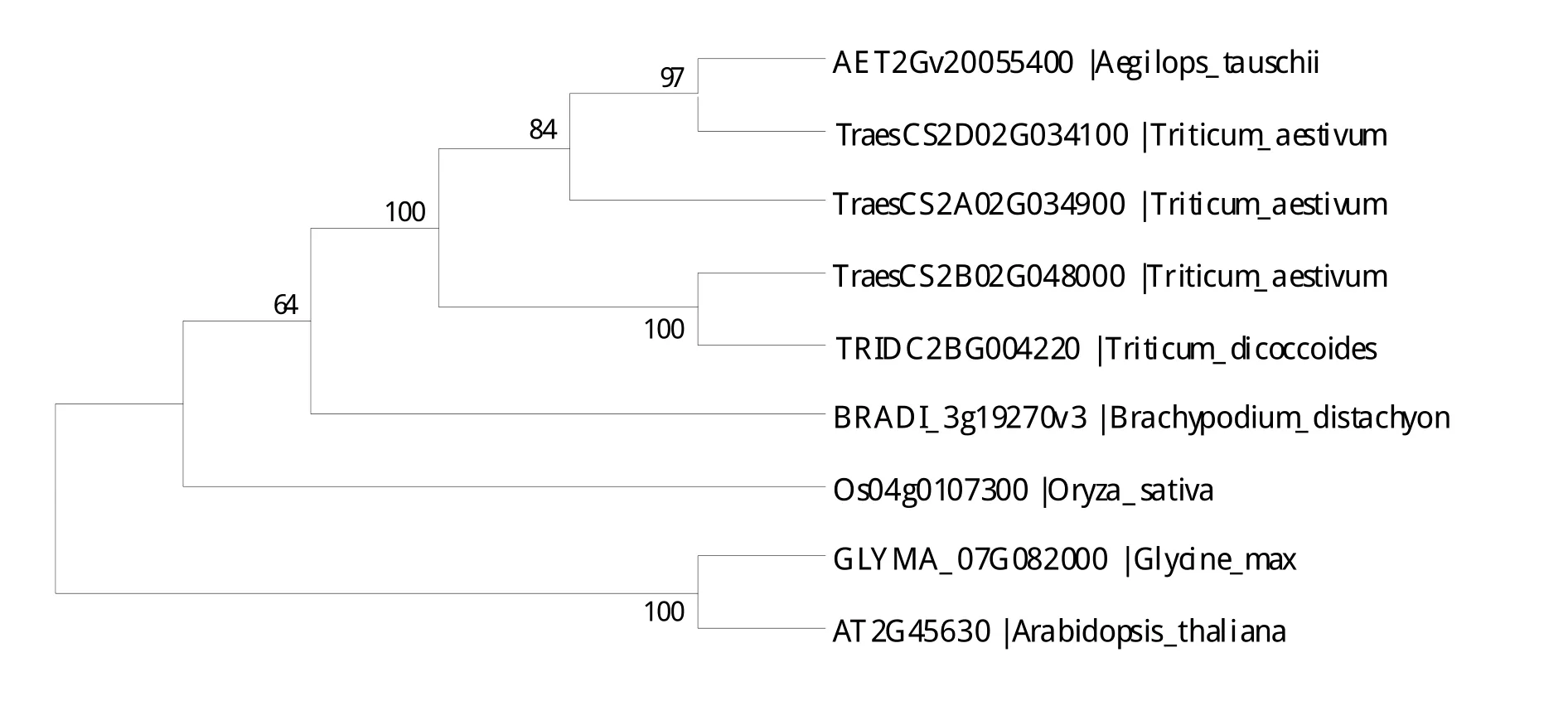
图4 TaHPPR与其他6种植物HPPR系统进化分析
2.3 TaHPPR基因的组织特异性表达分析
利用WheatExp(https://wheat.pw.usda.gov/Wheat Exp/)网站下载转录组数据,对小麦TaHPPR基因不同组织的表达分析表明:该基因在籽粒、叶、根、穗、茎中均有表达,而在根中表达量最高(图5)。将1.1中保存的‘太原806’供试材料反转录cDNA进行荧光定量PCR,结果表明:TaHPPR基因在根中高度表达,在其他组织中相对表达量较低,此结果与小麦转录组数据库结果基本吻合,TaHPPR基因可能在小麦根器官发育发挥作用。
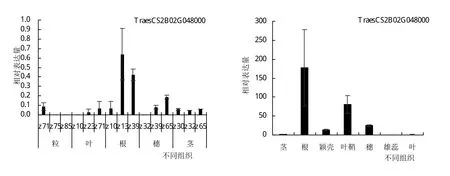
图5 小麦TaHPPR基因在不同组织器官中的相对表达量
2.4 TaHPPR基因在非生物胁迫下的表达分析
为进一步了解TaHPPR基因对逆境胁迫的响应,以提取的‘太原806’不同胁迫处理材料的cDNA作为模板,采用荧光定量PCR技术对高盐、干旱、低温和脱落酸(ABA)处理下的小麦幼苗中该基因的表达情况进行分析(图6)。结果发现:在高盐胁迫处理下,TaHPPR表达量随处理时间延长持续下降,说明该基因表达受高盐胁迫抑制;在干旱胁迫处理下,该基因表达量在2 h下降,在5 h上升,然后又持续下降,但表达量均低于未处理;在低温处理下该基因表达量均有所下降,8 h达到最低值;在ABA处理下该基因表达量持续下降,24 h基本回复正常水平。以上结果表明,TaHPPR基因在高盐、干旱、低温、ABA诱导下表达均受到不同程度抑制,其中盐胁迫下该基因表达的抑制效果最显著。
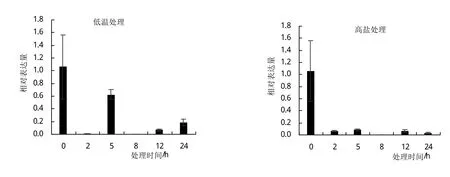
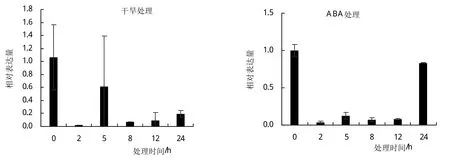
图6 小麦TaHPPR基因在不同胁迫处理下的相对表达量
2.5 小麦不同抗盐性品种中TaHPPR基因的表达分析
小麦不同品种间抗盐性存在明显差异,为进一步研究该基因的盐胁迫调控模式,选用了已报道过的抗盐品种‘京冬8’、较敏感品种‘京411’和敏感品种‘小白麦’[18]进行盐胁迫处理。为验证‘京冬8’、‘京411’、‘小白麦’的抗盐性,本研究对其进行了高盐胁迫的鉴定试验。所用的3个品种在受到相同浓度(200 mmol/L)的NaCl高盐胁迫后,根长和株高、根数、干重、鲜重均低于对照组。其中3个品种处理后的株高,都与对照组存在极显著差异;‘京411’处理后的根长存在极显著差异;‘京411’与‘小白麦’处理后的鲜重存在极显著差异,‘小白麦’干重实验组与对照组存在极显著差异。3个品种根数的处理组与对照组差异不显著。综上所述可以判断‘京冬8’的抗盐性明显高于‘京411’和‘小白麦’(如图7)。
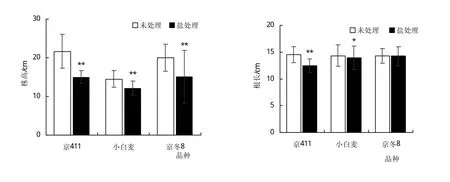
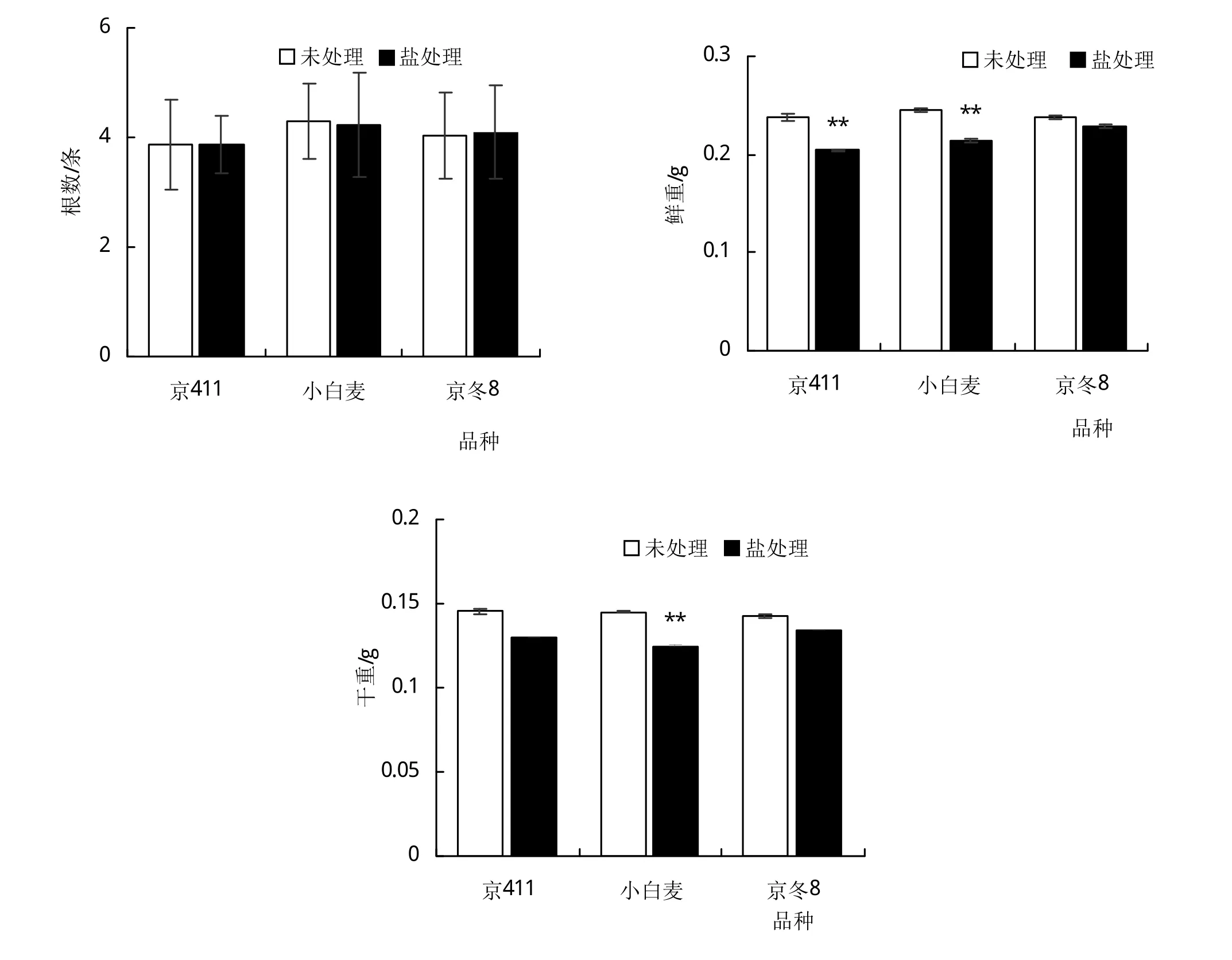
图7 小麦不同品种的抗盐性鉴定
为了进一步了解高盐胁迫条件下TaHPPR基因的表达情况,对抗盐性不同的3个品种的盐胁迫材料进行了实时荧光定量试验。结果显示该基因在‘京411’和‘小白麦’的盐胁迫处理后的表达量均低于未处理,而在抗盐性更强的‘京冬8’中,表达量高于对照组,且在24 h达到最高值,说明该基因可能参与抗盐的调节(如图8)。
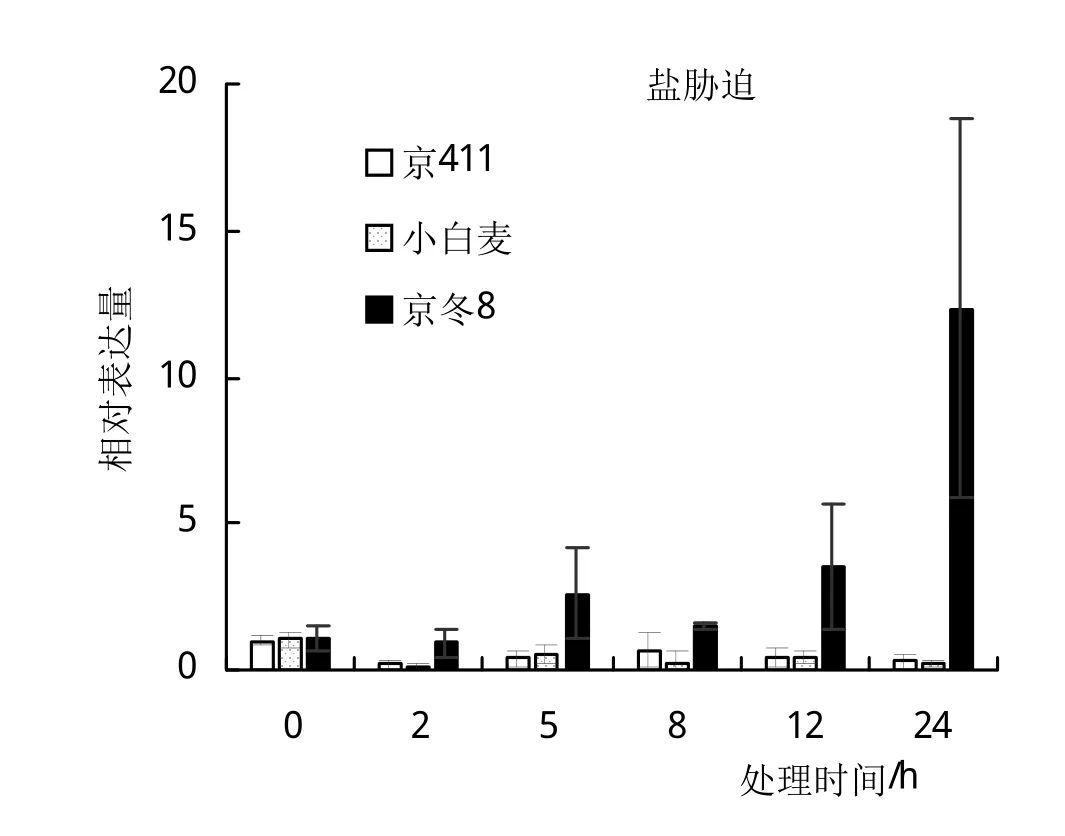
图8 小麦TaHPPR基因在不同品种盐胁迫处理下的相对表达量
2.6 TaHPPR的亚细胞定位
通过瞬时表达系统,利用PEG介导转化的方法转化小麦原生质体,使用激光共聚焦显微镜观察叶片原生质体细胞的GFP荧光位置,确定TaHPPR蛋白在植物细胞内的定位。结果(图9)表明:明场下观察所有细胞具有完整、规则的细胞形态,mCherry通道下,细胞内叶绿体自发荧光清楚,叶绿体形态良好,表明细胞生长发育正常。在488 nm激发光下,TaHPPR-GFP融合蛋白的绿色荧光清晰的聚集在细胞质中有点状分布,而在只含GFP的对照细胞35S::GFP中,绿色荧光信号没有明确的细胞器定位,绿色荧光在全细胞范围弥散。将所有通道图片整合后的Merged图片显示,初步判断TaHPPR-GFP融合蛋白定位于线粒体中。
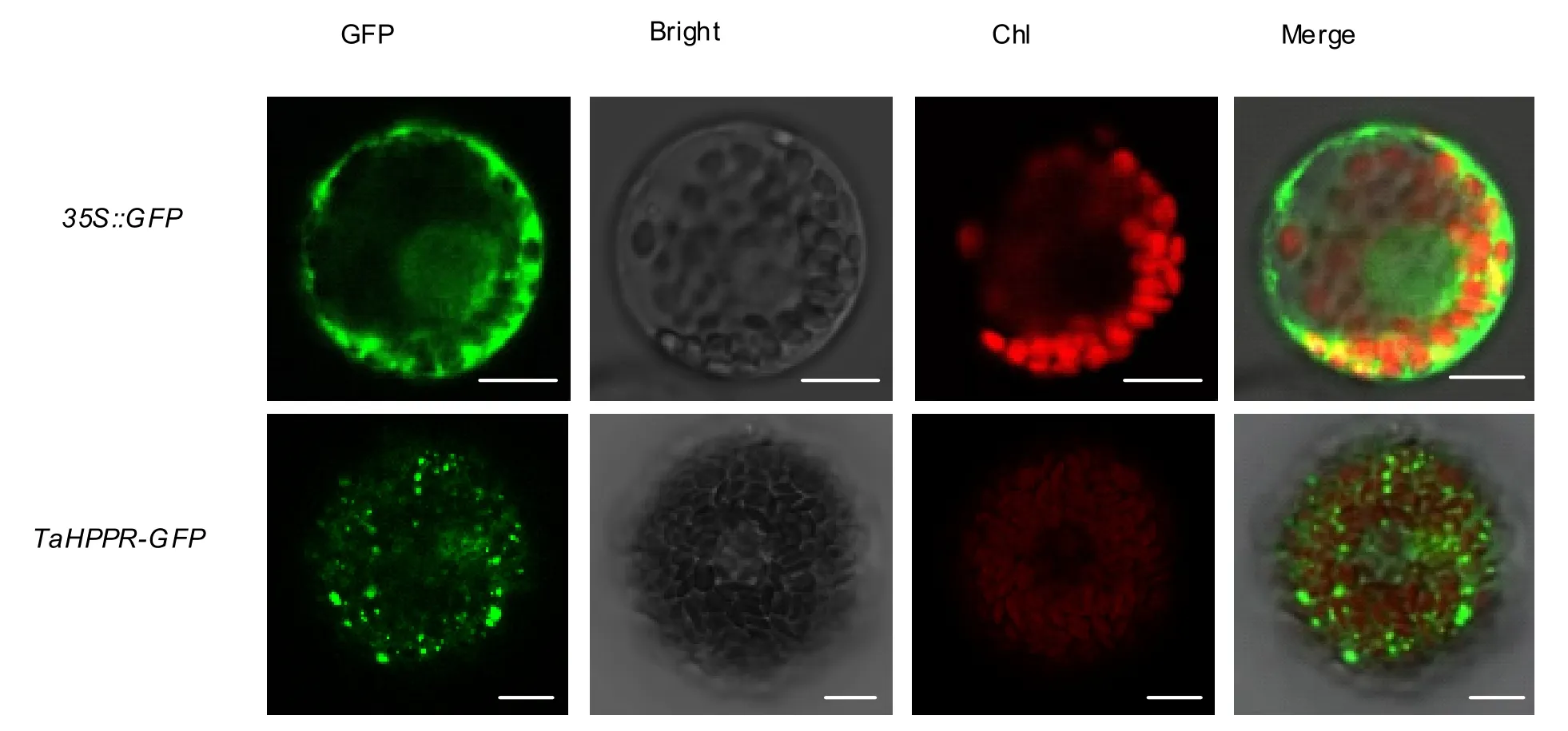
图9 小麦TaHPPR蛋白的亚细胞定位
3 讨论与结论
HPPR基因在植物中普遍存在,并且已经在拟南芥、丹参和紫苏等植物中被报道[13]。然而作为世界最重要的粮食作物之一的小麦,目前HPPR相关基因尚未被报道。本研究基于拟南芥基因HPPR4基因序列,在小麦中同源克隆了该基因,序列比对结果表明,所有HPPR蛋白均包含NAD-binding domain结构域,且位置完全相同,进一步分析发现TaHPPR属于HPPR蛋白家族。
TaHPPR基因在根、茎、叶、花、籽粒中均有表达,在根中高度表达,在其他组织中相对表达量较低,此结果与小麦转录组数据库结果基本吻合,同时与拟南芥HPPR3主要在根中表达、HPPR4主要在毛状根和叶脉中毛状体表达、丹参SmHPPR在茎和根中高度表达但在叶中弱表达、夏枯草PvHPPR在根中的相对表达量最高的结果一致。该基因在小麦根器官表达量最高,原因可能是小麦等植物的耐盐性与根尖细胞质膜上ATPase活性之间存在着非常显著的正相关,一定范围内的盐胁迫,引起植物体内Na+的积累,导致根尖细胞质膜上的ATPase活化,因此增加了根细胞对Na+的清除并减少了Na+积累引起的破坏[26];另一方面,小麦的根中基本不含有叶绿体,主要充斥着线粒体细胞器,进一步的亚细胞定位结果显示TaHPPR蛋白定位于线粒体中,这一结果预示着其功能与线粒体有关,该基因可能通过线粒体影响活性氧的变化参与逆境胁迫调控过程。亚细胞定位结果与拟南芥HPPR1定位于过氧化物酶体、HPPR2和HPPR3、HPPR4定位于细胞质中,丹参SmHPPR定位于细胞质中,夏枯草PvHPPR定位在内质网中的结果存在差异,小麦作为六倍体植物基因家族成员众多,可能功能调控更加细致多元化,具体原因还需进一步研究。
前人研究表明‘京冬8’品种在抗盐方面表现为高抗、‘京411’表现为较敏感和‘小白麦’表现为中度敏感,本研究的结果与前人研究结果相一致,TaHPPR基因在不同耐盐品种中的差异性表达变化说明TaHPPR基因的表达可作为耐盐性检测的参考指标,对杂交育种具有现实意义。TaHPPR基因在高盐、干旱、低温、ABA诱导下表达均受到不同程度抑制,其中盐胁迫下该基因表达的抑制效果最显著。在此基础上,对抗盐性不同的品种进行盐胁迫处理,结果显示:在‘京411’和‘小白麦’的盐胁迫处理后的表达量均低于未处理组,而在耐盐品种‘京冬8’中,盐胁迫下TaHPPR基因表达上调,胁迫处理约24 h后表达量达到最高,说明该基因参与盐胁迫应答,但TaHPPR基因通过何种途径调控小麦抗盐性,还需进一步研究。本研究推测,TaHPPR基因的精准表达调控是小麦盐胁迫应答的重要指标,上述推论为小麦逆境胁迫应答反应及小麦抗盐性研究提供了新的思路和方法。
小结:本文研究了小麦的羟基苯丙酮酸还原酶基因,其编码324个氨基酸且含有NAD-binding domain结构域。系统进化分析发现了TaHPPR基因在不同植物物种间的进化保守性和变异性。组织表达分析发现TaHPPR基因主要在小麦根中表达;TaHPPR基因在低温、干旱、高盐和ABA胁迫处理下表达均有所下降;在抗盐品种中,TaHPPR基因表达升高,而在敏感品种中,TaHPPR基因表达受到抑制。TaHPPR蛋白主要在线粒体中表达,过表达TaHPPR基因可能增加小麦的抗盐性,其反应机制还需进一步研究。

